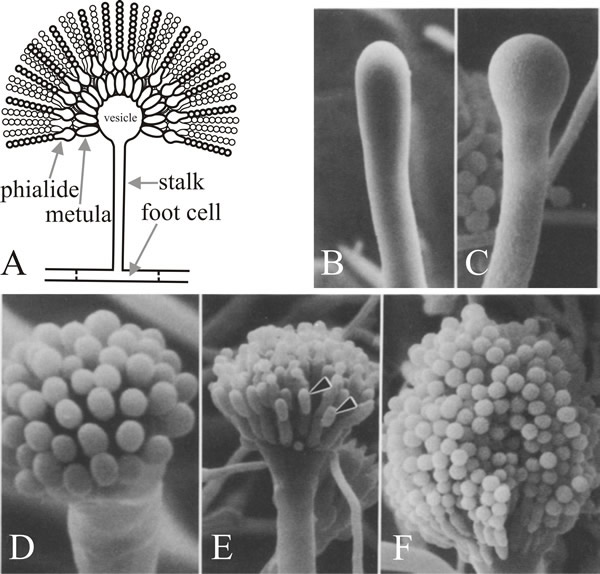
De cel waaruit de vertakking ontstaat is de conidiofore voetcel, die van andere vegetatieve cellen te onderscheiden is doordat hij een bruin gepigmenteerde secundaire wandverdikking heeft aan de binnenzijde van zijn oorspronkelijke wand. De stengel groeit apicaal tot hij een lengte van ongeveer 100 µm bereikt, wanneer de apex zwelt om het conidiofore blaasje te vormen, dat een diameter van ongeveer 10 µm heeft. Een enkele rij van talrijke primaire sterigmata, metulae genaamd, ontluiken dan uit het blaasje en secundaire sterigmata, de phialiden, ontluiken uit de blootliggende apices van de metulae. De phialiden zijn de stamcellen die vervolgens herhaalde asymmetrische delingen ondergaan om de lange ketens van enteroblastische conidia te vormen met een diameter van ongeveer 3 µm (Fig. 7).
Klassieke genetische analyse, door isolatie en analyse van mutanten, heeft de genetische basisstructuur van Aspergillus conidiation vastgesteld. Er werd geschat dat tussen 300 en 1.000 genloci betrokken waren bij de conidiatie door de mutatiefrequenties op loci die de conidiatie beïnvloeden te vergelijken met die voor andere functies (Martinelli & Clutterbuck, 1971). Analyse van mRNA-soorten gaf aan dat ongeveer 6000 tot expressie kwamen in vegetatief mycelium en nog eens 1200 in culturen die conidioforen en conidia bevatten; 200 van deze extra mRNAs werden in de conidia zelf gevonden. Slechts ongeveer 2% van de mutanten van A. nidulans die geen conidia hadden, vertoonden defecten in de stadia van conidiofoorgroei en -ontwikkeling, en 85% van de conidiamutanten vertoonden ook defecten in de vegetatieve groei van de hyfen en in het bereiken van de competentie.
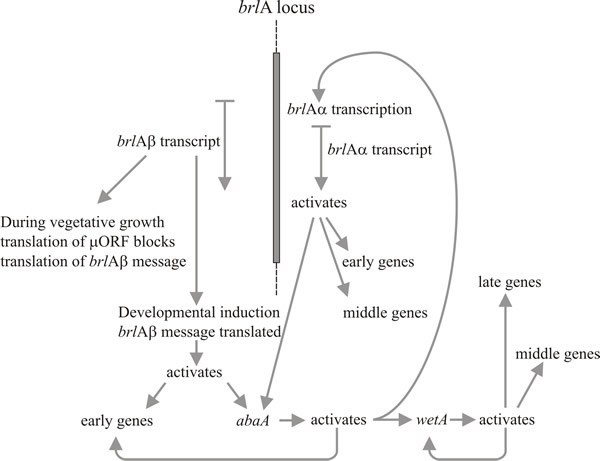
Twee genen in het bijzonder spelen een sleutelrol in de morfogenese van de conidiofoor: dit zijn het ‘bristle’ (brlA) gen, dat defecten vertoont in de vorming van blaasjes en metula, en ‘abacus’ (abaA), waarbij conidia worden vervangen door kralen van hypha-lengtes, zodat het vermoedelijk defect is in de conidiale ontluiking uit de phialide en de uiteindelijke septatie. Een derde gen, wetA, is defect in een vroeg stadium van de rijping van de sporen. Conidia van wetA mutanten missen pigment en hydrofobiciteit; ze autolyseeren na een paar uur en brengen een reeks sporenspecifieke mRNA’s niet tot expressie. Het wetA-gen-transcript ontbreekt in brlA- en abaA-mutanten (d.w.z. brlA en abaA zijn epistatisch ten opzichte van wetA), en studies van dubbelmutanten tonen aan dat deze drie genen werken in de volgorde: brlA → abaA → wetA.
Een opvallend kenmerk van de mutatie-analyse van de conidiofoorontwikkeling bij A. nidulans is dat mutanten van alleen deze drie genen defecten veroorzaken in de conidiofoor- en sporenmorfogenese, terwijl tot wel 1000 andere genloci leiden tot het uitblijven van conidiatie wanneer ze gemuteerd zijn. Dit impliceert dat brlA, abaA en wetA regulatoren zijn die de expressie integreren van andere genen die nodig zijn voor conidiation, maar er zelf niet specifiek voor bedoeld zijn. Veel van de Aspergillus conidiatiemutanten waren ook defect in de sexuele voortplanting, dus een andere conclusie die getrokken kan worden is dat er een zekere zuinigheid is in het gebruik van morfogenetische genen in verschillende ontwikkelingsprocessen. Vermoedelijk maken verschillende ontwikkelingswijzen gebruik van structurele genen die niet uniek zijn voor de ontwikkeling, maar die functioneren in talrijke paden, waarbij hun ontwikkelingsspecificiteit wordt toegekend door de regulatoren waarop zij reageren. Dit wordt belichaamd door het idee dat de sleutel tot de ontwikkeling van eukaryoten ligt in het vermogen om relatief weinig regulerende genen te gebruiken om de activiteiten van vele andere te integreren.
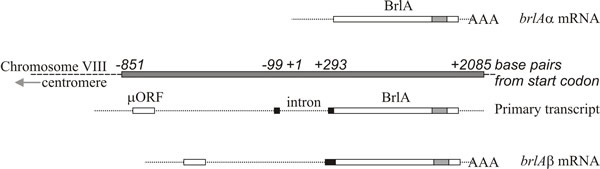
Moleculaire analyse ondersteunt de interpretatie dat brlA, abaA en wetA regulatoren zijn; de brlA-sequentie codeert voor een zinkvingereiwit, dat een sequentiespecifieke DNA-bindende transcriptie-activator is van ontwikkelingsgereguleerde doelgenen (Fig. 8). Maar dat is niet het hele verhaal, want het brlA product heeft verschillende affiniteiten voor verschillende doelgenen. Inderdaad, de brlA locus bestaat uit overlappende transcriptie-eenheden (Fig. 9), waarvan de stroomafwaartse eenheid brlAα wordt genoemd en de stroomopwaartse eenheid brlAβ; tussen hen in lossen hun producten twee klassieke ontwikkelingsproblemen op, namelijk hoe te reageren op een signaal en hoe die reactie te handhaven wanneer het signaal is verdwenen.
De twee brlA-transcriptie-eenheden delen hetzelfde leesframe over het grootste deel van hun lengte, maar brlAβ heeft een extra 23 aminozuurresiduen aan het amino-terminale uiteinde van dat leesframe, en zijn transcript bezit ook een afzonderlijk leesframe van 41 aminozuurresiduen (µORF genaamd) in de buurt van zijn 5′-terminus. Het µORF product onderdrukt de translatie van het stroomafwaartse leeskader (BrlA) en hoewel het brlAβ transcript in vegetatieve hyfen kan worden gedetecteerd, wordt het BrlA peptide niet geproduceerd. De door µORF veroorzaakte repressie wordt enkel opgeheven wanneer het mycelium competent is, wat waarschijnlijk gesignaleerd wordt als een stikstofbeperking (een vaak voorkomend omgevingssignaal voor het initiëren van sporulatie in Ascomycota), waardoor de aminoacyl-tRNA pools verminderen en de translatieregulatie door µORF verstoord wordt. Wanneer de werking van µORF wordt gestoord, kan het BrlA peptide worden vertaald vanuit een bestaand transcript.
De ontdekker van dit proces beschreef de activering van de conidiation pathway als ’translational triggering’ (Timberlake, 1993), wat suggereert dat de translational trigger een manier is om de differentiatie gevoelig te maken voor de voedingsstatus van de hypha. De competente hyfa is dus klaar voor de ontwikkeling van conidioforen, maar onomkeerbare activering van de conidiatieroute wordt verhinderd door een translationele repressie die de vegetatieve groei in stand houdt tot de sporulatieomstandigheden ideaal zijn.
Activering van brlA wordt daarom gezien als de eerste stap in de ontwikkeling van conidioforen, en zijn produkt activeert op zijn beurt een panel van conidiation-specifieke genen, waaronder de volgende regulator, abaA. Het product abaA is eveneens een DNA-bindend transcriptioneel regulatie-eiwit dat de expressie van de door brlA geïnduceerde structurele genen versterkt. De genen brlA en abaA zijn wederzijdse activatoren, want abaA activeert ook brlA. Natuurlijk moet de expressie van brlA plaatsvinden voordat abaA tot expressie kan komen, maar de daaruit voortvloeiende abaA-activatie van brlA versterkt de expressie van laatstgenoemd gen en maakt de voortgang van de pathway in feite onafhankelijk van gebeurtenissen van buitenaf. Het abaA-product activeert ook bijkomende structurele genen en het laatste regulerende gen, wetA, dat spore-specifieke structurele genen activeert. Aangezien brlA en abaA niet tot expressie komen in differentiërende conidia, is wetA waarschijnlijk betrokken bij het inactiveren van hun expressie in de sporen (en misschien ook in de fialide; wanneer de huidige sporenkern het rijpingsstadium bereikt waarvoor genen nodig zijn die door wetA worden gereguleerd, moeten de fialide-kernen worden “teruggedraaid” naar de conidium-initiatie-toestand om de vorming van de volgende spore te starten). De expressie van wetA wordt aanvankelijk in de fialide geactiveerd door de opeenvolgende werking van brlA en abaA, en wordt vervolgens geautoreguleerd (het wetA-product activeert de wetA-transcriptie). Positieve autoregulatie van wetA handhaaft vervolgens de expressie ervan nadat het conidium (fysisch en cytologisch) van de fialide is gescheiden.
Timberlake (1993) noemt dit mechanisme feedback fixatie: wederkerige activering, feedback activering en autoregulatie van de kernregulerende sequenties versterken de expressie van de hele pathway, waardoor deze onafhankelijk wordt van de externe omgevingscues die haar initieerden en waardoor de spore kan blijven rijpen, zelfs na scheiding van de fialide. Conidiofoorontwikkeling is, net als vele andere morfogenetische processen, van nature verdeeld in opeenvolgende stappen. Dit regulatorisch netwerk laat zien hoe translationele triggering een morfogenetische route kan relateren aan de ontwikkeling van competentie enerzijds, en aan initiatie in antwoord op omgevingscue(s) anderzijds. Na de initiatie resulteert feedback fixatie in ontwikkelingsdeterminatie in de klassieke embryologische zin van voortzetting van de morfogenese, zelfs indien verwijderd van de initiërende omgeving.
We hebben er in dit deel bewust voor gekozen om onze beschrijving te baseren op onderzoek van ongeveer 50 jaar geleden, dat begon met de isolatie van een groot aantal mutaties met veranderde conidiatiefenotypes en werd voortgezet met ‘klassieke’ studies van gen segregaties en gen complementatie (Martinelli & Clutterbuck, 1971). Behalve dat dit laat zien hoe ons begrip van sporulatie tot stand is gekomen, toont het de waarde aan van het gebruik van deze ‘ouderwetse’ technieken om dergelijke verschijnselen te onderzoeken.
Het uitgebreide onderzoek dat is voltooid naar de moleculaire mechanismen die ten grondslag liggen aan de groei en ontwikkeling van Aspergillus, kan echter niet worden genegeerd. Deze studies hebben bevestigd dat de sleutelgebeurtenis in sporulatie de activering is van de zinkvingertranscriptiefactor die wordt gecodeerd door brlA, en dat abaA- en wetA-genen noodzakelijke regulatoren zijn van conidiatie. De door abaA gecodeerde transcriptiefactor wordt geactiveerd door brlA na de differentiatie van de metulae en tijdens de middenstadia van de conidiofoorontwikkeling; en het wetA-gen, geactiveerd door abaA, functioneert in de late fase van de conidiatie en stuurt de synthese van cruciale celwandcomponenten en transformeert het metabolisme van het rijpende conidium. In Aspergillus nidulans vormen deze drie genen de centrale regulatorische pathway, die samen met andere genen de conidiation-specifieke genexpressie en de volgorde van genactivering controleert die betrokken zijn bij de verwerving van ontwikkelingscompetentie, conidiofoorontwikkeling en sporenrijping (Lee et al., 2016).
Vele aspecten van deze ontwikkelingspathways zijn geconserveerd in andere aspergilli. Leden van het geslacht Aspergillus behoren tot de meest voorkomende schimmels, en planten zich allemaal aseksueel voort door lange ketens van conidia te vormen. Verscheidene soorten, waaronder Aspergillus oryzae en Aspergillus niger, worden in de industrie gebruikt voor de productie van enzymen en de verwerking van levensmiddelen, terwijl Aspergillus flavus verantwoordelijk is voor voedselbederf door de productie van de krachtigste in de natuur voorkomende carcinogenen, de aflatoxinen. Een andere zorgwekkende soort is de opportunistische menselijke ziekteverwekker Aspergillus fumigatus, die een massaal aantal kleine hydrofobe conidia produceert als voornaamste verspreidingsmiddel en die in de ontwikkelde landen een wijdverbreide schimmelziekteverwekker in de lucht is geworden. Bij immuungecompromitteerde patiënten veroorzaakt A. fumigatus een invasieve aspergillose met een hoog sterftecijfer. De BrlA-AbaA-WetA ontwikkelingssignaleringsroute is geconserveerd in de conidiatie van deze Aspergillus-soorten (Yu, 2010; Tao & Yu, 2011; Krijgsheld et al., 2013). Verder hebben proteomische, transcriptomische en metabolomische studies een gedetailleerd beeld gegeven van de dynamische veranderingen die optreden in vele duizenden genen, transcripten, enzymen en metabolische reacties tijdens de vorming, rijping, dormantie en kieming van Aspergillus conidia (van Leeuwen et al., 2013; Novodvorska et al., 2016; Teertstra et al., 2017).
Updated juli, 2019