Ionisatie-energieën van s- en p-blok elementen
Ionisatie-energieën van de elementen in de derde rij van het periodiek systeem vertonen hetzelfde patroon als die van Li en Be (Tabel Tabel PaginaIndex{2}): De opeenvolgende ionisatie-energieën nemen gestaag toe wanneer elektronen worden verwijderd uit de valentiebanen (3s of 3p, in dit geval), gevolgd door een bijzonder grote toename van de ionisatie-energie wanneer elektronen worden verwijderd uit gevulde kernniveaus, zoals aangegeven door de vetgedrukte diagonale lijn in Tabel \(\PageIndex{2}\). Zo komt in de derde rij van het periodiek systeem de grootste toename van de ionisatie-energie overeen met het verwijderen van het vierde elektron uit Al, het vijfde elektron uit Si, enzovoort – dat wil zeggen het verwijderen van een elektron uit een ion dat de valentie-elektronenconfiguratie heeft van het voorgaande edelgas. Dit patroon verklaart waarom de chemie van de elementen normaal gesproken alleen valentie-elektronen omvat. Er is te veel energie nodig om de binnenste elektronen te verwijderen of te delen.
| Element | (I_1) | (I_2) | (I_3) | (I_4) | (I_5) | (I_6) | (I_7) |
|---|---|---|---|---|---|---|---|
| *Inner-shell elektron | |||||||
| Na | 495.8 | 4562.4* | – | – | – | ||
| Mg | 737.7 | 1450.7 | 7732.7 | – | – | – | |
| Al | 577.4.4 | 1816.7 | 2744.8 | 11.577.4.4 | – | – | |
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16.090.6 | – | – |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4.3 |
| Cl | 1251.2 | 2297.7 | 3822 | 5158.6 | 6540 | 9362 | 11.018,2 |
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 |
Voorbeeld: Hoogste Vierde Ionisatie Energie
Voorspel, uitgaande van hun plaats in het periodiek systeem, welk van deze elementen de hoogste vierde ionisatie energie heeft: B, C, of N.
Gegeven: drie elementen
Vraag: element met hoogste vierde ionisatie-energie
Strategie:
- Lijst de elektronenconfiguratie van elk element.
- Bepaal of elektronen worden verwijderd uit een gevulde of gedeeltelijk gevulde valentieschil. Voorspel welk element de hoogste vierde ionisatie-energie heeft, erkennende dat de hoogste energie overeenkomt met de verwijdering van elektronen uit een gevulde elektronenkern.
Oplossing:
A Deze elementen staan allemaal in de tweede rij van het periodiek systeem en hebben de volgende elektronenconfiguraties:
- B: 2s22p1
- C: 2s22p2
- N: 2s22p3
B De vierde ionisatie-energie van een element (I_4) is gedefinieerd als de energie die nodig is om het vierde elektron te verwijderen:
Omdat koolstof en stikstof respectievelijk vier en vijf valentie-elektronen hebben, komt hun vierde ionisatie-energie overeen met het verwijderen van een elektron uit een gedeeltelijk gevulde valentieschil. De vierde ionisatie-energie voor boor komt echter overeen met het verwijderen van een elektron uit de gevulde 1s2-subschil. Hiervoor zou veel meer energie nodig moeten zijn. De werkelijke waarden zijn als volgt: B, 25.026 kJ/mol; C, 6223 kJ/mol; en N, 7475 kJ/mol.
Oefening: Laagste Tweede Ionisatie Energie
Vanuit hun plaats in het periodiek systeem, voorspel welk van deze elementen de laagste tweede ionisatie energie heeft: Sr, Rb, of Ar.
Antwoord
(\ce{Sr}})
De eerste kolom van gegevens in Tabel \(\PageIndex{2}}) laat zien dat de eerste ionisatie-energie de neiging heeft om toe te nemen in de derde rij van het periodiek systeem. Dit komt doordat de valentie-elektronen elkaar niet goed afschermen, waardoor de effectieve kernlading over de hele rij gestaag toeneemt. De valentie-elektronen worden daardoor sterker aangetrokken tot de kern, zodat de atoomgrootte afneemt en de ionisatie-energie toeneemt. Deze effecten vertegenwoordigen twee kanten van dezelfde medaille: door sterkere elektrostatische interacties tussen de elektronen en de kern neemt de energie die nodig is om de elektronen te verwijderen verder toe.
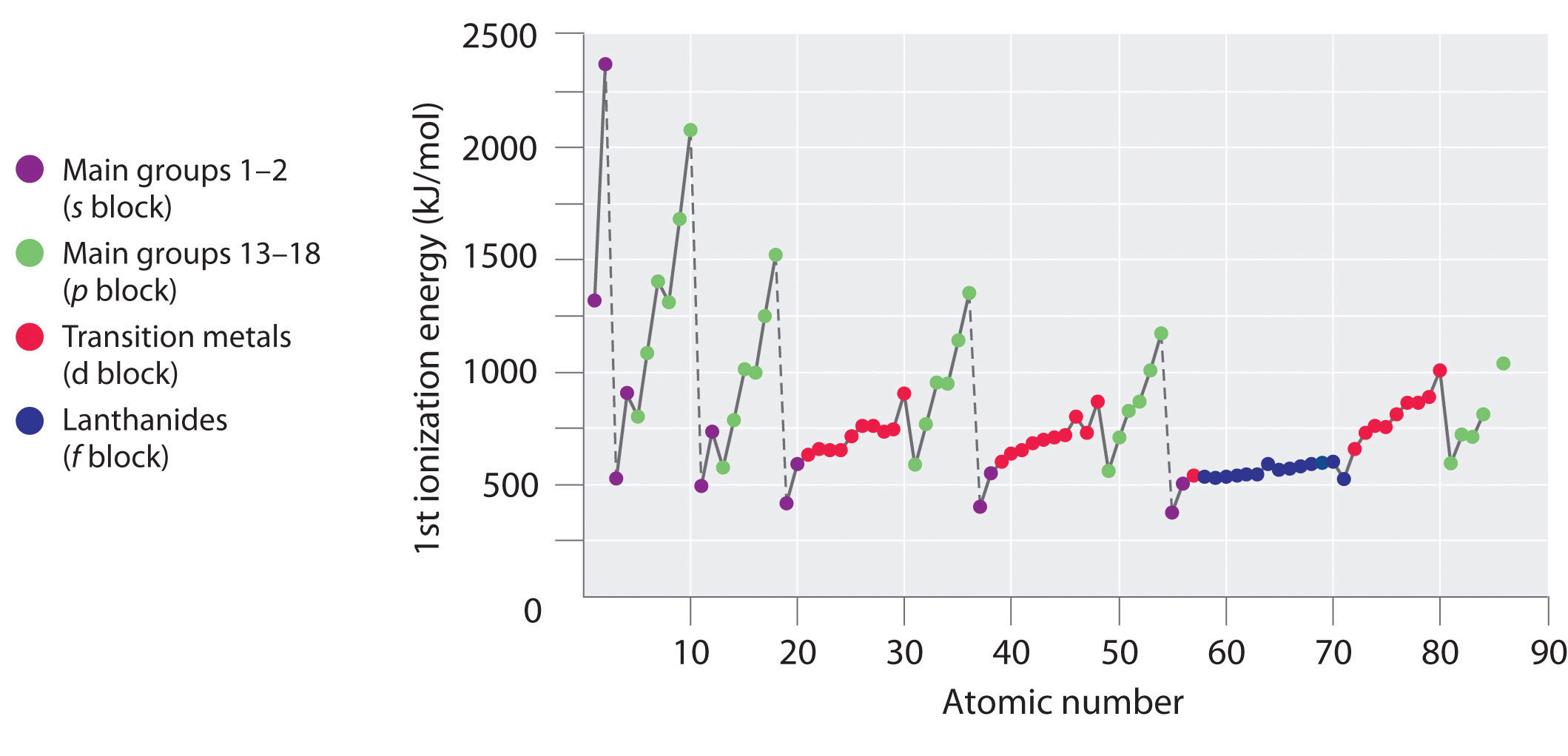
De eerste ionisatie-energie neemt echter af bij Al (3s23p1) en bij S (3s23p4). De elektronenconfiguraties van deze “uitzonderingen” geven het antwoord waarom. De elektronen in de gevulde 3s2-subschil van aluminium zijn beter in het afschermen van het 3p1-elektron dan in het afschermen van elkaar tegen de kernlading, zodat de s-elektronen dichter bij de kern doordringen dan het p-elektron doet en het p-elektron gemakkelijker wordt verwijderd. De afname bij S ontstaat doordat de twee elektronen in dezelfde p-baan elkaar afstoten. Hierdoor is het S-atoom iets minder stabiel dan anders zou worden verwacht, zoals geldt voor alle elementen van groep 16.
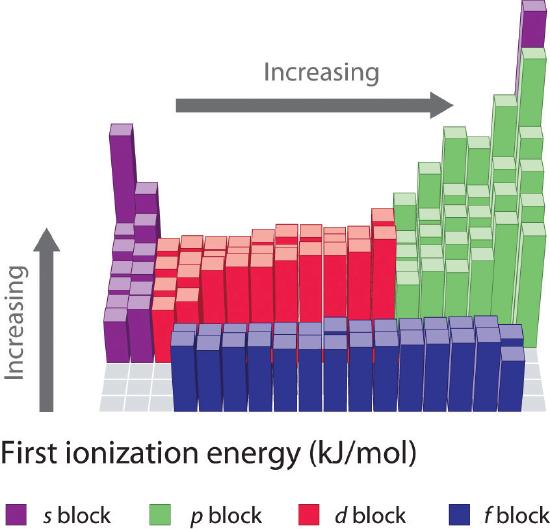
De eerste ionisatie-energieën van de elementen in de eerste zes rijen van het periodiek systeem zijn uitgezet in figuur {PageIndex{1}\) en numeriek en grafisch weergegeven in figuur {PageIndex{2}\). Deze figuren illustreren drie belangrijke tendensen:
- De veranderingen in de tweede (Li naar Ne), vierde (K naar Kr), vijfde (Rb naar Xe), en zesde (Cs naar Rn) rij van de s- en p-blokken volgen een patroon dat vergelijkbaar is met het patroon dat beschreven is voor de derde rij van het periodiek systeem. De overgangsmetalen zijn echter opgenomen in de vierde, vijfde en zesde rij, en de lanthaniden zijn opgenomen in de zesde rij. De eerste ionisatie-energieën van de overgangsmetalen lijken enigszins op elkaar, evenals die van de lanthaniden. De ionisatie-energieën nemen van links naar rechts in elke rij toe, met afwijkingen bij ns2np1 (groep 13), ns2np4 (groep 16), en ns2(n – 1)d10 (groep 12).
- Eerste ionisatie-energieën nemen in het algemeen af naar beneden in een kolom. Hoewel het hoofdkwantumgetal n naar beneden in een kolom toeneemt, zijn gevulde binnenschillen effectief in het afschermen van de valentie-elektronen, zodat er een relatief kleine toename is van de effectieve kernlading. Bijgevolg worden de atomen groter naarmate zij elektronen verwerven. Valentie-elektronen die verder van de kern zijn, zijn minder sterk gebonden, waardoor ze gemakkelijker te verwijderen zijn, waardoor de ionisatie-energie afneemt. Een grotere straal stemt gewoonlijk overeen met een lagere ionisatie-energie.
- Omwille van de eerste twee tendensen liggen de elementen die het gemakkelijkst positieve ionen vormen (de laagste ionisatie-energieën hebben) in de linkerbenedenhoek van het periodiek systeem, terwijl de elementen die het moeilijkst te ioniseren zijn in de rechterbovenhoek van het periodiek systeem liggen. Bijgevolg nemen de ionisatie-energieën in het algemeen diagonaal toe van linksonder (Cs) tot rechtsboven (He).

In het algemeen neemt de ionisatie-energie diagonaal toe van linksonder in het periodiek systeem naar rechtsboven.
Gallium (Ga), dat het eerste element is na de eerste rij overgangsmetalen, heeft de volgende elektronenconfiguratie: 4s23d104p1. Zijn eerste ionisatie-energie is beduidend lager dan die van het onmiddellijk daaraan voorafgaande element, zink, omdat de gevulde 3d10 subschil van gallium binnen de 4p subschil ligt, waardoor het enkele 4p elektron van de kern wordt afgeschermd. Experimenten hebben nog iets belangrijkers aan het licht gebracht: de tweede en derde elektronen die worden verwijderd wanneer gallium wordt geïoniseerd, komen uit de 4s2-baan, niet uit de 3d10-subschil. De chemie van gallium wordt gedomineerd door het resulterende Ga3+ ion, met zijn 3d10 elektronenconfiguratie. Deze en soortgelijke elektronenconfiguraties zijn bijzonder stabiel en worden vaak aangetroffen in de zwaardere p-blokelementen. Ze worden ook wel pseudo- edelgas configuraties genoemd. In feite zijn er voor elementen die deze configuraties vertonen geen chemische verbindingen bekend waarin elektronen worden verwijderd uit de (n – 1)d10 gevulde subshell.