Subatomaire Deeltjes
Alle elementen zijn opgebouwd uit uiterst kleine materiedeeltjes die atomen worden genoemd. We kunnen een atoom definiëren als het eenvoudigste deeltje van een element dat de chemische eigenschappen van dat element heeft. Chemische eigenschappen omvatten de fysische toestand van het element (gas, vloeistof of vast), de soorten bindingen die het element kan vormen, hoe het reageert met andere elementen, enz. Daarom hebben alle atomen waaruit het element koolstof is opgebouwd dezelfde chemische eigenschappen.
Fysici zijn erin geslaagd atomen uiteen te laten spatten in tientallen verschillende sub-atomaire deeltjes, maar slechts 3 daarvan zijn stabiel. Dit zijn de protonen, neutronen, en elektronen. Protonen zijn positief geladen deeltjes, hebben massa, en bevinden zich in het centrum, of de kern van het atoom. Neutronen hebben geen lading, hebben massa, en bevinden zich ook in de kern van het atoom. Neutronen binden zich met protonen op een manier die helpt de kern te stabiliseren. Te veel of te weinig neutronen kunnen leiden tot een atoomkern die onstabiel is en kan vervallen tot andere elementen. We noemen deze atomen radioactief. Hoewel de massa van een neutron iets groter is dan die van een proton, kunnen wij aan beide de relatieve massa 1 (1 atomaire massaeenheid of amu) toekennen. Neutronen en protonen vormen bijna de gehele massa van een atoom. Het derde type van stabiele deeltjes is het elektron. Elektronen hebben een negatieve lading maar zijn uiterst klein en hebben een massa van slechts 1/1850 die van een proton of neutron. Zij zijn zo klein dat zij voor praktische doeleinden niet bijdragen tot de massa van het atoom. De elektronen bewegen met een enorme snelheid rond de atoomkern, bijna met de snelheid van het licht. Hoewel wij de elektronen vaak beschrijven als verblijvend in banen die om de kern cirkelen, zoals planeten om de zon, leert de moderne natuurkunde ons dat dit model onjuist is. Deze “banen” zijn in feite gebieden in de ruimte rond de kern waar de elektronen zich het grootste deel van de tijd zullen bevinden. Dit gebied wordt vaak de “elektronenwolk” genoemd. Het is nog steeds een specifiek gebied, maar het is een beetje meer amorf dan een bolvormige baan. Om het eenvoudig te houden, zien wij deze vaak als satellietachtige cirkelvormige banen. De afbeelding hieronder stelt ons huidige model van een stikstofatoom voor.
De stikstofkern bevat 7 protonen (oranje) en 7 neutronen (groen). De gearceerde gebieden rond de kern stellen de elektronenbanen (wolken) voor. De elektronen (blauw) bevinden zich ergens in deze banen. (Opmerking: de afbeelding is niet op schaal getekend. Er is gezegd dat als de kern zo groot zou zijn als een basketbal, de elektronen ongeveer zes kilometer ver weg zouden zijn!)
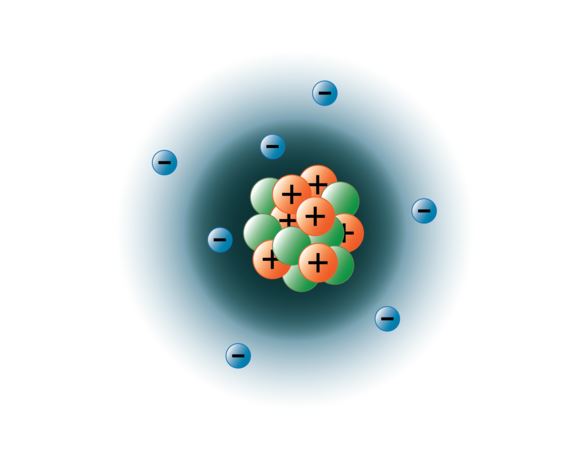
afbeelding gemaakt door BYU-I-student Hannah Crowder Fall 2013
Atoomnummer
Bekijk het periodiek systeem nog eens en let op het getal bovenin elk vakje. Dit getal is het atoomnummer van het element en is uniek voor elk element. Het atoomnummer van waterstof is bijvoorbeeld 1. Geen enkel ander element heeft een atoomnummer van 1. Voor koolstof is het atoomnummer 6 en ook hier heeft geen enkel ander element een atoomnummer van 6. Het atoomnummer is belangrijk omdat het ons het aantal protonen in de kern van elk element vertelt. Daarom hebben alle waterstofatomen 1 proton en alle koolstofatomen 6 protonen. Aangezien atomen een neutrale lading hebben, vertelt het atoomnummer ons ook het aantal elektronen in het atoom. In de chemische notatie wordt het atoomnummer van een element uitgedrukt als een subscript vóór het symbool van het element. Zo zou koolstof worden uitgedrukt als 6C.
Massa Aantal (Atoommassa)
Het massagetal van een atoom geeft, zoals de naam al zegt, de totale massa van het atoom aan. Aangezien de massa van een elektron uiterst klein is (verwaarloosbaar), wordt deze niet gebruikt bij de berekening van het massagetal. Bedenk ook dat de massa van elk proton en elk neutron 1 atomaire massaeenheid is. Het massagetal is dus de som van de protonen en de neutronen in het atoom. Aangezien het massagetal het aantal protonen plus het aantal neutronen is en het atoomnummer het aantal protonen, kan men het aantal neutronen vinden door eenvoudig het atoomnummer af te trekken van het massagetal. Stel bijvoorbeeld dat we een element hebben met een atoomnummer van 8 en een massagetal van 17. Uit deze informatie kun je afleiden dat dit element 8 protonen, 8 elektronen en 9 neutronen heeft (17-8=9). Nu zal ik eens een curve ball gooien. Zoals hierboven vermeld, hebben alle atomen van een bepaald element hetzelfde aantal protonen (atoomnummer), maar verschillende atomen van een bepaald element kunnen verschillende aantallen neutronen hebben. We zeggen dat dit verschillende isotopen van het element zijn. Er zijn bijvoorbeeld drie isotopen van waterstof. Het meest voorkomende isotoop, dat 99,98% van alle waterstofatomen omvat, heeft een massagetal van 1. Het bestaat dus uit 1 proton, geen neutronen en 1 elektron. De andere isotopen van waterstof, die minder talrijk zijn, hebben massagetallen van respectievelijk 2 en 3. Deze isotopen verschillen in het aantal neutronen in hun kernen, maar hebben alle drie één proton en één elektron. In werkelijkheid zijn er natuurlijk voorkomende isotopen van elk element, elk met zijn eigen unieke massagetal. In de chemische notatie wordt het massagetal voor een bepaalde isotoop uitgedrukt als een superscript vóór het symbool voor het element. De drie isotopen voor waterstof zouden worden uitgedrukt als 1H, 2H en 3H. Aangezien elk element uit verschillende isotopen bestaat, rijst de vraag “wat is de werkelijke massa van een bepaald element?” Nogmaals, als je naar het periodiek systeem hierboven kijkt, zie je onderin elk vakje een getal staan. Dit is het atoomgewicht van het element. Het atoomgewicht van waterstof is bijvoorbeeld 1,00794 amu. Dit getal is verkregen door de gemiddelde massa van de 3 isotopen van waterstof te berekenen. Bijvoorbeeld, stel dat we 10 jongens in onze klas hadden. Als we het gemiddelde gewicht van de jongens wilden weten, zouden we hun individuele gewichten bij elkaar optellen en dan het totaal door 10 delen. Dit zou ons hun gemiddelde gewicht geven. Dit is in wezen de manier waarop atoomgewichten worden bepaald. Aangezien 1H de meest voorkomende isotoop van waterstof is, is het logisch dat het atoomgewicht van waterstof heel dicht bij de atoommassa van 1H ligt.
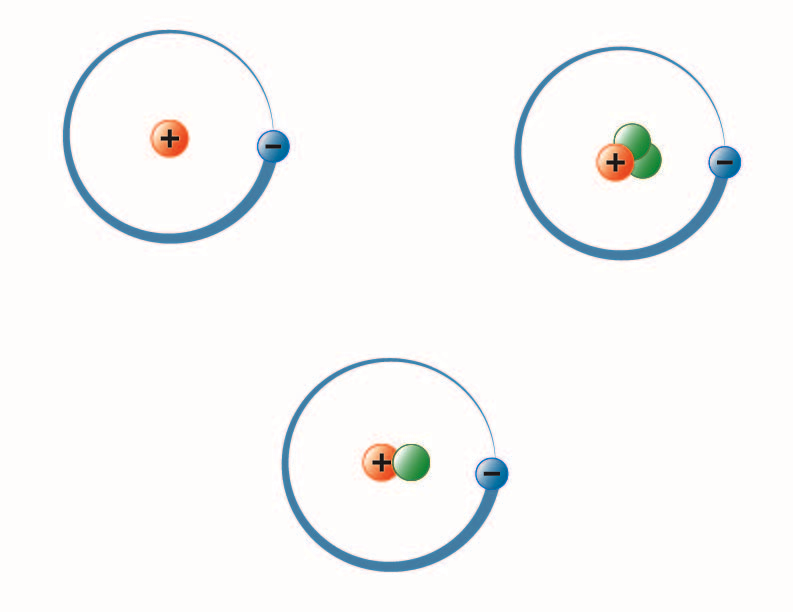
afbeelding gemaakt door BYU-I-student Hannah Crowder Fall 2013
De afbeelding hierboven stelt de drie isotopen van waterstof voor. Het meest voorkomende (linksboven) heeft één proton en geen neutronen in de kern. Deuterium (onder) heeft één proton en één neutron en Tritium (rechtsboven) heeft één proton en twee neutronen.
**Je kunt de knoppen hieronder gebruiken om naar de volgende of vorige lezing in deze module te gaan**

