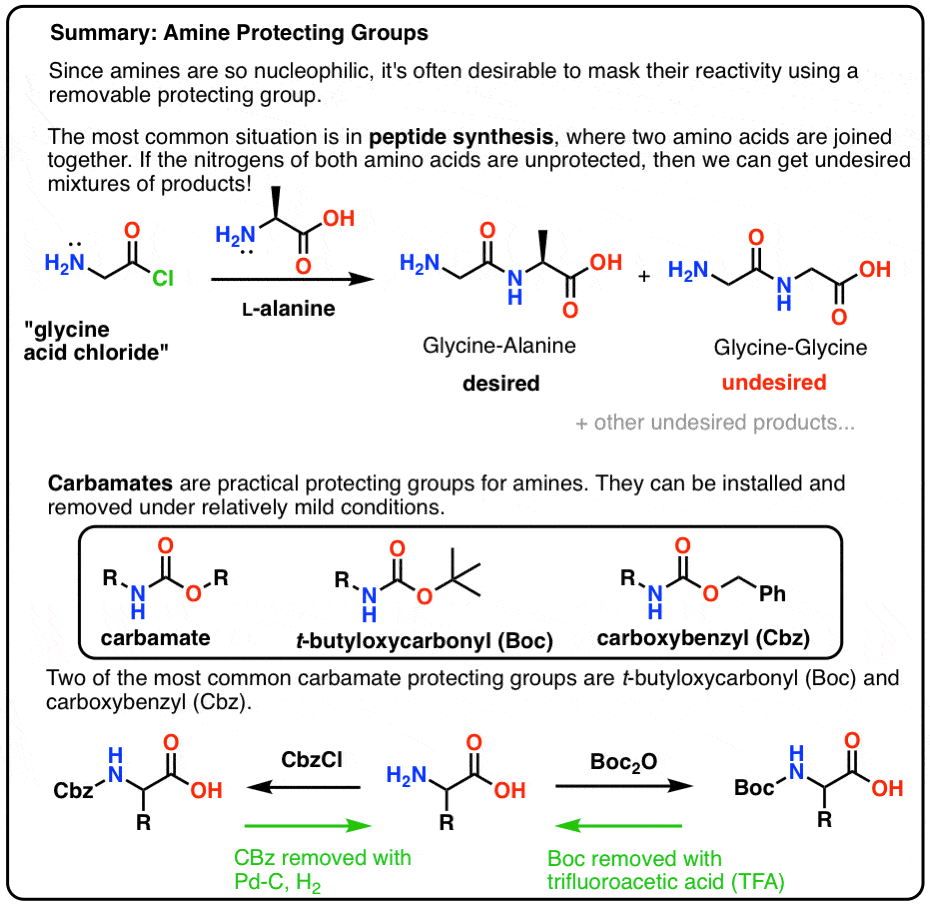
In deze post introduceren we carbamaten als een nuttige beschermende groep voor aminen, met name in de context van het maken van peptiden.
Hier volgt een snel samenvattend beeld van waar we in deze post op in zullen gaan, met meer details hieronder.
Inhoudsopgave
- Een inleiding tot eenvoudige peptidesynthese
- Let’s Mix Up A Batch of Gly-Ala
- Een zeer slecht eerste plan
- “Hark! Wat is dit voor troep?
- Een beschermhoedje voor NH2
- Maat! Gebruik een carbamaat, maat!
- Boc en CBz zijn de knieën van de bijen
- Installatie en verwijdering van de “Boc” beschermende groep
- Installatie en verwijdering van de CBz (of “Z”) carbamaat beschermende groep
- Een simpele peptide synthese met gebruik van carbamaat beschermende groepen
- Het gaat maar door…
- Noten
- (Gevorderden) Referenties en verder lezen
Een inleiding tot eenvoudige peptide synthese
In een recente post hebben we 3 veelgebruikte manieren om amiden te maken doorgenomen:
- Aan acylhalogeniden / anhydriden aminen toevoegen
- Partiële hydrolyse van nitrillen
- Koppeling van carbonzuren met aminen met behulp van een dehydraterend middel zoals DCC (N,N’-dicyclohexylcarbodiimide).
Wat ontbrak in dat bericht was enige vermelding van het synthetiseren van de overgrootvader van de meest bruikbare amide koppelingen die de mensheid kent, en daarmee bedoel ik peptiden.
Een peptidebinding is de naam die we geven aan de amidebinding die twee aminozuren met elkaar verbindt.
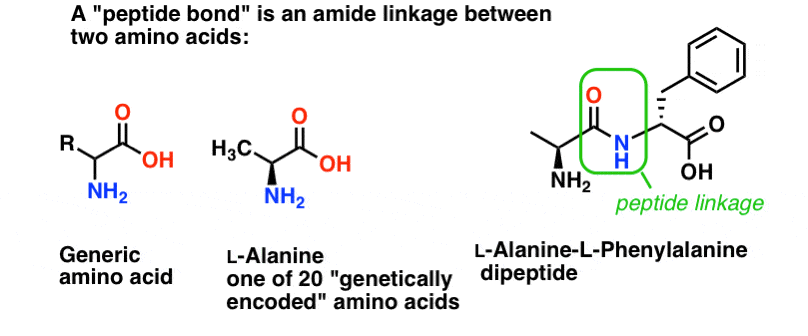
En aminozuren zijn belangrijk omdat… wacht. Je weet al waarom aminozuren belangrijk zijn, toch? Als je dat nu nog niet weet, kom dan na het lezen nog eens terug.
Let’s Mix Up A Batch of Gly-Ala
Laten we eens proberen wat van onze pas ontdekte amidesynthesevaardigheden toe te passen om te proberen een heel eenvoudig dipeptide te maken, glycine-alanine. Als we nu een eenvoudige dipeptide kunnen maken, kunnen we wat we geleerd hebben gebruiken om te laten zien hoe nog complexere peptiden worden gemaakt in een latere post. Wist je dat Nobelprijswinnaar Bruce Merrifield insuline heeft gesynthetiseerd door één aminozuur tegelijk samen te voegen? Ja, echt waar.
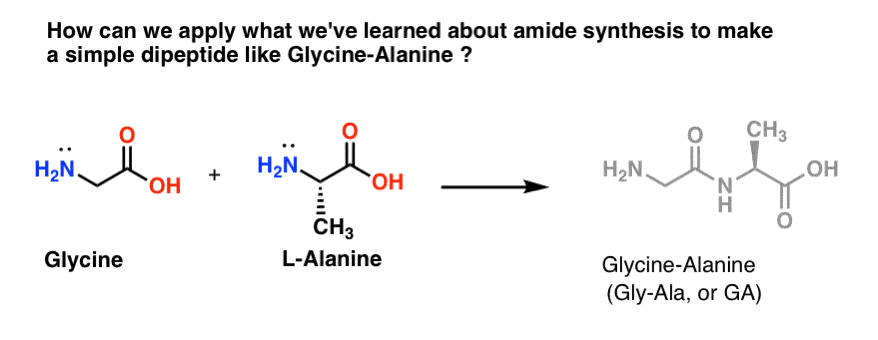
Van de drie methoden die we hebben opgesomd om amiden te maken, zijn er slechts twee potentieel bruikbaar voor het vormen van peptidebindingen: 1) de zuurchloride-methode, of 2) synthese via een koppelmiddel zoals DCC.
3. Een zeer slecht eerste plan
Onze eerste poging tot peptidesynthese zal bestaan uit een zeer naïef aanvalsplan en hopen dat het uiteindelijk allemaal goed komt. Hou je vast mensen, want het wordt een zooitje.
We beginnen met het voorstel voor de zuurchloride-methode voor de synthese van Gly-Ala.
Achteruitkijkend vanaf het Gly-Ala dipeptide, zou ons plan inhouden dat we de peptidebinding synthetiseren door de reactie van alanine met het zuurchloride afkomstig van glycine:
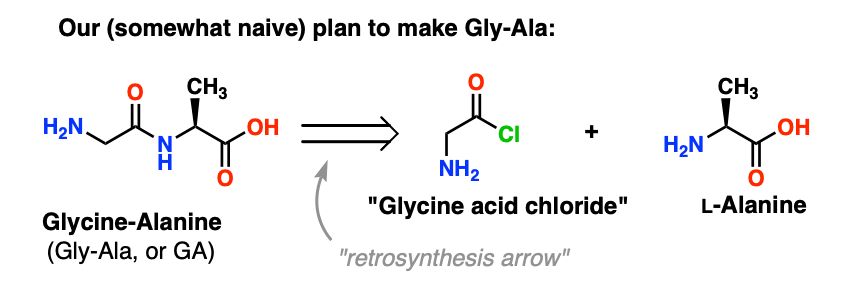
Er is een klein probleempje met dit plan.
Laten we aannemen dat we het zuurchloride van glycine* hebben gemaakt, en dat we “glycinezuurchloride” en alanine samen in dezelfde kolf hebben, samen met wat overmaat base om de zaak te versnellen.
We tekenen de reactie in voorwaartse richting:
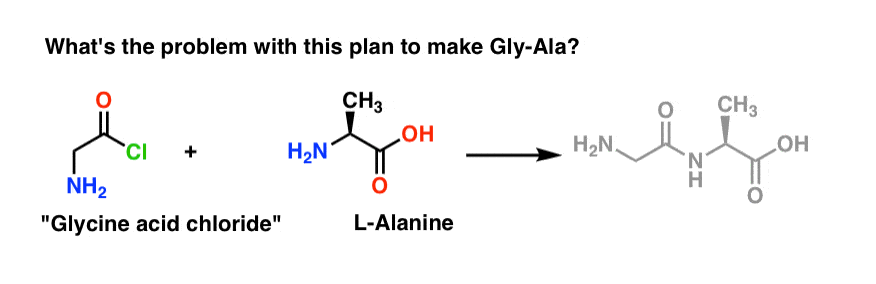
Wat zou er mis kunnen gaan?
“Hark! Wat is dit voor onzin? “
Het plan is om een oplossing te maken van het zure chloride van glycine (1 molair equivalent), en het dan geduldig in de kolf te laten wachten tot we een molair equivalent van alanine toevoegen, waarna het zou reageren met de nucleofiele NH2 groep van alanine.
Het probleem met ons plan is dat we niet te maken hebben met een enkele molecuul “glycinezuurchloride” – we hebben te maken met iets van een mol (6,02 x 1023 moleculen) ervan. En het zuurchloride van glycine heeft al een nucleofiele NH2 groep!
“Glycinezuurchloride” zoals getekend, is geen stabiele molecule, omdat het met zichzelf kan reageren.
Dit betekent dat een oplossing van glycinezuurchloride, aan zichzelf overgelaten, een polymeer van glycine zou vormen, met de structuur Gly-Gly-Gly-Gly…
Zelfs een oplossing van glycinezuurchloride in aanwezigheid van alanine zou niet alleen de gewenste Gly-Ala vormen, maar ook Gly-Gly (met een aangehecht acylhalogenide) dat verder kan gaan om meer onheil aan te richten met een ander nucleofiel, of het nu Gly of Ala is:
(en nee, er is niet veel dat de NH2 van “glycinezuurchloride” onderscheidt van de NH2 van alanine. Ze zijn ongeveer even reactief.)
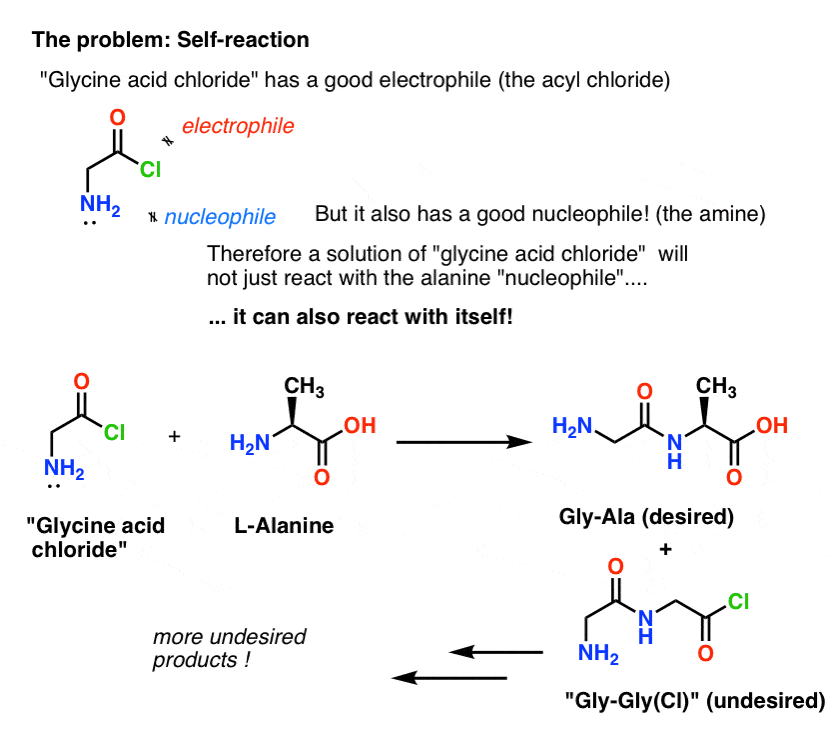
De les hier is dat wanneer je een oplossing hebt van een molecuul dat zowel een nucleofiel als een elektrofiel bevat, het een zelfreactie kan aangaan. Er is een naam voor dit proces die misschien bekend in de oren klinkt: polymerisatie.
Dus hoe voorkomen we dat dit gebeurt?
Een beschermhoedje voor NH2
De beste manier is om de stikstof op de een of andere manier te “bedekken” met een beschermende groep (PG) die de NH2 groep niet-nucleofiel maakt. Het zou ook de volgende eigenschappen moeten hebben:
- gemakkelijk en selectief geïnstalleerd
- inert voor de gewenste reactievoorwaarden (b.v. SOCl2 om het zuurchloride van het carbonzuur te maken)
- gemakkelijk en selectief verwijderd zonder het eindproduct te beïnvloeden
We hebben al eerder beschermende groepstrategieën gezien, in het bijzonder met alcoholen en het gebruik van Grignard-reagentia.
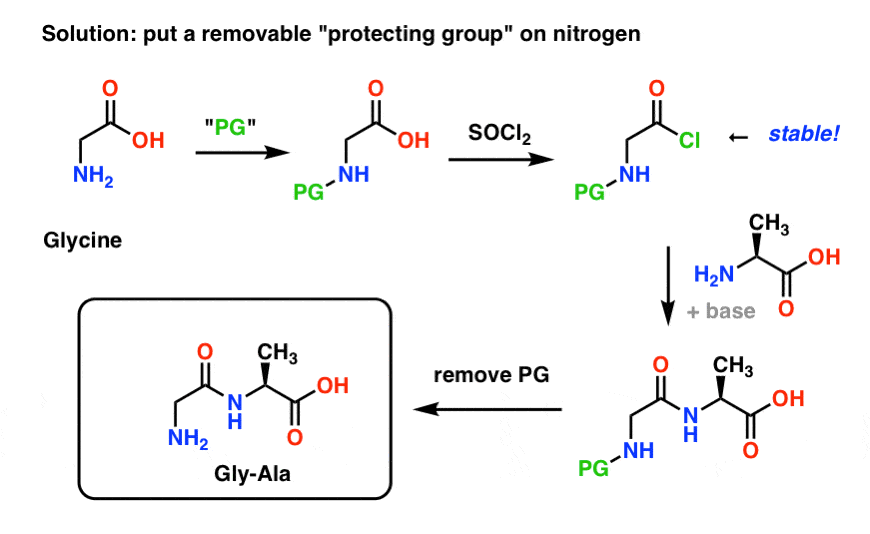
Hier ziet u hoe een beschermende groepstrategie voor onze synthese van “Gly-Gly” eruit zou kunnen zien. We installeren een beschermende groep (“PG”) op glycine en maken dan het zuurchloride. De PG moet zo worden gekozen dat de stikstof niet-nucleofiel is (d.w.z. het zal niet reageren met het zuurchloride)
We kunnen dan onze peptidebinding vormen met onbeschermd alanine en dan de PG verwijderen onder milde omstandigheden.
Een beschermende groepstrategie voor stikstof die we al hebben onderzocht, is de Gabriel-synthese, waarbij ftaalimide wordt gebruikt (je kunt een ftaalimide beschouwen als een beschermde stikstof). Dit is ook gebruikt om Gly-Gly (“glycylglycine”) te synthetiseren ! Een van de problemen is echter dat relatief zware omstandigheden (veel hitte) nodig zijn om zowel de ftalimidegroep te installeren als te verwijderen, en dit is geen erg gezonde omgeving voor het overleven van gevoelige, chirale aminozuren, die gemakkelijk kunnen racemiseren.
Een andere mogelijke keuze is om de stikstof te beschermen als een amide, maar splitsing van amides kan ook zware omstandigheden vereisen. Bovendien, aangezien we hier toch proberen een amidebinding (peptide) te smeden, zouden we selectiviteitsproblemen kunnen krijgen met de verwijdering ervan – het vernietigen van het dorp om het te redden.
Mate! Gebruik een carbamaat, maat!
De meest populaire keuze van beschermende groep voor amine stikstof is de carbamaat functionele groep. Een carbamaat lijkt op het bastaardkind van een ester en een amide, met N en O die een carbonyl flankeren.
De stikstof van een carbamaat is relatief niet-nucleofiel, en verder zijn carbamaten:
- gemakkelijk op stikstof te plaatsen
- inert tegen een grote verscheidenheid van reactieomstandigheden
- gemakkelijk te verwijderen zonder bestaande amidegroepen aan te tasten
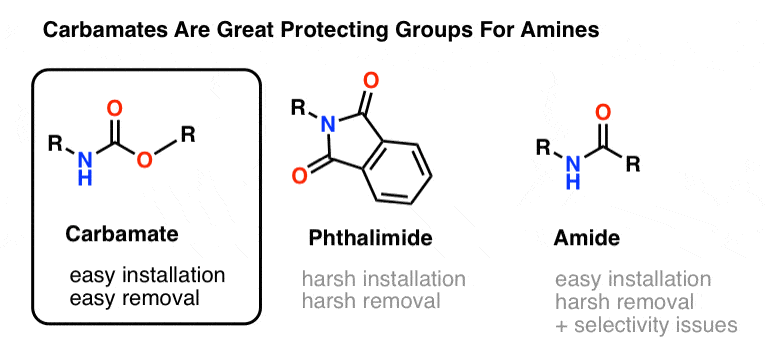
Dit maakt ze perfect voor onze doeleinden.
Boc en CBz zijn de bijenknieën
Twee populaire carbamaatbeschermende groepen zijn Boc (t-Butyloxycarbonyl) en CBz (carboxybenzyl).
Voor onze doeleinden kunnen deze twee beschermende groepen worden beschouwd als min of meer gelijkwaardig, omdat beide effectief kunnen worden gebruikt voor peptidesynthese.
Het belangrijkste verschil zit hem eigenlijk in hoe ze worden verwijderd (d.w.z. de “deprotectie” stap). De keuze tussen het een en het ander wordt cruciaal zodra je een complex molecuul hebt met meerdere beschermgroepen; dat valt onder de categorie “geavanceerde synthetische strategie”, wat meer een onderwerp is voor Org 3.
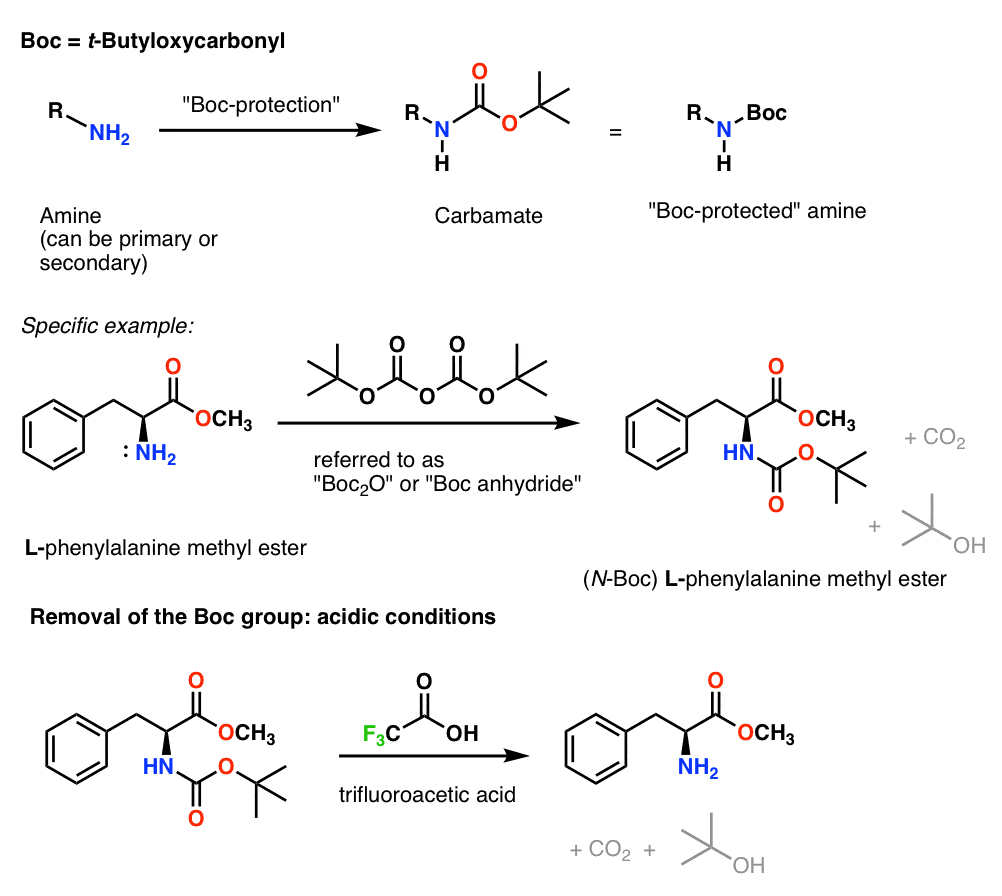
Installatie en verwijdering van de “Boc” beschermende groep
De Boc groep wordt gewoonlijk geïnstalleerd met “Boc2O” (soms ook “Boc anhydride” genoemd), en wordt verwijderd met zuur. De gebruikelijke keuze is “zuiver” (d.w.z. onverdund) trifluorazijnzuur (TFA), dat de Boc-groepen zeer schoon wegknalt, waarbij CO2 en t-butylalcohol vrijkomen.
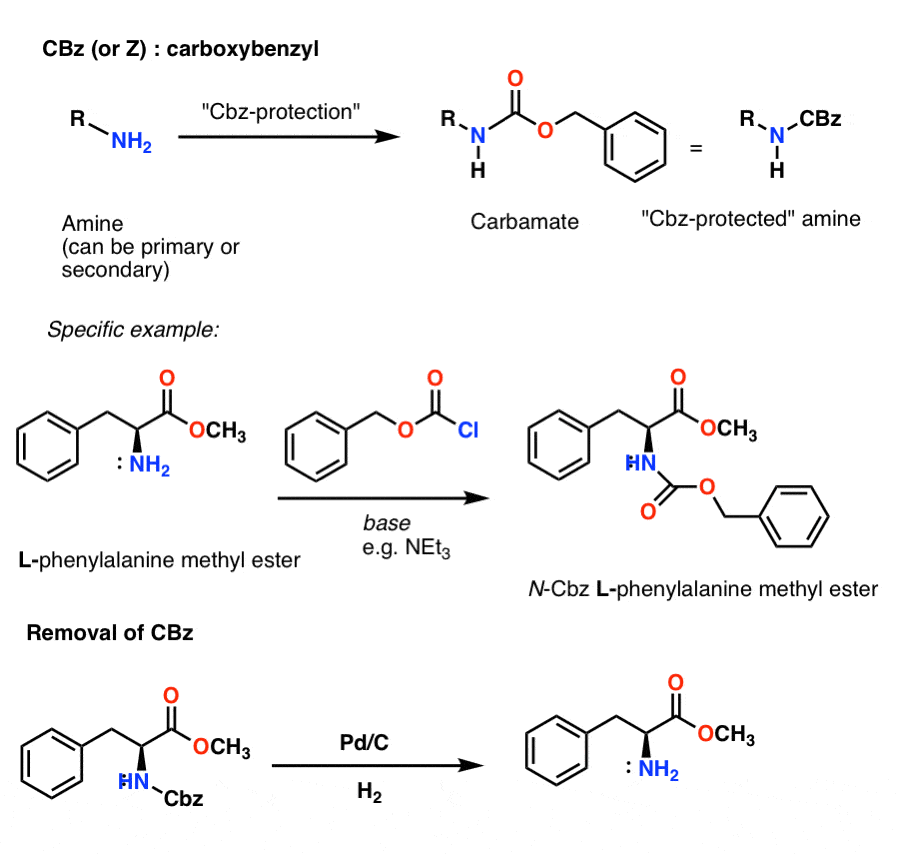
installatie en verwijdering van de CBz (of “Z”) carbamaatbeschermende groep
De Cbz-groep (soms verder afgekort als “Z”) kan worden geïnstalleerd met CbzCl en milde base, en wordt gewoonlijk verwijderd via katalytische hydrogenering (Pd-C/H2). Dit is uiterst mild en heeft het voordeel dat het bij neutrale pH plaatsvindt, zodat zuur- of basegevoelige functionele groepen alleen overblijven.
Een eenvoudige peptidesynthese met behulp van carbamaat beschermende groepen
Laten we teruggaan naar peptidesynthese en deze beschermende groep strategie toepassen om Gly-Ala te maken.
We beginnen met een aminozuur zoals L-alanine. Door alanine met Boc2O te behandelen, verkrijgen we N-Boc beschermd L-alanine. De volgende stap is de vorming van een zuurchloride met behulp van SOCl2. Eenmaal gevormd, voegen wij vervolgens ons amine (b.v. L-valine) toe in aanwezigheid van een overmaat base, waarbij onze belangrijkste amidebinding wordt gevormd. De laatste stap om het dipeptide te verkrijgen is het deprotecteren van het met Boc beschermde amine met trifluorazijnzuur (TFA), en voila! we hebben ons dipeptide.
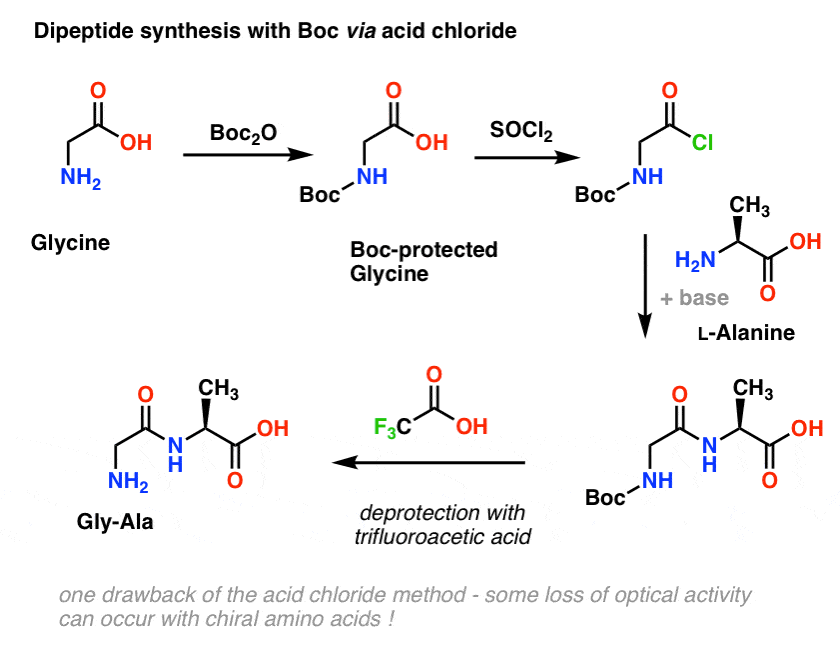
Hoewel deze methode op papier goed lijkt, is een probleem van het gebruik van zuurchloriden in de praktijk dat chirale aminozuren bij deze methode vaak hun optische zuiverheid verliezen, een proces dat soms wordt aangeduid als “racemisatie”, maar correcter “epimerisatie” wordt genoemd (technisch correcter, omdat een waterstof op een chiraal centrum wordt omgekeerd)
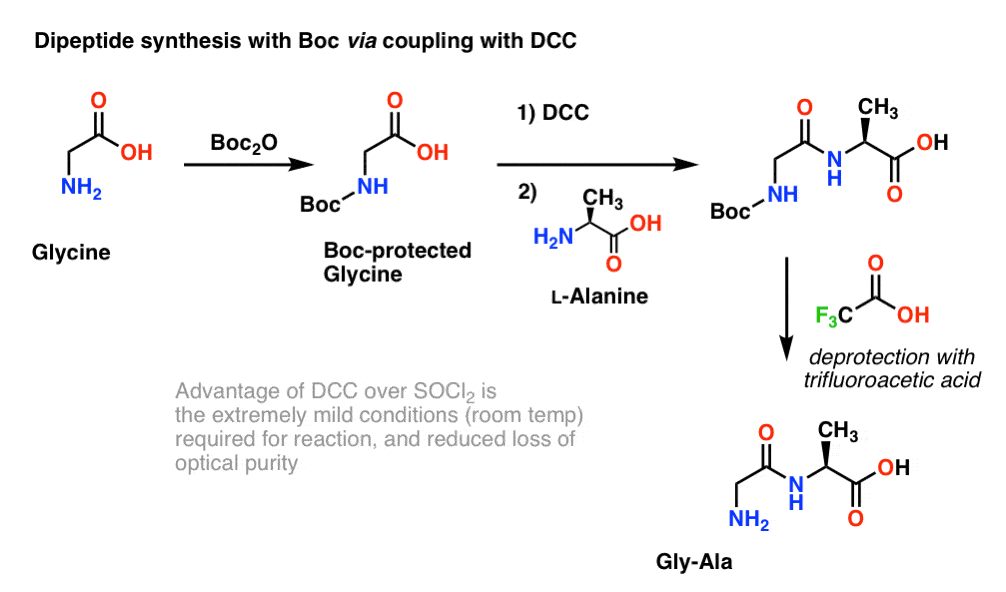
Omdat de chiraliteit van aminozuren essentieel is voor hun biologische functie, wordt over het algemeen een iets milder protocol gebruikt dat gebruik maakt van DCC of een vergelijkbaar koppelingsreagens.
Hier behandelen we Boc-beschermd glycine met DCC om het carboxylzuur te activeren. Daarna voegen we ons aminozuur-nucleofiel (L-alanine) toe, dat het dipeptide vormt. Als we het gly-Ala-dipeptide op dit punt willen isoleren, kunnen we de Boc-groep verwijderen met TFA.
(opmerking over dit schema)
Het gaat maar door…
Merkt u op dat als we een tri-peptide willen maken, we gewoon cycli kunnen blijven uitvoeren van het toevoegen van DCC (om het carbonzuur te activeren) gevolgd door het toevoegen van nieuwe aminozuren, waarbij we het peptide één voor één opbouwen!
Er bestaat een bijzonder effectieve methode voor het bouwen van langere peptiden, die werd ontwikkeld door Bruce Merrifield (en onder meer werd toegepast bij de synthese van insuline), de zogenaamde vaste-fase peptidesynthese, die we de volgende keer dat we dit onderwerp behandelen, zullen behandelen.
Noten
Noot 1. Vergelijkbaar met de oude grap over de econoom die een plan voorstelt om van een onbewoond eiland af te komen:
“Veronderstel dat we een boot hebben”.
Glycine (zoals alle aminozuren) zelf is een zwitterion. Behandeling van glycine met SOCl2 zou het zuurchloride met een geprotoneerd amine moeten opleveren. Dit zou relatief stabiel moeten zijn in oplossing zolang er geen base wordt toegevoegd.
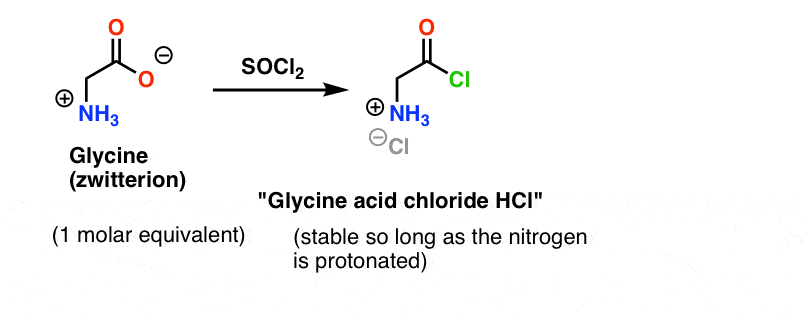
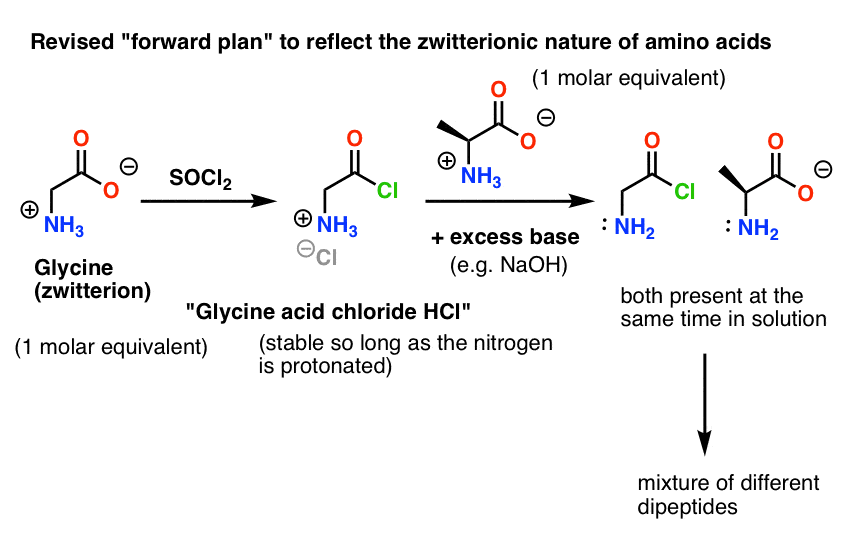
Hier is het probleem. Aangezien ons aminozuur-nucleofiel (alanine) ook zwitterionisch is, kan er geen reactie plaatsvinden totdat een overmaat base wordt toegevoegd om een lone paar op de alanine-stikstof vrij te maken. Na toevoeging van de base hebben we “glycinezuurchloride” en alanine samen in oplossing. Er is geen merkbaar verschil in nucleofiliciteit tussen de nitrogenen van deze twee soorten, en elk van hen zal concurreren om te reageren met het nucleofiel zuurchloride, wat leidt tot een mengsel van Gly-Ala en Gly-GlyCl, en het Gly-GlyCl kan dan verder reageren met de verschillende nucleofielen die in oplossing aanwezig zijn om tri-, tetra- en hogere peptiden te geven.
Noot 2. John Sheehan, die we eerder hebben leren kennen als de uitvinder van DCC op weg naar de eerste synthese van penicilline, maakte ook ftalyl-beschermde Gly-Gly via een Gabriel-synthese:
Referentie hier (JACS, 1949, 71, 1856)
Noot 3. Een ander probleem bij het gebruik van amide-beschermgroepen is azlactonvorming, die kan leiden tot epimerisatie van chirale aminozuren. Zie ook deze probleemstelling.
Noot 4. “Orthogonale beschermgroepen”. Bij synthetische planning is het vaak van cruciaal belang om beschermgroepen te hebben die onder duidelijk verschillende omstandigheden kunnen worden verwijderd. Deze eigenschap wordt vaak “orthogonaliteit” genoemd
Bij voorbeeld in het volgende dipeptide hebben we twee verschillende beschermgroepen op stikstof – een Boc en een CBz. Door het selecteren van “orthogonale” beschermende groepen, elke stikstof is adresseerbaar – we kunnen kiezen welke beschermende groep te verwijderen, en onze synthese kan vanaf daar verder gaan. Dit voorkomt dat we in een situatie terechtkomen waarin we twee onbeschermde amines hebben en moeten vertrouwen op het feit dat de ene reactiever is dan de andere. Deze aanpak werkt zelden!
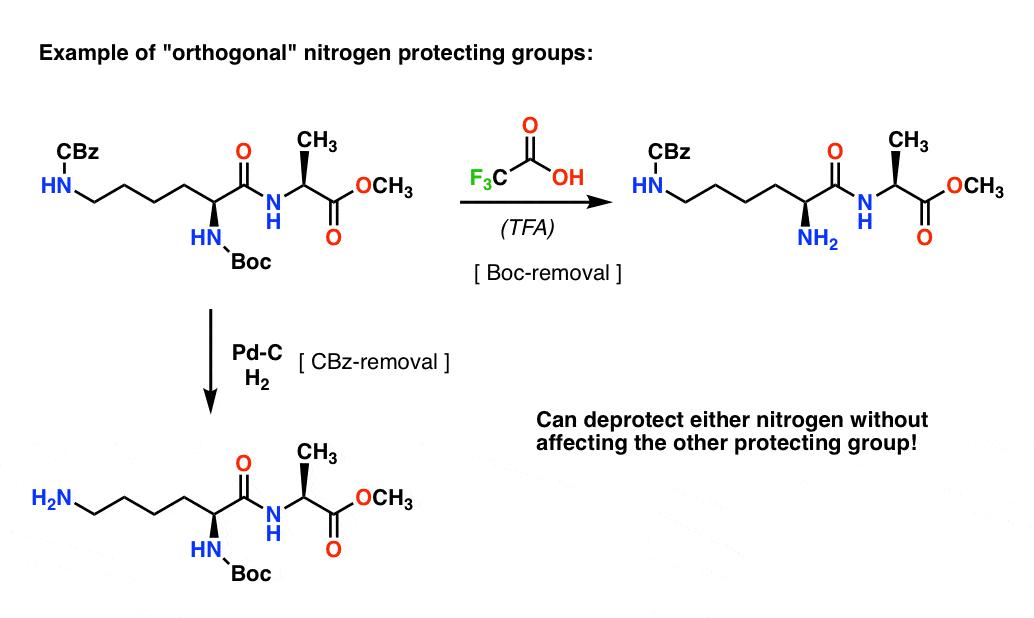
Een opmerking – voor de eenvoud is alanine hier afgebeeld met een vrij carbonzuur, maar een iets betere aanpak zou zijn om de methylester van alanine te gebruiken om een eventuele zelfkoppeling tussen het vrije amine van alanine en het vrije carbonzuur te vermijden.
Mate…
(Gevorderd) Referenties en verder lezen
Carbamaten zijn nuttig als beschermende groepen voor aminen, en de meest gebruikte zijn -Boc, -Cbz, en -Fmoc.
- Über ein allgemeines Verfahren der Peptid-Synthese
Max Bergmann and Leonidas Zervas
Ber. 1932, 65 (7), 1192-1201
DOI: 10.1002/cber.19320650722
De -Cbz (carboxybenzyl) beschermende groep werd voor het eerst gebruikt door Max Bergmann en Leonidas Zervas in 1932 voor de synthese van peptiden, en wordt soms afgekort als “-Z” ter ere van Zervas. - VERWIJDERING VAN PROTECTERENDE GROEPS VAN t-BUTYL EN t-BUTOXYCARBONYL MET TRIFLUOROACETISCH ACID
Mechanismen, vorming van biproducten en evaluatie van Scavengers
Behrend F. Lundt, Nils L. Johansen, Aage Vølund, and Jan Markussen
J. Pept. Prot. Res. 1978, 12 (5), 258-268
DOI: 10.1111/j.1399-3011.1978.tb02896.x
In de praktijk worden bij het deprotecteren meestal nucleofiele scavengers (b.v. thiolen) aan de zuurcocktail (TFA) toegevoegd, omdat bij deprotectie van Boc elektrofiele t-butylsoorten (b.v. t-butyltrifluoracetaat) ontstaan, die met gevoelige residuen (b.v. Trp of Cys) kunnen reageren. - Een methode voor de synthese van lange peptideketens aan de hand van een synthese van oxytocine als voorbeeld
Miklos Bodanszky en Vincent du Vigneaud
Journal of the American Chemical Society 1959, 81 (21), 5688-5691
DOI: 1021/ja01530a040
In de eerste helft van de 20e eeuw werd de synthese van peptiden gedaan met behulp van standaard organisch-chemische oplossingsfasetechnieken. Dit staat nu bekend als LPPS (liquid-phase peptide synthesis). du Vigneaud ontving de Nobelprijs voor scheikunde in 1955 voor zijn werk om aan te tonen dat peptide synthese mogelijk was, met gebruikmaking van de juiste keuze van beschermende groepen en synthetische strategieën. - DE TEMPORAIRE VORMING VAN DE AZLACTONE RING IN DE RACEMISATIE VAN ACYL DERIVATEN VAN AMINO ACIDS MET ACETISCH ANHYDRIDE
Vincent du Vigneaud en Curtis E. Meyer
Biol. Chem. 1932, 99:143-151
http://www.jbc.org/content/99/1/143.citation
Een ander probleem bij het gebruik van amide-beschermende groepen is de vorming van azlacton, wat kan leiden tot epimerisatie van chirale aminozuren. - Een nieuwe synthetische route naar peptiden
John C. Sheehan en Victor S. Frank
Journal of the American Chemical Society 1949, 71 (5), 1856-1861
DOI: 10.1021/ja01173a095
John Sheehan, de uitvinder van DCC op weg naar de eerste synthese van penicilline, maakte ook ftalyl-beschermde Gly-Gly via een Gabriel synthese. - Een nieuwe methode voor het vormen van Peptide Bindingen
John C. Sheehan en George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
Oorspronkelijk artikel over de synthese van peptidebindingen/amidebindingen met behulp van DCC. - 9-Fluorenylmethoxycarbonyl functie, een nieuwe base-gevoelige amino-beschermende groep
Louis A. Carpino en Grace Y. Han
Journal of the American Chemical Society 1970, 92 (19), 5748-5749
DOI: 10.1021/ja00722a043 - 9-Fluorenylmethoxycarbonyl amino-beschermende groep
Louis A. Carpino and Grace Y. Han
The Journal of Organic Chemistry 1972 37 (22), 3404-3409
DOI: 10.1021/jo00795a005
De ontdekking en ontwikkeling van de -Fmoc-beschermende groep voor aminen voegt een extra laag orthogonaliteit toe aan amine-beschermings-/de-beschermingsstrategieën. De -Fmoc groep is base labiel, en in peptide synthese wordt typisch verwijderd met 20% piperidine in DMF. Cbz wordt verwijderd door hydrogenering, -Boc verwijderd met zuur, en -Fmoc met base.