Figuur 1. De signaaltransductieroute van de Toll-like receptor
Wat is een Toll-like receptor?
Toll-like receptors (TLR’s) zijn een klasse eiwitten die een sleutelrol spelen in de aangeboren immuniteit. Het zijn trans-membraanreceptoren met één domein die behoren tot de patroonherkenningsreceptoren (PRR’s) die gewoonlijk tot expressie komen in schildwachtcellen zoals macrofagen, dendritische cellen en vele andere niet-immuuncellen zoals fibroblasten en epitheelcellen. Zij herkennen structureel geconserveerde moleculen afkomstig van microben, die pathogeen-geassocieerde moleculaire patronen (PAMP’s) worden genoemd, of zelfgemaakte moleculen afkomstig van beschadigde cellen, die schadegeassocieerde moleculenpatronen (DAMP’s) worden genoemd. PAMP’s omvatten diverse bacteriële celwandbestanddelen zoals lipopolysaccharide (LPS), peptidoglycaan (PGN) en lipopeptiden, alsmede flagelline, bacterieel DNA en viraal dubbelstrengs RNA. DAMP’s omvatten intracellulaire eiwitten zoals heat shock-eiwitten en eiwitfragmenten uit de extracellulaire matrix. PRR’s activeren stroomafwaartse signaalwegen die leiden tot de inductie van aangeboren immuunreacties door de productie van ontstekingsbevorderende cytokines, type I interferon (IFN) en andere mediatoren. Deze processen brengen niet alleen onmiddellijke verdedigingsreacties van de gastheer op gang, zoals ontsteking, maar zetten ook antigeenspecifieke adaptieve immuunreacties op gang en orkestreren deze. Deze reacties zijn essentieel voor het opruimen van infecterende microben en cruciaal voor de daaropvolgende instructie van antigeenspecifieke adaptieve immuunreacties.
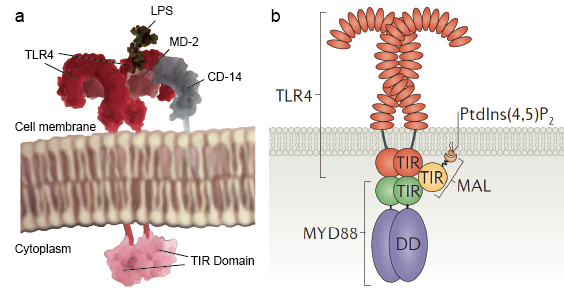
Figuur 2. Het schematische diagram van de moleculaire structuur van de TLR’s.
Toll-like receptor family
De TLR-familie omvat 10 leden (TLR1-TLR10) bij de mens en 12 (TLR1-TLR9, TLR11-TLR13) bij de muis. TLR’s lokaliseren aan het celoppervlak of in intracellulaire compartimenten zoals het ER, endosoom en lysosoom. TLR’s op de celoppervlakte omvatten TLR1, TLR2, TLR4, TLR5, TLR6, en TLR10, terwijl intracellulaire TLR’s gelokaliseerd zijn in het endosoom en TLR3, TLR7, TLR8, TLR9, TLR11, TLR12, en TLR13 omvatten (figuur 1). TLR’s aan de celoppervlakte herkennen vooral microbiële membraancomponenten zoals lipiden, lipoproteïnen, en proteïnen. Intracellulaire TLR’s herkennen nucleïnezuren afkomstig van bacteriën en virussen, en herkennen ook zelf-nucleïnezuren in ziektecondities zoals auto-immuniteit.
De functie van Toll-like receptor berust meestal op een dimerisatieproces van twee TLR moleculen, maar niet altijd. Bijvoorbeeld, TLR-1 en TLR-2 zullen zich aan elkaar binden om een dimer te vormen wanneer ze PAMP-moleculen herkennen, voornamelijk lipoproteïnen, peptidoglycanen, lipotechoïdezuren (LTA, Gram-), zymosan, mannan, en tGPI-mucine. TLR-2 kan ook een dimmer vormen met TLR-6 wanneer zij dezelfde PAMPs herkennen die hierboven zijn genoemd. TLR-4 kan lipopolysaccharide (LPS, Gram+) herkennen en een homodimer vormen met een ander TLR-4 molecuul. TLR-5 kan bacterieel flagelline herkennen, maar zij vormen geen dimeer. TLR-11 is functioneel in muizen en herkent vooral uropathogene bacteriën. TLR-3, 7, 8, 9, 13 komen tot expressie op het endosoomoppervlak in het cytoplasma. TLR3 herkent viraal dubbelstrengs RNA (dsRNA), kleine interfererende RNA’s, en zelf-RNA’s afkomstig van beschadigde cellen. TLR-7 komt voornamelijk tot expressie in plasmacytoïde DC’s (pDC’s) en herkent enkelstrengs (ss) RNA van virussen. Het herkent ook RNA van streptococcus B bacteriën in conventionele DC’s (cDC’s). TLR8 reageert op viraal en bacterieel RNA. TLR-9 herkent bacterieel en viraal DNA dat rijk is aan ongemethyleerde CpG-DNA motieven. TLR13 herkent bacterieel 23S rRNA en onbekende componenten van het vesiculaire stomatitis virus.
Hoewel er zovele types TLR-moleculen zijn die een brede waaier van liganden herkennen, delen al deze TLR’s een gemeenschappelijk structureel kader in hun extracellulaire, ligand-bindende domeinen. Deze domeinen hebben allemaal een hoefijzervormige structuur, opgebouwd uit leucinerijke herhalingsmotieven. Bij binding aan een ligand vormen de twee extracellulaire domeinen een m-vormig dimeer dat het ligand in een sandwich plaatst en de transmembrane en cytoplasmatische domeinen in elkaars nabijheid brengt en een stroomafwaartse signaalcascade in gang zet (Figuur 2).
Toll-like receptor signaling pathway
1. Toll-like receptor signaleringscascade
Toll-like receptoren stellen schildwachtcellen zoals macrofagen in staat om microben te detecteren via PAMPs zoals LPS. LPS is een bestanddeel van de celwand van bacteriën. Het mechanisme van de herkenning van lipopolysaccharide door Toll-like receptoren is complex en vereist verschillende accessoire eiwitten. Een serumeiwit, LPS-bindend eiwit, bindt LPS-monomeren en draagt deze over aan een eiwit dat CD14 wordt genoemd. CD14 kan oplosbaar zijn of zich aan het celoppervlak binden via een glycosylfosfatidylinositolanker. CD14 levert en laadt LPS aan het extracellulaire domein van Toll-like receptoren. TLR’s zijn in staat LPS te detecteren met behulp van een accessoir eiwit, MD-2 genaamd. Vervolgens wordt homodimerisatie van TLR’s geïnduceerd wanneer LPS zich bindt aan het complex van TLR-CD14-MD2. De conformatieverandering van de extracellulaire domeinen initieert dimerisatie van het cytoplasmatische Toll IL-1 receptor (TIR) domein. De conformatieverandering van het TIR zorgt voor een nieuwe steiger die de rekrutering van adaptoreiwitten mogelijk maakt om een post-receptor signaalcomplex te vormen. Het TIR bevat een adaptoreiwit myeloïde differentiatie primair-respons eiwit 88 (MyD88).
MyD88 functioneert als een adaptor die TLR’s/IL-1R’s verbindt met stroomafwaartse signaleringsmoleculen die DD’s hebben. Het herkent de conformatieverandering in het TIR-domein van de TLR’s, bindt zich aan het nieuwe receptorcomplex, en draagt de signalering over door amino (N)-terminale doodsdomein (DD) interactie met IL-1R-geassocieerde kinasen (IRAK’s). Dit resulteert in een complexe cascade met signaalinducties die de cel waarschuwt voor een pathogene invasie. Er zijn 4 IRAK’s (IRAK 1, 2, 4, M). Zij bevatten een N-terminaal DD en een centraal serine/threonine-kinase domein. IRAK1 en IRAK4 hebben intrinsieke kinase-activiteit, terwijl IRAK2 en IRAK-M geen detecteerbare kinase-activiteit hebben. IRAK4 wordt geactiveerd door MyD88 en gaat door met het activeren van IRAK1. IRAK1 activeert vervolgens de stroomafwaartse TRAF6. TRAF6 is lid van de tumornecrosefactorreceptor (TNFR)-geassocieerde factor (TRAF)-familie die cytokinesignaleringsroutes medieert. Bij stimulatie wordt TRAF6 gerekruteerd aan het receptorcomplex, en geactiveerd door IRAK-1 dat bindt aan het TRAF-domein van TRAF6. Vervolgens wordt het IRAK-1/TRAF6 complex losgekoppeld van de receptor en geassocieerd met TGF-beta-geactiveerd kinase 1 (TAK1) en TAK1-bindende eiwitten, TAB1 en TAB2. Het complex van TRAF6, TAK1, TAB1 en TAB2 verplaatst zich naar het cytoplasma, waar het een groot complex vormt met andere eiwitten, zoals de E2-ligasen Ubc13 en Uev1A. Er is aangetoond dat het Ubc13- en Uev1A-complex de synthese van een Lys 63-gekoppelde polyubiquitineketen van TRAF6 katalyseert en daardoor TRAF6-gemedieerde activering van TAK1 en tenslotte van NF-kB induceert. Deze hierboven beschreven signaalroutes worden MyD88-afhankelijke routes genoemd, omdat het signaal uitgaat van de MyD88-molecule. Er is ook een andere weg die MyD88-afhankelijke weg wordt genoemd, waarbij het signaal niet uitgaat van MyD88. In plaats daarvan gaat het signaal uit van het TRIF-eiwit. TRIF interageert met TRAF6 en TRAF3. TRAF6 rekruteert het kinase RIP-1, dat op zijn beurt interageert met het TAK1-complex en dit activeert, wat leidt tot de activering van NF-kB en MAPK’s en de inductie van ontstekingsbevorderende cytokines. TRAF3 daarentegen rekruteert de IKK-gerelateerde kinasenTBK1 en IKKi samen met NEMO voor IRF3-fosforylering en activering. IRF3 vormt een dimeer en transloceert vanuit het cytoplasma naar de kern, en induceert de expressie van type I IFN.
2. Downstream signalering
TLRs signaleren eigenlijk hoofdzakelijk door de rekrutering van specifieke adaptormoleculen, wat leidt tot de activering van de transcriptiefactoren NF-kB en IRFs, die de uitkomst van aangeboren immuunreacties dicteren. Deze stroomafwaartse signaalroute activeert dus de IRFs transcriptiefactor, de NF-kB signaalroute en de MAKP signaalroute. Meer gedetailleerde informatie over de NF-kB en MAKP pathway vindt u in:
NF-kB signalerings pathway, P38 signalerings pathway en MAKP signalerings pathway.
3. Pathway regulatie
Omdat er enige negatieve regulatie is door een aantal moleculen via verschillende mechanismen om de buitensporige immuunreacties te voorkomen of te beëindigen die leiden tot nadelige gevolgen geassocieerd met auto-immuniteit en ontstekingsziekte. Activering van de MyD88-afhankelijke route wordt onderdrukt door ST2825, SOCS1, en Cbl-b, en activering van de TRIF-afhankelijke route wordt onderdrukt door SARM en TAG. Deze moleculen associëren met MyD88 of TRIF om te voorkomen dat ze zich binden aan TLR’s of downstream moleculen. De activering van TRAF3 wordt negatief gereguleerd door SOCS3 en DUBA. TRAF6 is het doelwit van een aantal remmende moleculen zoals A20, USP4, CYLD, TANK, TRIM38 en SHP. De activering van TAK1 wordt geremd door TRIM30a en A20.
4. Relatie met ziekten
Aangezien TLR betrokken is bij LPS sensing en een rol zou kunnen spelen bij sepsis, is targeting van TLR’s belangrijk voor de behandeling van verschillende ziekten. Naast interferentie met TLR responsen om pathogene infecties te behandelen, was een voor de hand liggende klinische toepassing van de kennis opgedaan uit TLR studies het gebruik van TLR liganden als adjuvans voor vaccins. Bovendien is ook geprobeerd TLR remming toe te passen in de kliniek, met als doel excessieve ontsteking te beperken die vermoedelijk wordt aangedreven door de overactivatie van een bepaalde TLR.
| Takeda, Kiyoshi, and Shizuo Akira. “TLR signaling pathways.” Seminars in immunologie. Vol. 16. No. 1. Academic Press, 2004. | |
| Akira, Shizuo, and Kiyoshi Takeda. “Toll-like receptor signalling.” Nature reviews immunology 4.7 (2004): 499-511. | |
| Lim, Kian-Huat, and Louis M. Staudt. “Toll-like receptor signaling.” Cold Spring Harbor perspectives in biology 5.1 (2013): a011247. | |
| enTaro Kawai, Takumi Kawasaki. “Toll-like receptor signaling pathways.” Pattern Recognition Receptors and Cancer 8916 (2015): 7. | |
| Gay, Nicholas J., et al. “Assemblage en lokalisatie van Toll-like receptor signaleringscomplexen.” Nature reviews Immunology 14.8 (2014): 546-558. | |
| O’Neill, Luke AJ, Douglas Golenbock, and Andrew G. Bowie. “The history of Toll-like receptors redefining innate immunity.” Nature Reviews Immunology 13.6 (2013): 453-460. | |
| Botos, Istvan, David M. Segal, and David R. Davies. “De structurele biologie van Toll-like receptoren.” Structure 19.4 (2011): 447-459. |