Introduction
Methaan (CH4) is een belangrijk broeikasgas. De uitstoot ervan uit natuurlijke omgevingen zoals wetlands, oceanen en sedimenten is verantwoordelijk voor meer dan 70% van het methaan in de atmosfeer wereldwijd (IPCC, 2007). Een beoordeling van gepubliceerde gegevens bracht verschillende methaanemissiewaarden aan het licht voor wetlands, meren, rivieren, estuaria en oceanen (in afnemende volgorde, aanvullende figuur S1). Natuurlijke wetlands zijn alleen al goed voor 62% van de biogene CH4-productie (Kirschke et al., 2013; Nazaries et al., 2013) en de emissies van wetlands domineren de inter-jaarlijkse variabiliteit van methaanbronnen (Bousquet et al., 2006). Daarentegen draagt het uitgestrekte oppervlak van mariene ecosystemen slechts ongeveer 8% bij aan de natuurlijke bronnen van CH4 (Nazaries et al., 2013). Binnen de wereldwijde oceaanemissie van methaan wordt minder dan 10% bijgedragen door estuaria (Bange et al., 1994).
Methanogenese, de biologische vorming van methaan, wordt uitgevoerd door methanogene archaea die methaan voornamelijk produceren uit H2/CO2, methylgroepen of acetaat onder anoxische omstandigheden (Thauer et al., 2008). Deze reactie wordt gekatalyseerd door het methyl-co-enzym M-reductase (MCR). Het mcrA-gen dat codeert voor een subeenheid van dit enzym is een veelgebruikte genmarker in moleculaire onderzoeken (Conrad, 2007; Bridgham et al., 2013). Het voordeel van de mcrA-genmarker is dat hij zowel de fylogenetische als de functionele signatuur van methanogenen vastlegt, waardoor hij een grote sequendiediepte biedt voor deze specifieke functie (Luton et al., 2002; Borrel et al., 2013; Yang et al., 2014). Een groot aantal mcrA-sequenties werd opgehaald uit een verscheidenheid van natuurlijke omgevingen. De openbare mcrA-dataset maakt het mogelijk om algemene ecologische patronen te extraheren en de vormende milieugradiënten op mondiale en regionale schaal te onderzoeken. Daarnaast is er een database beschikbaar met een overzicht van de fysiologische eigenschappen van 152 methanogene isolaten1 (Jabłoński et al., 2015). Onlangs bracht genoom binning ongewone mcrA sequenties aan het licht in de nieuwe klasse van Methanofastidiosa (Nobu et al., 2016) en de nieuwe fyla van Bathyarchaeota (Evans et al., 2015) en Verstraetearchaeota (Vanwonterghem et al., 2016). Deze nieuwe bevindingen hebben onze kennis over de diversiteit van potentiële methanogenen uitgebreid, maar hebben de toepasbaarheid van het mcrA-gen als moleculaire marker voor de grote meerderheid van methanogene gemeenschappen niet vertroebeld.
Tot op heden zijn methanogene gemeenschappen gedetecteerd in wetlands, sedimenten, permafrostgebieden, rijstvelden, vergisters, geothermische bronnen en hydrothermale vents (Conrad, 2007; Thauer et al., 2008; Wagner en Liebner, 2009). De structuur van de methanogene gemeenschap bleek geassocieerd te zijn met de pH, temperatuur, zoutgehalte, grondwaterstand en vegetatiedynamiek in het milieu op verschillende ruimtelijke en temporele schalen (Megonigal et al., 2005; Milferstedt et al., 2010; Frank-Fahle et al., 2014; McCalley et al., 2014; Cui et al., 2015; Liebner et al., 2015). Zo wordt de acetoclastische methanogenese in het algemeen belemmerd door een lage pH, omdat deze de acetaatdissociatie vermindert (Megonigal et al., 2005; Kotsyurbenko et al., 2007). De vegetatie kan labiele organische koolstof van hoge kwaliteit leveren om methanogenen te voeden in de vorm van wortelexudaten of detritus, zodat plantenexudaten over het algemeen acetoclastische methanogenen bevoordelen, voornamelijk in vennen (Bridgham et al., 2013). Sulfaat uit zeewater remt de methaanproductie in getijdenwetlands, en het zoutgehalte is bijgevolg gebruikt als een algemene voorspeller voor methaanemissies (Holm et al., 2016). Een studie op Tibetaanse meersedimenten toonde aan dat toenemende saliniteit hydrogenotrofe methanogenen remt, maar acetoclastische methanogenese versterkt (Liu et al., 2016). Deze studies wezen op milieudrivers voor methanogene gemeenschappen, maar hebben zich gericht op enkele habitats of beperkte ruimtelijke schalen.
Inzicht in de aanpassing van methanogenen aan verschillende milieuveranderingen vereist echter een systematische en wereldwijde verkenning van de correlaties tussen de samenstelling van microbiële gemeenschappen en milieuomstandigheden (Lozupone en Knight, 2007). Op dit moment zijn er slechts een paar studies die zich richten op dispersie en habitatfiltering van methanogene gemeenschappen (Auguet et al., 2010; Barreto et al., 2014). Wij stellen de hypothese voorop dat methanogene assemblages voornamelijk beïnvloed worden door habitatfiltering en dat dit gestuurd wordt door globale milieu-invloeden. Gezien het feit dat methaanemissies sterk verschillen tussen natuurlijke ecosystemen, kan de expliciete integratie van de samenstelling, diversiteit en biogeografie van methanogene assemblages in deze ecosystemen van fundamenteel belang zijn om de respons van methaanproductie op huidige en toekomstige klimaatverandering te bepalen. Deze metastudie is uitgevoerd om de hiaten te vullen die geassocieerd zijn met methanogene biogeografie, diversiteit en de milieucontroles daarvan, door gebruik te maken van openbaar beschikbare mcrA-sequentiegegevens en literatuur, aangevuld met fysiologische gegevens van methanogene isolaten.
Materialen en methoden
Gegevensverzameling
We hebben mcrA-sequenties opgezocht die beschikbaar zijn in GenBank (januari 2016)2. Voor elke hit werd de oorspronkelijke paper gecontroleerd en de bijbehorende mcrA-sequenties werden door een aangepast Perl-script geparsed. Aangezien we ons richtten op natuurlijke omgevingen, werden methanogene mcrA-sequenties verkregen uit natuurlijke habitats en geclassificeerd als bodem, meer-, estuariene-, mariene en hydrothermale sedimenten, en moddervulkanen. Vijf bibliotheken van next generation sequencing (NGS) werden opgenomen naast sequenties van kloonbibliotheken. De sequenties werden gedownload zonder rekening te houden met de relatieve abundantie in de oorspronkelijke dataset. Omdat sequenties van kloonbibliotheken vooral de overvloedige fylotypes bestrijken terwijl NGS een veel diepere diversiteit kan vastleggen, hebben we een compromis gesloten om de NGS-gegevens te gebruiken maar een potentiële fout als gevolg van verschillende resolutie van sequencingmethoden te beperken. Daarom kozen we alleen de representatieve sequenties van overvloedige OTU’s met een relatieve abundantie van meer dan 1%. Verder verwierpen we de NGS-sequenties die niet voldeden aan de vertaalcontrole van nucleotide naar eiwitsequenties of van lage kwaliteit waren (sequenties < 250 bps). Uiteindelijk construeerden we een dataset met 4466 unieke mcrA-sequenties van 94 wereldwijd verspreide locaties (figuur 1 en aanvullende tabellen S1, S2). Bovendien hebben we de mcrA-sequenties van potentiële archaeale methanotrofen niet van de dataset afgetrokken, omdat die onvermijdelijk in het genoomonderzoek aan het licht waren gekomen (Conrad, 2007). Dit deel valt buiten de focus van deze studie.
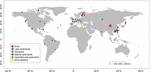
FIGUUR 1. Ligging van de voor deze studie gebruikte locaties. De locaties zijn op basis van hun habitat in zes verschillende categorieën ingedeeld en met verschillende kleuren gelabeld. Een overzicht van de zes habitats wordt gegeven in de aanvullende tabellen S1 en S2.
De geografische coördinaten en de milieu-instellingen, met inbegrip van pH, zoutgehalte, hoogte, gemiddelde jaarlijkse luchttemperatuur (MAAT) en gemiddelde jaarlijkse neerslag (MAP), werden voor elke onderzoekslocatie die in deze studie in aanmerking werd genomen, uit de overeenkomstige publicaties gehaald, voor zover de gegevens beschikbaar zijn (zie aanvullende tabel S1). Om rekening te houden met ontbrekende milieuparameters in meerdere studies, hebben we sommige milieuvariabelen kwalitatief gedefinieerd volgens de locatiebeschrijvingen in de relevante literatuur, en vervolgens deze categoriegegevens omgezet in semi-metrische numerieke waarden, bijvoorbeeld, we hebben mariene sedimenten, hydrothermale sedimenten, vulkanische modder en sodameer-sedimentmonsters gedefinieerd als “zout”, bodem- en zoetwater-meer-sedimentmonsters als “niet-zout”, en mangrove- en estuarismonsters als “gemengde” monsters.
Raw Sequence Processing
De sequentie verwerking werd uitgevoerd met de Mothur software platform (Schloss et al., 2009). Sequenties van verschillende bibliotheken werden gepoold vóór de verwerking. Sequenties met een lengte van minder dan 350 bp of met meer dan 8 dubbelzinnige basen werden verwijderd. Vervolgens werden deze sequenties uitgelijnd met een vooraf uitgelijnde subset van mcrA-sequenties, die werden opgehaald uit de FunGene database op http://fungene.cme.msu.edu/ (Fish et al., 2013). Chimerische sequenties werden geïdentificeerd met de Mothur software met behulp van de uchime methode (Edgar et al., 2011) met de dataset zelf als referentie. Vervolgens werden de geldige mcrA-gen nucleotidesequenties gebruikt voor de berekening van ongecorrigeerde paarsgewijze afstanden tussen uitgelijnde DNA-sequenties en verder toegewezen aan operationele taxonomische eenheden (OTU) met een cutoff van 84%, wat overeenkomt met 97% voor het 16S rRNA-gen (Yang et al., 2014). De abundantie van elke mcrA OTU werd alleen verantwoord als aan- of afwezigheid. We verhoogden de nauwkeurigheid van de taxonomische classificatie van de OTU’s door zowel nucleotide- als aminozuursequenties in aanmerking te nemen. Op DNA-niveau werd de taxonomische identiteit toegekend door het Mothur-platform volgens een referentiedatabank (Yang et al., 2014). Op eiwitniveau werden de uitgelijnde eiwitsequenties gebruikt om een boom in ARB te construeren, en vervolgens werd de taxonomische toewijzing gebaseerd op de overeenkomstige database. Als de toewijzing van een OTU inconsistent was, blasten we zowel de nucleotide- als de eiwitsequentie handmatig in NCBI en bepaalden we de uiteindelijke taxonomische identiteit door rekening te houden met de querydekking (>95%), identiteit (>84%), en e-waarde (<1E-5). Voor eiwitsequenties verwees de cutoff op genusniveau naar de drempel van 83,5% (Hunger et al., 2011).
Ecologische en statistische analyse
De statistische analyse werd uitgevoerd met verschillende R-pakketten. Principal coordinates analysis (PCoA) ordinaties werden gegenereerd op basis van Jaccard afstandsmatrices geconstrueerd met behulp van het vegan pakket v2.2.0 (Oksanen et al., 2015). Permutationele MANOVA (multivariate variantieanalyse) werd uitgevoerd om de bron van variatie in de Jaccard-matrix te beoordelen (McArdle en Anderson, 2001) in vegan met 104 permutaties. De Jaccard-afstandsmaat is gebaseerd op de aan-/afwezigheid van de soorten, wat geschikter is voor onze dataset, aangezien de meeste studies alleen de representatieve sequenties verstrekten, terwijl de informatie over de abundanties ontbreekt. De taxonomische incidentiefrequenties over de habitats werden gevisualiseerd door middel van bubbelplots met het ggplot2-pakket (v1.0.0) (Wickham, 2009). Hiërarchische clusteringanalyse van de niet-zout bodem- en meersedimentgemeenschappen werd uitgevoerd met de R-functie ‘hclust’ (R Core Team, 2014). De verkregen gemeenschapsclusters werden beschreven volgens het pH- en temperatuurregime van de oorspronkelijke monsters, omdat we met behulp van PCoA vooraf hadden vastgesteld dat beide parameters pH en temperatuur de samenstelling van de methanogene gemeenschap in niet-alische bodems en meersedimenten beïnvloeden. De associatie van elke methanogene lineage met elk van deze clusters werd bepaald met behulp van correlatie-gebaseerde indicatorsoortenanalyse (Dufrene en Legendre, 1997). Indicatorsoorten worden hier gedefinieerd als soorten die zowel overvloedig voorkomen in een specifiek type habitat (specificiteit) als overwegend in dit type habitat (trouwheid). In deze studie werden de indicatortaxa, vergelijkbaar met het indicatorsoortenconcept, voor niet-zoutere bodems en meersedimenten uitgekozen volgens een indicatorwaarde (IndVal-waarde) door het R-pakket labdsv (Roberts, 2016) als de waarschijnlijkheid van het verkrijgen van een indicatorwaarde die even hoog is als waargenomen over de opgegeven iteraties kleiner is dan 0,05. De Chao2-indices werden voor elke steekproef berekend met het vegan-pakket. De Wilcoxon rank sum test van Chao2 indices tussen habitats werd uitgevoerd door de R functie ‘wilcox.test’ (R Core Team, 2014). Om de impact van habitatfiltering op methanogene archaea isolaten te consolideren, werden de fysiologische en biochemische kenmerken van beschreven methanogene culturen opgehaald uit de3 ‘Methanogenic archaea database’ (Jabłoński et al., 2015). Daaronder werden de isolaten met informatie over optimale NaCl-behoefte gefilterd, gecategoriseerd en uitgezet volgens hun isolatiebron.
Om de invloed van dispersiebeperking op de methanogene gemeenschapsstructuur te onderzoeken, werd een lineaire regressieanalyse uitgevoerd op basis van een geografische afstandsmatrix en een Jaccard-afstandsmatrix van de gemeenschap door de R-functie ‘lm’ (R Core Team, 2014). We voerden Mantel- en partiële Mantel-tests uit om de effecten van dispersiebeperking volgens de twee matrices te evalueren, opnieuw met behulp van het vegan-pakket in R (Oksanen et al., 2015). Verder werd multivariate ruimtelijke analyse (ruimtelijke PCA) toegepast op 16 Europese bodem- en meersedimentmonsters op basis van Moran’s I-index om de ruimtelijke structuur van methanogenen te onderzoeken met de functie “multispati” in het R ade4-pakket (Dray en Dufour, 2007). Bovendien werd de Ward’s Minimum variantie clustering die gebaseerd was op de Jaccard afstandsmatrix geïmplementeerd op deze 16 monsters met behulp van de R-functie “hclust” (R Core Team, 2014) en projecteerden we de clusteringresultaten verder op een geografische kaart. Het Europese shapefile voor kartering op deelstaatniveau is beschikbaar in de GSHHG Database (v2.3.6)4. De kaart werd gegenereerd met behulp van QGIS v2.18.25.
Results
Biogeography of Methanogenic Archaea in Natural Environments
De mcrA-gensequenties van 94 wereldwijd verspreide natuurlijke omgevingen werden opgehaald. De locatie en het ecosysteemtype van elk van deze 94 locaties is afgebeeld in figuur 1. De incidentie (aanwezigheid/afwezigheid) frequenties van methanogene lineages werden samengevoegd volgens ecosysteemtype en geïllustreerd in figuur 2. Kort samengevat is Methanoregula het meest frequent waargenomen taxon in bodems, samen met Methanobacterium, Methanosaeta, Methanocella, Methanomassiliicoccus, en Methanosarcina. In estuaire sedimenten werden vaak sequenties aangetroffen van Methanosaeta, Methanobacterium, Methanoregula, en Methanoculleus. Bovendien kwamen in de sedimenten van meren vooral Methanoregula en Methanosaeta voor. In mariene sedimenten zijn Methanoculleus en Methanosaeta de meest voorkomende lijnen, gevolgd door Methanolinea.
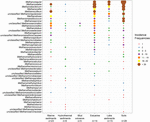
FIGUUR 2. Bubbelplot met de incidentiefrequenties van methanogene lineages in verschillende natuurlijke omgevingen. De rangorde langs de verticale as komt overeen met de afnemende totale incidentiefrequenties van de lineages. De taxonomie wordt weergegeven voor het genusniveau. Als een toewijzing aan het genusniveau niet mogelijk was, werd het eerstvolgende hogere taxonomische niveau gebruikt. Het aantal monsters (n) wordt voor elke habitat gegeven.
Ondanks het feit dat vele taxa in verschillende milieus werden waargenomen, vertonen sommige toch milieuvoorkeuren. Methanoregula, het taxon dat vaak voorkomt in niet-mariene en overgangsmilieus (bodems, sedimenten van meren en estuaria), is afwezig in mariene habitats (mariene sedimenten, hydrothermale sedimenten en moddervulkanen). Methanobacterium en Methanocella, die overheersen in de niet-mariene en overgangsmilieus, worden zelden aangetroffen in mariene habitats. Methanococcoides daarentegen, die een overheersende stam is in mariene sedimenten, hydrothermale sedimenten en moddervulkanen, wordt nauwelijks waargenomen in bodems en meersedimenten. Bovendien worden Methanogenium en Methanolacinia alleen waargenomen in estuaria en mariene sedimenten, terwijl Methanospirillum en Methanosphaerula alleen in terrestrische milieus worden aangetroffen. Bovendien worden sommige specifieke taxa uitsluitend in hydrothermale sedimenten aangetroffen, waaronder Methanocaldococcus, Methanothermococcus, Methanopyrus, Methanotorris, en Methanococcus. Hoewel sommige lijnen zoals Methanosaeta in de meeste milieus aanwezig zijn, kan geen enkele lijn als alomtegenwoordig worden beschouwd.
De grootste rijkdom aan lijnen kwam voor in sedimenten van estuaria, die ook meer gelijkmatige incidentiefrequenties van verschillende lijnen herbergen. Moddervulkaan- en hydrothermale ecosystemen daarentegen vertonen een relatief lage methanogene diversiteit. Bodems en meersedimenten, vergelijkbaar met estuaria, worden gekenmerkt door diverse methanogene assemblages.
Alpha-Diversity of Methanogenic Communities in Natural Environments
De rijkdom van methanogene archaea volgens de Chao2 index varieerde sterk tussen de verschillende ecosysteemtypes (Figuur 3). Om de alfa-diversiteiten rechtstreeks te kunnen vergelijken en om een redelijke afweging tussen de monsters te kunnen maken, werd voor elke locatie een subsampling tot 15 sequenties uitgevoerd. De Chao2 -index toont aan dat de sedimenten van estuaria de hoogste soortenrijkdom aan methanogenen van de zes ecosysteemtypes omvatten (aanvullende tabel S3), wat de resultaten van de bubbelplot (figuur 2) onderstreept. Bodem- en meersedimenten, die een lagere rijkdom vertonen dan estuariene monsters, hebben significant hogere Chao2 -indices dan mariene sedimenten en hydrothermale sedimenten en zonder significante verschillen tussen mariene sedimenten en hydrothermale sedimenten (aanvullende tabel S3).
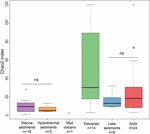
FIGUUR 3. Boxplot van Chao2 -indices van de verschillende ecosysteemtypes. De plot is gebaseerd op subsampling datasets met 15 sequenties voor elke locatie om de vergelijking op alfa-diversiteitsmaatstaven robuuster te maken. Het aantal monsters in elke habitat wordt aangegeven met “n” onder het habitatlabel. De ‘ns’ geeft geen statistische significantie in de Wilcoxon test. Het statistische resultaat van de alfa-diversiteit op OTU-niveau wordt gegeven in de aanvullende tabel S3.
Global Controls on Methanogenic Communities in Natural Environments
De 94 wereldwijd verspreide methanogene gemeenschappen werden geclusterd in een ordinatieplot door PCoA toe te passen op basis van de Jaccard-afstandsmatrix. Volgens de PCoA analyse verklaren de eerste en tweede as samen 16.3% van de totale variantie. De variaties tussen de monsters kunnen dus grotendeels worden verklaard door het zoutgehalte (figuur 4). Aangezien in sommige gevallen geen initiële gegevens over de zoutconcentraties beschikbaar waren, hebben we deze monsters kwalitatief ingedeeld als zoute, gemengde (intermediaire) en niet-zoute monsters, zoals hierboven beschreven. De zoute en niet-zoute monsters worden effectief gescheiden langs de eerste as. De gemengde monsters groeperen zich globaal tussen de zoute en niet-zoutrijke monsters in. De permutationele MANOVA op basis van de Jaccard-afstandsmatrix suggereert eveneens dat het zoutgehalte de voornaamste abiotische factor is die de verspreiding van de methanogene gemeenschappen wereldwijd beheerst (R2 = 0,099, P < 0,001) (Tabel 1).
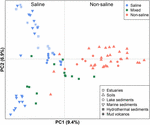
FIGUUR 4. Principal coordinates analysis (PCoA)-ordening op basis van de Jaccard-afstandsmatrix van methanogene mcrA-gensequentiebibliotheken, waarbij 94 monsters worden vergeleken. De PCoA is gekleurd volgens saliniteit: De rode symbolen wijzen op niet-zout milieu, de blauwe op zout milieu, en de groene op intermediair milieu. Verschillende symbolen geven verschillende omgevingen aan. Het percentage van de variatie dat door de uitgezette hoofdcoördinaten wordt verklaard, wordt op de assen aangegeven.

TABLE 1. Permutationele MANOVA-analyse op de Jaccard-afstandsmatrix van alle monsters uit de zes habitats om de associatie van de gemeenschapsvariantie met verschillende omgevingsvariabelen te testen.
Daarnaast controleerden we op een mogelijke relatie tussen de isolatiebron van methanogene reinculturen en de optimale concentratie NaCl voor groei. De optimale NaCl-concentratie van de methanogene zuivere culturen vertoonde een afname van mariene naar estuaria, meersedimenten en bodemecosystemen (aanvullende figuur S2). Enkele uitbijterisolaten zijn afkomstig uit sedimenten van sodameren of hypersaline bodems.
Milieucontroles en methanogene indicator-taxa in niet-zoutwaterige bodems en meersedimenten
Op wereldschaal zijn methanogene gemeenschappen van niet-zoutwaterige bodems en meersedimenten sterk geclusterd (Figuur 4), zodat we de milieucontroles van methanogene gemeenschappen van deze twee habitats, die in totaal 33 studiesites omvatten, verder hebben geanalyseerd. Clusteranalyse op basis van de gemeenschap voor deze twee typen habitats onthulde vier clusters op basis van de Jaccard-afstandsmatrix (supplementaire figuur S3). Permutationele MANOVA suggereren dat zowel pH (R2 = 0.099, P < 0.001) als temperatuur (R2 = 0.069, P < 0.001) de methanogene β-diversiteit in niet-zout bodems en meersedimenten beïnvloeden (Tabel 2). Bijgevolg hebben wij de vier clusters toegewezen aan de pH en MAAT van de initiële bemonsteringsplaats en hebben wij grotendeels consistente subgroepen verkregen voor de clustering van de gemeenschap (Figuren 5C,D). De combinatie van milieukenmerken en deze vier gemeenschapsclusters stelt ons in staat deze vier subgroepen te definiëren als neutraal en koud groep 1, zuur en koud groep 2, zuur en matig groep 3, en neutraal en warm groep 4 (Figuur 5). Verdere PCoA-ordening op basis van de Jaccard-verschillenmatrix suggereert dat langs de PC1-as de meeste monsters van groep 2 en groep 3 afkomstig zijn van zure bodems en meersedimenten, terwijl groep 1 en groep 4 voornamelijk afkomstig zijn van neutrale milieus (Figuur 5A). Bovendien scheiden de monsters van gematigde locaties (groep 3) zich langs PC2 van die van warme en koude locaties, terwijl de monsters van de warme milieus (groep 4) zich langs PC3 van de andere monsters scheiden (figuur 5B). Daarmee verklaren de eerste drie assen van de PCoA-ordening 38,8% van de totale variatie.

TABEL 2. Permutationele MANOVA op basis van een Jaccard-afstandsmatrix van niet-zout bodem- en meersedimentmonsters om de associatie van gemeenschapsvariantie met verschillende milieuvariabelen te testen.
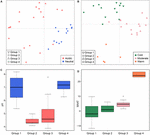
FIGUUR 5. Principal coordinates analysis plot op basis van een Jaccard afstandsmatrix voor 33 niet-zoutrijke bodems en meersedimenten. Subplot (A) toont PC1 en PC2 en de symbolen zijn gekleurd volgens pH, en subplot (B) toont PC2 en PC3 en de symbolen zijn gekleurd volgens temperatuur. De eerste drie componenten verklaren 17,1, 11,7, en 10% van de variantie. De boxplots tonen de pH (C) en MAAT (gemiddelde jaarlijkse luchttemperatuur) (D) van vier geïdentificeerde subgroepen. De kleur van de box in figuur C correspondeert met de pH-categorie in (A). De kleuren van de boxplots geven de statistische significantie aan op basis van een paarsgewijze Wilcoxon test (P < 0.05), waarbij de monsters met dezelfde kleur niet significant van elkaar verschillen. Op dezelfde manier volgt de kleur in (D) de temperatuurgroepering in (B). De subgroepen verwijzen naar de hiërarchische clusteranalyse van de overeenkomsten tussen de gemeenschappen.
Wij onderzochten het voorkomen van methanogene lineages in elke subgroep op basis van de incidentiefrequenties (figuur 6). Methanoregula overheerst in alle soorten niet-ziliene habitats. Naast Methanoregula vertoont de neutrale en koude subgroep (groep 1) een hoge abundantie van Methanosaeta, Methanobacterium, en Methanosarcina. De zure en koude groep 2 wordt vertegenwoordigd door Methanobacterium, Methanocella, en Methanosarcina, terwijl Methanosaeta hier afwezig is. Methanocella en Methanosaeta komen veel voor in de zure en matige groep 3. In de neutrale en warme groep 4 zijn Methanolinea en Methanosaeta belangrijke leden. Deze groep is de enige groep waarin Methanoculleus is geïdentificeerd.

FIGUUR 6. Incidentie-frequenties van methanogene lineages binnen de vier gedefinieerde groepen van methanogene gemeenschappen in bodems en meersedimenten. De verticale as is gerangschikt in alfabetische volgorde. De lengte van de staaf komt overeen met de gemiddelde incidentiefrequentie voor elke lineage binnen de overeenkomstige groep. De foutbalkjes geven de standaardafwijking van een bepaald taxon over verschillende monsters in die groep weer. Asterisken geven de gespecialiseerde taxa met P-waarde < 0.05 aan. De taxonomie wordt weergegeven voor het genusniveau. Als een toewijzing aan het genusniveau niet mogelijk was, werd het eerstvolgende hogere taxonomische niveau gebruikt. De beschrijving voor de vier groepen wordt gegeven in figuur 5.
Voor alle vier groepen zijn de taxa met een hoge incidentie Methanoregula, Methanobacterium, Methanosarcina, Methanosaeta, Methanomassiliicoccus, en Methanocella. De gespecialiseerde taxa, die significant meer vertegenwoordigd zijn op de meeste locaties binnen een bepaalde groep, werden opgespoord volgens de indicator-soortenanalyse zoals eerder beschreven. In totaal vertoonden zes van de 31 taxa een significante indicatorwaarde (P < 0.05) (gelabeld met asterisk in Figuur 6). Groep 1 (neutraal en koud) toonde het grootste aantal specialisten met lineages van Methanosaeta, Methanolobus, en Methanomethylovorans. Methanobacterium diende als specialist taxon in de koude en zure groep 2 terwijl Methanolinea als specialist werd geïdentificeerd in groep 4 (neutraal en warm) maar nauwelijks werd waargenomen in andere groepen. Bovendien is Methanoregula grotendeels vertegenwoordigd in de zure en matige groep 3.
Dispersal Limitation
Een lineaire regressie-analyse (R2= 0.05, P < 0.001) gaf een zwakke correlatie aan tussen geografische afstand en methanogene gemeenschapsstructuur op de globale dataset. Tegelijkertijd bleek uit een Mantel-test dat de milieuvariabelen een hogere correlatie hebben met de gemeenschapsstructuur dan de geografische afstanden (zie tabel 3). Deze tendens wordt ook bevestigd door een partiële Mantel-test die controleert voor autocorrelatie-effecten. Het uitzetten van de geografische afstand tegen de Jaccard-gemeenschapssamenhang vertoont geen duidelijke lineaire trend, maar patronen die hoofdzakelijk voortvloeien uit de globale verdeling van de bemonsteringspunten (zie supplementaire figuur S4).

TABLE 3. Mantel- en partiële Manteltoetsanalyses voor de bepaling van de invloed van milieuvariabelen en geografische afstand op de microbiële distributie voor de globale dataset en een deelsteekproef van 16 Europese monsters.
Om de invloed van dispersie verder te analyseren, beperkten wij onze analyse tot Europa, waar de dichtste en meest gelijkmatige bemonstering plaatsvond. Manteltoetsen en partiële Manteltoetsen op deze subset reproduceerden de trend dat de gemeenschapsgegevens sterker gecorreleerd zijn met de milieuvariabelen dan met de geografische afstanden (zie Tabel 3). De partiële Mantel-test met controle voor de milieuvariabelen kon geen statistisch significante correlatie aantonen tussen de microbiële gemeenschap en de geografische afstand. Een ruimtelijke PCA-analyse van deze 16 Europese locaties impliceert een ruimtelijke structuur van de methanogene gemeenschap (23,7% van de totale variantie werd door deze structuur verklaard) die overeenkomt met een positieve ruimtelijke autocorrelatie van de locaties zoals aangegeven door de Moran’s I-index (Moran’s I = 0,4018). Alleen de eerste eigenwaarde was stabiel en kwam overeen met een scheiding van de monsters tussen Centraal-Europa en de Baltische Staten (aanvullende figuur S5). De kleine gegevensverzameling bemoeilijkt echter een robuuste toewijzing van deze waargenomen ruimtelijke structuur aan geografische variabelen, milieuvariabelen of aan beide. Daarom voerden wij een clusteranalyse uit op de methanogene gemeenschappen zoals hierboven beschreven en onthulden drie groepen (Figuur 7A) die wij projecteerden op een geografische kaart (Figuur 7B). De clustering reproduceerde niet de scheiding van de ruimtelijke PCA langs de Oostzee. Bijgevolg vertonen sommige locaties die geografisch zeer dicht bij elkaar liggen, ongelijke methanogene gemeenschapsstructuren en komen ze samen in verschillende clusters. Anderzijds vertonen sommige geografisch zeer ver van elkaar verwijderde locaties een zeer vergelijkbare samenstelling van de gemeenschap en clusteren ze samen (figuur 7B). De regionale verspreiding van de groepen in Europa lijkt niet overeen te komen met of beperkt te worden door een geografische structuur.
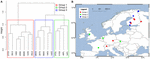
FIGUUR 7. Hiërarchische clusteranalyse van de Jaccard-afstandsmatrix onder 16 Europese bodem- en meersedimentmonsters. Voor de analyse werd de Ward-clustermethode gebruikt. De sites werden verdeeld in drie groepen, gekleurd door verschillende rechthoeken in het clusterdendrogram (A) en werden geprojecteerd op een Europese kaart (B).
Discussie
Het identificeren en toepassen van concepten van biogeografie op microbiële gemeenschappen is van groot belang in de microbiële ecologie. Microbiële biogeografie wordt verondersteld te worden beheerst door de evolutionaire en ecologische wisselwerking van vier belangrijke processen: habitatfiltering, dispersie, drift en mutatie (Hanson et al., 2012). Hoewel de invloed van drift en mutatie buiten het interpretatievermogen van deze studie valt, tonen wij aan dat er wereldwijde patronen bestaan van methanogene gemeenschappen in natuurlijke milieus. Deze studie toont een wereldwijd biogeografisch patroon van methanogene gemeenschappen aan dat meer geassocieerd is met habitatfiltering dan met geografische dispersie. Methanogene gemeenschappen uit sedimenten van sodameren, bijvoorbeeld, clusteren nauw met geografisch verafgelegen mariene monsters (figuur 4) en zeer vergelijkbare methanogene gemeenschappen komen voor in Europese bodem- en meersedimenten, ondanks dat ze op grote afstand van elkaar liggen (figuur 7). Onze pogingen om mogelijke dispersiebeperkingen aan het licht te brengen, hebben een zwakke invloed van de geografische locatie op de structuur van de methanogene gemeenschap aan het licht gebracht, in tegenstelling tot een duidelijke invloed van de milieuomstandigheden. Een sluitende uitsluiting van ruimtelijke effecten op de microbiële gemeenschappen is met de beschikbare datapunten niet mogelijk. De monsternemingspunten zijn gericht op bepaalde habitats en/of gebieden, terwijl het totale aantal monsters laag is. Als er een effect is, nemen wij aan dat ruimtelijke effecten alleen op regionale of lokale schaal optreden. Lokale dispersiebeperkingen werden gerapporteerd voor hyperthermofiele archaea veroorzaakt door geografische barrières (Whitaker et al., 2003), ammonia-oxiderende bacteriën op lokale zoutmoerassen, maar niet op regionale en continentale schaal (Martiny et al., 2011), micro-organismen in diepzeesedimenten samen met milieu-instellingen (Schauer et al., 2009), en voor bacteriën van een grote reeks heterogene sneeuwmilieus meestal veroorzaakt door de beschikbaarheid van allochtone koolstof (Lutz et al., 2016). Een geringe invloed van dispersiebeperking op methanogenen in natuurlijke omgevingen betekent dat methanogenen zich willekeurig over de ruimte kunnen verspreiden, met succes door de lokale omgeving worden geselecteerd als aan hun fysiologische vereisten wordt voldaan en stabiele gemeenschappen kunnen vestigen (Martiny et al., 2006; von Mering et al., 2007).
Het concept van habitatfiltering impliceert dat soorten met vergelijkbare ecologische vereisten vaker samen moeten voorkomen dan op grond van toeval wordt verwacht (Weiher en Keddy, 2001; Cornwell et al., 2006; Ulrich et al., 2010). Onze resultaten tonen aan dat er grote verschillen zijn in de samenstelling van methanogene gemeenschappen tussen mariene ecosystemen en ecosystemen in wetlands en meren, terwijl estuaria daartussenin clusteren. Biogeografiepatronen op basis van een reeks genenonderzoeken op milieumonsters werden ook gerapporteerd voor algemene bacteriën (Nemergut et al., 2011), het methaan seep microbioom (Ruff et al., 2015), ammonia-oxiderende archaea (Cao et al., 2013), mariene pelagische en benthische bacteriën (Zinger et al., 2011), en stikstof-cyclende micro-organismen (Church et al., 2008). Habitatfiltering werd specifiek gerapporteerd voor ongecultiveerde archaea (Auguet et al., 2010), volledige bacteriële gemeenschappen in diverse omgevingen (von Mering et al., 2007; Chaffron et al., 2010) of in Zuid-Amerikaanse veengebieden op regionale schaal (Oloo et al, 2016), maar ook specifieke bacteriegroepen zoals methaanoxiderende (Knief, 2015) en stikstoffixerende bacteriën (Nelson et al., 2016).
Onze resultaten geven aan dat op wereldschaal het zoutgehalte de samenstelling van de methanogene gemeenschap aanzienlijk regelt en grote verschillen bepaalt tussen mariene en terrestrische methanogene assemblages. Ook methanogenen uit sedimenten van sodameren clusteren met die uit mariene sedimenten (figuur 4), wat de wereldwijde invloed van het zoutgehalte benadrukt. Dit resultaat is in overeenstemming met andere studies op basis van het 16S rRNA-gen, waaruit blijkt dat het zoutgehalte een primaire factor is die de wereldwijde patronen van de algemene bacteriële en algemene archaeale gemeenschappen bepaalt (Lozupone and Knight, 2007; Auguet et al., 2010; Caporaso et al., 2011; Cao et al., 2013). Een geringe invloed van geografische scheiding maar een sterke invloed van saliniteit op algemene microbiële gemeenschappen werd ook waargenomen in eerdere studies (Logares et al., 2013; Yang et al., 2016). Het zoutgehalte bepaalt dus in grote mate welke lineages kunnen overleven. In verschillende habitats was de methaanproductie negatief gecorreleerd met het zoutgehalte (Bartlett et al., 1987; Potter et al., 2009; Poffenbarger et al., 2011). De remming van de methaanproductie door het zoutgehalte zou dan ook samenvallen met een verminderde omvang van de methanogene populatie (Pattnaik et al., 2000). Het effect van saliniteit op hydrogenotrofe, acetotrofe en methylotrofe methanogenese hangt daarbij af van het saliniteitsniveau en is verschillend voor de verschillende routes van methanogenese (Liu et al., 2016). Momenteel is er geen duidelijk mechanisme om de impact van saliniteit op de gemeenschapsstructuur te verklaren, maar verschillende hypothesen kunnen als mogelijke verklaring dienen. Fysiologisch beïnvloedt saliniteit de externe en interne osmolariteit van cellen. De niet-zoute methanogene cellen hebben fysiologische aanpassingen ontwikkeld om de interne turgordruk tegen te gaan, terwijl de aan zout aangepaste cellen een dergelijke eigenschap hebben verloren (Zinder, 1993). Bovendien kan een toenemend zoutgehalte de methanogenen ertoe aanzetten een groter aandeel compatibele solventen te synthetiseren of op te nemen, wat aanzienlijke energetische en dus metabolische kosten met zich meebrengt (McGenity, 2010). De eigenschap van zouttolerantie komt zelfs tot uiting in de optimale concentratie NaCl voor groei van methanogene zuivere culturen, aangezien we ontdekten dat de isolaten uit mariene sedimenten en hydrothermale sedimenten een significant hogere optimale NaCl-concentratie hebben dan die uit bodems (aanvullende figuur S2).
In de niet-zoute terrestrische ecosystemen, met name in bodems en meersedimenten, wordt de samenstelling van de methanogene gemeenschap bepaald door de combinatie van temperatuur en pH. Bijgevolg kunnen de methanogenen van deze milieus in vier groepen worden ingedeeld (figuur 6). In tegenstelling tot mariene ecosystemen vertonen de niet-zoute terrestrische ecosystemen een grote natuurlijke variabiliteit van zowel pH als temperatuur. Temperatuur kan niet alleen de methanogene route, maar ook de methanogene populaties zelf beïnvloeden (Conrad, 2007; Rooney-Varga et al., 2007). De methaanproductie kan sterk toenemen als de temperatuur stijgt als gevolg van de temperatuurgevoelige stappen tijdens fermentatie en acetogenese (Megonigal et al., 2005; Kotsyurbenko et al., 2007). Bovendien kan een lage pH de beschikbaarheid van acetaat aanzienlijk beperken door te voorkomen dat acetaat dissocieert en zo de acetoclastische methanogenese negatief beïnvloeden (Fukuzaki et al., 1990; Bridgham et al., 2013). Dit zou een mogelijke reden kunnen zijn dat Methanosaeta afwezig was in groep2, terwijl Methanosarcina kan schakelen tussen verschillende bronnen en niet substantieel werd beïnvloed. Bovendien kan de pH de efficiëntie van methaanproductie en methanogene routes van ombrotrofe naar minerotrofe veengebieden reguleren, door directe remming van beide methanogenese routes en indirect door de effecten op fermentatie (Ye et al., 2012). Daarom kunnen zowel temperatuur als pH direct of indirect de metabole stappen reguleren die geassocieerd zijn met methanogenese en de upstream fermentatie, die substraat levert voor methanogenen.
Methanoregula is alomtegenwoordig en zeer overvloedig in alle vier groepen van terrestrische habitats (Figuur 6), maar vrijwel afwezig in het mariene systeem en kan dus een proxy blijken te zijn voor de invloed van zoet water in het mariene rijk. De wereldwijde relevantie ervan werd onlangs elders gemeld (Yang et al., 2017). Ondanks zijn alomtegenwoordige verspreiding in bodems en meersedimenten, komt Methanoregula voor als een indicatorlijn in zure habitats met gematigde temperaturen. Bovendien blijkt (1) Methanolinea zich vooral te hebben aangepast aan de warme, neutrale terrestrische milieus, (2) Methanobacterium aan de koude, zure milieus, en (3) Methanosaeta aan pH-neutrale milieus, wat consistent is met andere studies (Rosenberg et al., 2014) en de robuustheid van onze benadering onderstreept. In het algemeen zullen de geochemische omstandigheden rond methanogene gemeenschappen leiden tot nichedifferentiatie. Aangezien de nichesortering de neiging heeft om de adaptieve specialisten te verlaten (Langenheder en Székely, 2011), genereerde de progressieve milieuselectie op lange termijn een verscheidenheid aan niches die werden gevuld door een reeks endemische habitatspecialisten, die mogelijk minder vertegenwoordigd of afwezig zijn in andere verschillende milieuomstandigheden. De gemeenschap wordt ook gevormd door biotische factoren, zoals ecologische interacties, dynamiek, competitie en symbiose. Ondanks deze biologische factoren ontdekten von Mering et al. (2007) dat habitatvoorkeuren vaak opmerkelijk stabiel zijn in de tijd en dat de onderscheidende taxonomische samenstelling van milieugemeenschappen op hun beurt een belangrijke indicator kan zijn van hun ecologie en functie.
Consistent met de habitatvoorkeur van methanogene archaea, blijkt dat nauw verwante methanogene stammen vaak werden geïsoleerd uit vergelijkbare milieus. Methanoregulaceae lijkt bijvoorbeeld vrij divers te zijn in natuurlijke omgevingen (Yang et al., 2017) en neutrale stammen kunnen tot nu toe bestand zijn tegen kweken. De momenteel beschreven stammen van Methanoregula zijn beide verkregen uit licht acidofiele milieus, terwijl de twee vertegenwoordigers van Methanolinea afkomstig zijn uit relatief warme habitats, zoals respectievelijk vergistingsslib en rijstveldgrond (Rosenberg et al., 2014). Hoewel Methanobacterium-stammen uit verschillende milieus werden geïsoleerd, vertoont ongeveer de helft van de bestaande isolaten van dit genus pH-optima iets minder dan 7. Dit betekent dat de indicatorlijnen, die werden geïdentificeerd op basis van de milieusequenties, de differentiaties van fysiologie en bronnen van de bestaande methanogene cultivars zouden kunnen weerspiegelen. Zo kan het zoutgehalte van de habitat, als een algemene eigenschap van de habitat, organismen geleidelijk blootstellen aan sterke milieuselectie en de assemblage filteren van een nieuwe reeks soorten die het best geschikt zijn voor het omgevingszoutgehalte (Logares et al., 2013).
Biodiversiteitsbehoud en -beheer is een primaire uitdaging van onze huidige samenleving. Hier tonen we aan dat methanogene archaea van natuurlijke milieus het meest divers zijn in estuariene sedimenten. Estuaria zijn overgangszones tussen mariene en terrestrische ecosystemen. Dit maakt twee belangrijke processen mogelijk die kunnen bijdragen tot de soortenrijkdom. Ten eerste vermengen microben uit de zee en van het land zich in de estuaria en omvatten uiteindelijk een algemene hoge diversiteit (McLusky en Elliott, 2004). Zo is bijvoorbeeld de grote diversiteit van estuariene bacteriën, archaea, schimmels en zelfs specifieke bacteriën die unieke functies vervullen, waargenomen (Cunliffe et al., 2008; Mosier and Francis, 2008; Crump et al., 2012). Een ander aspect is het hoge nutriëntenniveau als gevolg van de terrestrische, getijde-input waarmee de organismen in het estuarium zich kunnen voeden (McLusky en Elliott, 2004; Statham, 2012). In deze context zijn de estuariene milieus van belang voor het terugwinnen van generische nieuwigheid voor methanogenen. Tot dusver hebben de effecten van soortendiversiteit op ecosysteemprocessen heel wat onderzoeksinspanningen gevergd. Het verband tussen biodiversiteit en ecosysteemfunctie staat nog steeds ter discussie en blijft ongrijpbaar voor microbiële gemeenschappen (Loreau et al., 2001; Tilman et al., 2014). Hoewel bodems en meersedimenten primaire bronnen van methaan zijn en ook habitats met een hoge methanogene diversiteit, stellen wij voor dat de soortenrijkdom geen geschikte proxy is van het methaanproductiepotentieel en de methaanemissies van ecosystemen; het lijkt eerder de heterogeniteit en de geschiedenis van het milieu te weerspiegelen. Rangschikking van de omgevingen volgens hun soortenrijkdom betekent niet noodzakelijkerwijs het potentieel van methaanemissies die het hoogst zijn van bodems en meren en relatief gering van estuaria (figuur 3 en aanvullende figuur S1).
Ten slotte kan het gebrek aan milieu-informatie in de openbare databanken een volledige interpretatie van de hier waargenomen milieudrijfveren hebben belemmerd. Hoewel er in de literatuur en openbare databanken steeds meer sequentiegegevens over methanogenen te vinden zijn, zijn de abiotische variabelen die in verband daarmee worden verstrekt, vaak inconsistent en schaars. De beperkte hoeveelheid consistente informatie voor milieuvariabelen vormt een beperking voor de toepassing van multivariate statistische analyses. Wanneer men bedenkt dat de abiotische factoren in deze studie slechts een beperkt deel van de gemeenschapsvarianties kunnen verklaren, lijkt het erop dat er andere verklarende variabelen ontbreken. Van bijzonder belang zouden de concentraties en de beschikbaarheid van methanogene substraten zoals acetaat, waterstof en methylamines kunnen zijn. Toch zullen abiotische parameters wellicht nooit volstaan om de structuur van methanogene assemblages volledig te verklaren, eenvoudigweg omdat habitats verschillende geschiedenissen hebben en alleen plaatselijk kunnen worden bestudeerd. Bovendien zijn in de beschikbare mcrA-gegevens de uitgestrekte gebieden van het Russische en Canadese subarctische en arctische gebied slecht vertegenwoordigd. Een betere geografische dekking en gelijkmatige verdeling van de mcrA-gen dataset zou de beoordeling van methanogene gemeenschappen op wereldschaal verbeteren.
Author Contributions
SL en XW ontwierpen de studie. XW en SY verzamelden en analyseerden de gegevens. XW, SY, en FH voerden de statistische analyse uit. XW, MW, en SY deed de fylogenetische correctie. XW, SY, FH, MW, DW, en SL interpreteerden de resultaten en schreef het artikel. Alle auteurs droegen bij aan de discussies en beoordeelden het manuscript.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in de afwezigheid van commerciële of financiële relaties die kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
De financiële steun aan XW (Grant No. 201408620031 aan XW) verstrekt door de China Scholarship Council (CSC) wordt dankbaar erkend. Deze studie werd ondersteund door de Helmholtz Gemeinschaft (HGF) door financiering van de Helmholtz Young Investigators Group van SL (VH-NG-919).
Aanvullend materiaal
Het aanvullend materiaal voor dit artikel is online te vinden op: https://www.frontiersin.org/article/10.3389/fmicb.2017.01339/full#supplementary-material
Footnotes
- ^ http://metanogen.biotech.uni.wroc.pl/
- ^ http://www.ncbi.nlm.nih.gov/
- ^ http://metanogen.biotech.uni.wroc.pl/
- ^ https://www.ngdc.noaa.gov/mgg/shorelines/gshhs.html
- ^ http://qgis.osgeo.org
Auguet, J. C., Barberan, A., en Casamayor, E. O. (2010). Global ecological patterns in uncultured Archaea. ISME J. 4, 182-190. doi: 10.1038/ismej.2009.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Bange, H. W., Bartell, U. H., Rapsomanikis, S., and Andreae, M. O. (1994). Methaan in de Oostzee en de Noordzee en een herevaluatie van de mariene emissies van methaan. Glob. Biogeochem. Cycles 8, 465-480. doi: 10.1029/94GB02181
CrossRef Full Text | Google Scholar
Barreto, D. P., Conrad, R., Klose, M., Claus, P., and Enrich-Prast, A. (2014). Distance-decay and taxa-area relationships for bacteria, archaea and methanogenic archaea in a tropical lake sediment. PLoS ONE 9:e110128. doi: 10.1371/journal.pone.0110128
PubMed Abstract | CrossRef Full Text | Google Scholar
Bartlett, K. B., Bartlett, D. S., Harriss, R. C., and Sebacher, D. I. (1987). Methaanemissies langs een zoutmoeras zoutgehalte gradiënt. Biogeochemistry 4, 183-202. doi: 10.1007/BF02187365
CrossRef Full Text | Google Scholar
Borrel, G., O’Toole, P. W., Harris, H. M. B., Peyret, P., Brugere, J. F., and Gribaldo, S. (2013). Fylogenomic data support a seventh order of methylotrophic methanogens and provide insights into the evolution of methanogenesis. Genome Biol. Evol. 5, 1769-1780. doi: 10.1093/Gbe/Evt128
PubMed Abstract | CrossRef Full Text | Google Scholar
Bousquet, P., Ciais, P., Miller, J., Dlugokencky, E., Hauglustaine, D., Prigent, C., et al. (2006). Bijdrage van antropogene en natuurlijke bronnen aan de variabiliteit van methaan in de atmosfeer. Nature 443, 439-443. doi: 10.1038/nature05132
PubMed Abstract | CrossRef Full Text | Google Scholar
Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., and Zhuang, Q. (2013). Methaanemissies uit wetlands: biogeochemische, microbiële en modelleringsperspectieven van lokale tot mondiale schalen. Glob. Chang. Biol. 19, 1325-1346. doi: 10.1111/gcb.12131
PubMed Abstract |Ref Full Text | Google Scholar
Cao, H., Auguet, J.-C., and Gu, J.-D. (2013). Wereldwijd ecologisch patroon van ammonia-oxiderende archaea. PLoS ONE 8:e52853. doi: 10.1371/journal.pone.0052853
PubMed Abstract | CrossRef Full Text | Google Scholar
Caporaso, J. G., Lauber, C. L., Walters, W. A., Berg-Lyons, D., Lozupone, C. A., Turnbaugh, P. J., et al. (2011). Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample. Proc. Natl. Acad. Sci. U.S.A. 108, 4516-4522. doi: 10.1073/pnas.1000080107
PubMed Abstract | CrossRef Full Text | Google Scholar
Chaffron, S., Rehrauer, H., Pernthaler, J., and von Mering, C. (2010). A global network of coexisting microbes from environmental and whole-genome sequence data. Genome Res. 20, 947-959. doi: 10.1101/gr.104521.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Church, M. J., Bjorkman, K. M., Karl, D. M., Saito, M. A., and Zehr, J. P. (2008). Regional distributions of nitrogen-fixing bacteria in the Pacific Ocean. Limnol. Oceanogr. 53, 63-77. doi: 10.4319/lo.2008.53.1.0063
CrossRef Full Text | Google Scholar
Conrad, R. (2007). “Microbial ecology of methanogens and methanotrophs,” in Advances in Agronomy, ed. L. S. Donald (Cambridge, MA: Academic Press), 1-63.
Google Scholar
Cornwell, W. K., Schwilk, D. W., and Ackerly, D. D. (2006). A trait-based test for habitat filtering: convex hull volume. Ecology 87, 1465-1471. doi: 10.1890/0012-9658(2006)872.0.CO;2
PubMed Abstract | CrossRef Full Text | Google Scholar
Crump, B. C., Amaral-Zettler, L. A., and Kling, G. W. (2012). Microbial diversity in arctic freshwaters is structured by inoculation of microbes from soils. ISME J. 6, 1629-1639. doi: 10.1038/ismej.2012.9
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, M., Ma, A., Qi, H., Zhuang, X., Zhuang, G., and Zhao, G. (2015). Warmere temperatuur versnelt de methaanuitstoot van het Zoige wetland op het Tibetaanse Plateau zonder de samenstelling van de methanogene gemeenschap te veranderen. Sci. Rep. 5:11616. doi: 10.1038/srep11616
PubMed Abstract | CrossRef Full Text | Google Scholar
Cunliffe, M., Schafer, H., Harrison, E., Cleave, S., Upstill-Goddard, R., and Murrell, J. C. (2008). Fylogenetische en functionele genanalyse van de bacteriële en archaeale gemeenschappen geassocieerd met de oppervlakte microlaag van een estuarium. ISME J. 2, 776-789. doi: 10.1038/ismej.2008.28
PubMed Abstract | CrossRef Full Text | Google Scholar
Dray, S., and Dufour, A. B. (2007). Het ade4 pakket: implementatie van het dualiteitsdiagram voor ecologen. J. Stat. Softw. 22, 1-20. doi: 10.18637/jss.v022.i04
CrossRef Full Text | Google Scholar
Dufrene, M., and Legendre, P. (1997). Species assemblages and indicator species: the need for a flexible asymmetrical approach. Ecol. Monogr. 67, 345-366. doi: 10.2307/2963459
CrossRef Full Text | Google Scholar
Edgar, R. C., Haas, B. J., Clemente, J. C., Quince, C., and Knight, R. (2011). UCHIME verbetert gevoeligheid en snelheid van chimera detectie. Bioinformatics 27, 2194-2200. doi: 10.1093/bioinformatics/btr381
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, P. N., Parks, D. H., Chadwick, G. L., Robbins, S. J., Orphan, V. J., Golding, S. D., et al. (2015). Methaanmetabolisme in het archaeale fylum Bathyarchaeota geopenbaard door genome-centric metagenomics. Science 350, 434-438. doi: 10.1126/science.aac7745
PubMed Abstract | CrossRef Full Text | Google Scholar
Fish, J. A., Chai, B., Wang, Q., Sun, Y., Brown, C. T., Tiedje, J. M., et al. (2013). FunGene: de functionele gen pijplijn en repository. Front. Microbiol. 4:291. doi: 10.3389/fmicb.2013.00291
PubMed Abstract | CrossRef Full Text | Google Scholar
Frank-Fahle, B. A., Yergeau, E., Greer, C. W., Lantuit, H., and Wagner, D. (2014). Microbial functional potential and community composition in permafrost-affected soils of the NW Canadian Arctic. PLoS ONE 9:e84761. doi: 10.1371/journal.pone.0084761.g001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fukuzaki, S., Nishio, N., and Nagai, S. (1990). Kinetiek van de methanogene fermentatie van acetaat. Toepassing van milieu. Microbiol. 56, 3158-3163.
Google Scholar
Hanson, C. A., Fuhrman, J. A., Horner-Devine, M. C., and Martiny, J. B. (2012). Voorbij biogeografische patronen: processen die het microbiële landschap vormgeven. Nat. Rev. Microbiol. 10, 497-506. doi: 10.1038/Nrmicro2795
PubMed Abstract | CrossRef Full Text | Google Scholar
Holm, G. O., Perez, B. C., McWhorter, D. E., Krauss, K. W., Johnson, D. J., Raynie, R. C., et al. (2016). Ecosysteemniveau methaanfluxen van zoetwatergetijde- en brakke moerassen van de Mississippi River Delta: implicaties voor kustwetlandkoolstofprojecten. Wetlands 36, 401-413. doi: 10.1007/s13157-016-0746-7
CrossRef Full Text | Google Scholar
Hunger, S., Schmidt, O., Hilgarth, M., Horn, M. A., Kolb, S., Conrad, R., et al. (2011). Competing formate- and carbon dioxide-utilizing prokaryotes in an anoxic methane-emitting fen soil. Application Environ. Microbiol. 77, 3773-3785. doi: 10.1128/AEM.00282-11
PubMed Abstract | CrossRef Full Text | Google Scholar
IPCC (2007). “Climate Change 2007: the Physical Science Basis,” in Proceedings of the Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change, eds D. Qin, S. Solomon, M. Manning, Z. Chen, M. Marquis, K. B. Averyt, et al. (Cambridge: Cambridge University Press).
Google Scholar
Jabłoński, S., Rodowicz, P., and Łukaszewicz, M. (2015). Methanogene archaea database met fysiologische en biochemische kenmerken. Int. J. Syst. Evol. Microbiol. 65, 1360-1368. doi: 10.1099/ijs.0.000065
PubMed Abstract | CrossRef Full Text | Google Scholar
Kirschke, S., Bousquet, P., Ciais, P., Saunois, M., Canadell, J. G., Dlugokencky, E. J., et al. (2013). Drie decennia van wereldwijde methaanbronnen en -putten. Nat. Geosci. 6, 813-823. doi: 10.1038/Ngeo1955
CrossRef Full Text | Google Scholar
Knief, C. (2015). Diversity and habitat preferences of cultivated and uncultivated aerobic methanotrophic bacteria evaluated based on pmoA as molecular marker. Front. Microbiol. 6:1346. doi: 10.3389/fmicb.2015.01346
PubMed Abstract | CrossRef Full Text | Google Scholar
Kotsyurbenko, O., Friedrich, M., Simankova, M., Nozhevnikova, A., Golyshin, P., Timmis, K., et al. (2007). Shift from acetoclastic to H2-dependent methanogenesis in a West Siberian peat bog at low pH values and isolation of an acidophilic Methanobacterium strain. Appl. Environ. Microbiol. 73, 2344-2348. doi: 10.1128/AEM.02413-06
PubMed Abstract | CrossRef Full Text | Google Scholar
Langenheder, S., and Székely, A. J. (2011). Species sorting and neutral processes are both important during the initial assembly of bacterial communities. ISME J. 5, 1086-1094. doi: 10.1038/ismej.2010.207
PubMed Abstract | CrossRef Full Text | Google Scholar
Liebner, S., Ganzert, L., Kiss, A., Yang, S., Wagner, D., and Svenning, M. M. (2015). Shifts in methanogenic community composition and methane fluxes along the degradation of discontinuous permafrost. Front. Microbiol. 6:356. doi: 10.3389/fmicb.2015.00356
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y. Q., Priscu, J. C., Xiong, J. B., Conrad, R., Vick-Majors, T., Chu, H. Y., et al. (2016). Salinity drives archaeal distribution patterns in high altitude lake sediments on the Tibetan Plateau. FEMS Microbiol. Ecol. 92:fiw033. doi: 10.1093/femsec/fiw033
PubMed Abstract | CrossRef Full Text | Google Scholar
Logares, R., Lindstrom, E. S., Langenheder, S., Logue, J. B., Paterson, H., Laybourn-Parry, J., et al. (2013). Biogeography of bacterial communities exposed to progressive long-term environmental change. ISME J. 7, 937-948. doi: 10.1038/ismej.2012.168
PubMed Abstract | CrossRef Full Text | Google Scholar
Loreau, M., Naeem, S., Inchausti, P., Bengtsson, J., Grime, J. P., Hector, A., et al. (2001). Biodiversiteit en het functioneren van ecosystemen: huidige kennis en toekomstige uitdagingen. Science 294, 804-808. doi: 10.1126/science.1064088
PubMed Abstract | CrossRef Full Text | Google Scholar
Lozupone, C. A., and Knight, R. (2007). Mondiale patronen in bacteriële diversiteit. Proc. Natl. Acad. Sci. U.S.A. 104, 11436-11440. doi: 10.1073/pnas.0611525104
PubMed Abstract | CrossRef Full Text | Google Scholar
Luton, P. E., Wayne, J. M., Sharp, R. J., and Riley, P. W. (2002). The mcrA gene as an alternative to 16S rRNA in the phylogenetic analysis of methanogen populations in landfill. Microbiology 148, 3521-3530. doi: 10.1099/00221287-148-11-3521
PubMed Abstract | CrossRef Full Text | Google Scholar
Lutz, S., Anesio, A. M., Raiswell, R., Edwards, A., Newton, R. J., Gill, F., et al. (2016). De biogeografie van rode sneeuw microbiomen en hun rol in smeltende arctische gletsjers. Nat. Commun. 7:11968. doi: 10.1038/ncomms11968
PubMed Abstract | CrossRef Full Text | Google Scholar
Martiny, J. B. H., Bohannan, B. J. M., Brown, J. H., Colwell, R. K., Fuhrman, J. A., Green, J. L., et al. (2006). Microbiële biogeografie: micro-organismen op de kaart zetten. Nat. Rev. Microbiol. 4, 102-112. doi: 10.1038/Nrmicro1341
PubMed Abstract | CrossRef Full Text | Google Scholar
Martiny, J. B. H., Eisen, J. A., Penn, K., Allison, S. D., and Horner-Devine, M. C. (2011). Aanjagers van bacteriële bèta-diversiteit afhankelijk van ruimtelijke schaal. Proc. Natl. Acad. Sci. U.S.A. 108, 7850-7854. doi: 10.1073/pnas.1016308108
PubMed Abstract | CrossRef Full Text | Google Scholar
McArdle, B. H., and Anderson, M. J. (2001). Fitting multivariate models to community data: a comment on distance-based redundancy analysis. Ecology 82, 290-297. doi: 10.1890/0012-9658(2001)0822.0.CO;2
CrossRef Full Text | Google Scholar
McCalley, C. K., Woodcroft, B. J., Hodgkins, S. B., Wehr, R. A., Kim, E.-H., Mondav, R., et al. (2014). Methaan dynamiek gereguleerd door microbiële gemeenschap reactie op permafrost dooi. Nature 514, 478-481. doi: 10.1038/nature13798
PubMed Abstract | CrossRef Full Text | Google Scholar
McGenity, T. J. (2010). “Methanogens and Methanogenesis in Hypersaline Environments,” in Handbook of Hydrocarbon and Lipid Microbiology, ed. K. N. Timmis (Berlin: Springer), 665-680. doi: 10.1007/978-3-540-77587-4_53
CrossRef Full Text | Google Scholar
McLusky, D. S., and Elliott, M. (2004). Het estuariene ecosysteem: Ecology, Threats and Management. New York, NY: Oxford University Press. doi: 10.1093/acprof:oso/9780198525080.001.0001
CrossRef Full Text | Google Scholar
Megonigal, J. P., Mines, M. E., and Visscher, P. T. (2005). “Anaëroob metabolisme: verbanden met sporengassen en aërobe processen,” in Biogeochemistry, ed. W. H. Schlesinger (Oxford: Elsevier), 350-362.
Google Scholar
Milferstedt, K., Youngblut, N. D., and Whitaker, R. J. (2010). Spatial structure and persistence of methanogen populations in humic bog lakes. ISME J. 4, 764-776. doi: 10.1038/Ismej.2010.7
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosier, A. C., and Francis, C. A. (2008). Relative abundance and diversity of ammonia-oxidizing archaea and bacteria in the San Francisco Bay estuary. Environ. Microbiol. 10, 3002-3016. doi: 10.1111/j.1462-2920.2008.01764.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Nazaries, L., Murrell, J. C., Millard, P., Baggs, L., and Singh, B. K. (2013). Methaan, microben en modellen: fundamenteel begrip van de bodemmethaancyclus voor toekomstvoorspellingen. Environ. Microbiol. 15, 2395-2417. doi: 10.1111/1462-2920.12149
PubMed Abstract | CrossRef Full Text | Google Scholar
Nelson, M. B., Martiny, A. C., and Martiny, J. B. H. (2016). Global biogeography of microbial nitrogen-cycling traits in soil. Proc. Natl. Acad. Sci. U.S.A. 113, 8033-8040. doi: 10.1073/pnas.1601070113
PubMed Abstract | CrossRef Full Text | Google Scholar
Nemergut, D. R., Costello, E. K., Hamady, M., Lozupone, C., Jiang, L., Schmidt, S. K., et al. (2011). Mondiale patronen in de biogeografie van bacteriële taxa. Environ. Microbiol. 13, 135-144. doi: 10.1111/j.1462-2920.2010.02315.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Nobu, M. K., Narihiro, T., Kuroda, K., Mei, R., and Liu, W. T. (2016). Chasing the elusive Euryarchaeota class WSA2: genomes reveal a uniquely fastidious methyl-reducing methanogen. ISME J. 10, 2478-2487. doi: 10.1038/ismej.2016.33
PubMed Abstract | CrossRef Full Text | Google Scholar
Oksanen, J., Blanchet, F. G., Kindt, R., Legendre, P., Minchin, P. R., O’Hara, R. B., et al. (2015). vegan: Community Ecology Package. R Pakket Versie 2.2.0. Beschikbaar op: https://CRAN.R-project.org/package=vegan
Google Scholar
Oloo, F., Valverde, A., Quiroga, M. V., Vikram, S., Cowan, D., and Mataloni, G. (2016). Habitat heterogeniteit en connectiviteit vormen microbiële gemeenschappen in Zuid-Amerikaanse veengebieden. Sci. Rep. 6:25712. doi: 10.1038/srep25712
PubMed Abstract | CrossRef Full Text | Google Scholar
Pattnaik, P., Mishra, S. R., Bharati, K., Mohanty, S. R., Sethunathan, N., and Adhya, T. K. (2000). Invloed van saliniteit op methanogenese en geassocieerde microflora in tropische rijstbodems. Microbiol. Res. 155, 215-220. doi: 10.1016/S0944-5013(00)80035-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Poffenbarger, H. J., Needelman, B. A., and Megonigal, J. P. (2011). Salinity influence on methane emissions from tidal marshes. Wetlands 31, 831-842. doi: 10.1007/s13157-011-0197-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Potter, E. G., Bebout, B. M., and Kelley, C. A. (2009). Isotopische samenstelling van methaan en afgeleide methanogene substraten langs een zoutgradiënt in een hypersalisch microbieel mat-systeem. Astrobiology 9, 383-390. doi: 10.1089/ast.2008.0260
PubMed Abstract | CrossRef Full Text | Google Scholar
R Core Team (2014). R: A Language and Environment for Statistical Computing (Versie 3.0.3). Wenen: R Foundation for Statistical Computing.
Google Scholar
Roberts, D. (2016). labdsv: Ordinatie en Multivariate Analyse voor Ecologie. R Package Version 1.8-0. Beschikbaar op: https://CRAN.R-project.org/package=labdsv
Google Scholar
Rooney-Varga, J. N., Giewat, M. W., Duddleston, K. N., Chanton, J. P., and Hines, M. E. (2007). Verbanden tussen archeologische gemeenschapsstructuur, vegetatietype en methanogene pathway in veengebieden in Alaska. FEMS Microbiol. Ecol. 60, 240-251. doi: 10.1111/j.1574-6941.2007.00278.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Rosenberg, E., DeLong, E. F., Lory, S., Stackebrandt, E., and Thompson, F. (2014). De Prokaryoten: Other Major Lineages of Bacteria and the Archaea. Berlin: Springer.
Google Scholar
Ruff, S. E., Biddle, J. F., Teske, A. P., Knittel, K., Boetius, A., and Ramette, A. (2015). Global dispersion and local diversification of the methane seep microbiome. Proc. Natl. Acad. Sci. U.S.A. 112, 4015-4020. doi: 10.1073/pnas.1421865112
PubMed Abstract | CrossRef Full Text | Google Scholar
Schauer, R., Bienhold, C., Ramette, A., and Harder, J. (2009). Bacterial diversity and biogeography in deep-sea surface sediments of the South Atlantic Ocean. ISME J. 4, 159-170. doi: 10.1038/ismej.2009.106
PubMed Abstract | CrossRef Full Text | Google Scholar
Schloss, P. D., Westcott, S. L., Ryabin, T., Hall, J. R., Hartmann, M., Hollister, E. B., et al. (2009). Introducing mothur: open-source, platform-onafhankelijke, community-ondersteunde software voor het beschrijven en vergelijken van microbiële gemeenschappen. Toepassing van milieu. Microbiol. 75, 7537-7541. doi: 10.1128/Aem.01541-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Statham, P. J. (2012). Nutriënten in estuaria – een overzicht en de mogelijke gevolgen van klimaatverandering. Sci. Total Environ. 434, 213-227. doi: 10.1016/j.scitotenv.2011.09.088
PubMed Abstract | CrossRef Full Text | Google Scholar
Thauer, R. K., Kaster, A.-K., Seedorf, H., Buckel, W., and Hedderich, R. (2008). Methanogene archaea: ecologisch relevante verschillen in energiebehoud. Nat. Rev. Microbiol. 6, 579-591. doi: 10.1038/Nrmicro1931
PubMed Abstract | PubRef Full Text | Google Scholar
Tilman, D., Isbell, F., and Cowles, J. M. (2014). Biodiversiteit en het functioneren van ecosystemen. Annu. Rev. Ecol. Evol. Syst. 45, 471-493. doi: 10.1146/annurev-ecolsys-120213-091917
CrossRef Full Text | Google Scholar
Ulrich, W., Hajdamowicz, I., Zalewski, M., Stañska, M., Ciurzycki, W., and Tykarski, P. (2010). Soortenassortiment of habitatfiltering: een casestudy van spinnengemeenschappen op mereneilanden. Ecol. Res. 25, 375-381. doi: 10.1007/s11284-009-0661-y
CrossRef Full Text | Google Scholar
Vanwonterghem, I., Evans, P. N., Parks, D. H., Jensen, P. D., Woodcroft, B. J., Hugenholtz, P., et al. (2016). Methylotrofe methanogenese ontdekt in het archaeale fylum Verstraetearchaeota. Nat. Microbiol. 1:16170. doi: 10.1038/nmicrobiol.2016.170
PubMed Abstract | CrossRef Full Text | Google Scholar
von Mering, C., Hugenholtz, P., Raes, J., Tringe, S. G., Doerks, T., Jensen, L. J., et al. (2007). Kwantitatieve fylogenetische beoordeling van microbiële gemeenschappen in diverse omgevingen. Science 315, 1126-1130. doi: 10.1126/science.1133420
PubMed Abstract | CrossRef Full Text | Google Scholar
Wagner, D., and Liebner, S. (2009). “Global warming and carbon dynamics in permafrost soils: methane production and oxidation,” in Permafrost Soils, ed. R. Margesin (Berlin: Springer), 219-236.
Google Scholar
Weiher, E., and Keddy, P. (2001). Ecologische assemblageregels: Perspectives, Advances, Retreats. Cambridge: Cambridge University Press.
Google Scholar
Whitaker, R.J., Grogan, D.W., and Taylor, J.W. (2003). Geografische barrières isoleren endemische populaties van hyperthermofiele archaea. Science 301, 976-978. doi: 10.1126/science.1086909
PubMed Abstract | CrossRef Full Text | Google Scholar
Wickham, H. (2009). ggplot2: Elegant Graphics for Data Analysis. New York, NY: Springer-Verlag. doi: 10.1007/978-0-387-98141-3
CrossRef Full Text | Google Scholar
Yang, J., Ma, L. A., Jiang, H., Wu, G., and Dong, H. (2016). Salinity shapes microbial diversity and community structure in surface sediments of the Qinghai-Tibetan Lakes. Sci. Rep. 6:25078. doi: 10.1038/srep25078
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, S., Liebner, S., Alawi, M., Ebenhöh, O., and Wagner, D. (2014). Taxonomic database and cut-off value for processing mcrA gene 454 pyrosequencing data by MOTHUR. J. Microbiol. Methods 103, 3-5. doi: 10.1016/j.mimet.2014.05.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, S., Liebner, S., Winkel, M., Alawi, M., Horn, F., Dörfer, C., et al. (2017). In-depth analysis of core methanogenic communities from high elevation permafrost-affected wetlands. Soil Biol. Biochem. 111, 66-77. doi: 10.1016/j.soilbio.2017.03.007
CrossRef Full Text | Google Scholar
Ye, R. Z., Jin, Q. S., Bohannan, B., Keller, J. K., McAllister, S. A., and Bridgham, S. D. (2012). pH bepaalt de anaerobe koolstofmineralisatie, de efficiëntie van methaanproductie en methanogene routes in veengebieden over een ombrotrofe-minerotrofe gradiënt. Soil Biol. Biochem. 54, 36-47. doi: 10.1016/j.soilbio.2012.05.015
CrossRef Full Text | Google Scholar
Zinder, S. H. (1993). “Physiological ecology of methanogens,” in Methanogenesis: Ecology, Physiology, Biochemistry & Genetics, ed. J. G. Ferry (Boston, MA: Springer), 128-206.
Google Scholar
Zinger, L., Amaral-Zettler, L. A., Fuhrman, J. A., Horner-Devine, M. C., Huse, S. M., Welch, D. B. M., et al. (2011). Global patterns of bacterial beta-diversity in seafloor and seawater ecosystems. PLoS ONE 6:e24570. doi: 10.1371/journal.pone.0024570
PubMed Abstract | CrossRef Full Text | Google Scholar