T-regulatoire cellen (Tregs), vroeger bekend als T-onderdrukkers, zijn een T-celsubset met directe rollen in zowel auto-immuniteit als reacties op ziekteverwekkers.
Tregs verminderen ontstekingen via de secretie van immunosuppressieve cytokines (IL-10, TGF-b) en ook door directe onderdrukking van inflammatoire effector T-cellen (zoals Th1- en Th17-cellen).
Tregs controleren en voorkomen waarschijnlijk auto-immuunziekten door bij te dragen aan het behoud van tolerantie voor zelf-antigenen. Het therapeutische voordeel van Treg transfer is goed vastgesteld in diermodellen en pogingen om menselijke Treg therapieën te beginnen zijn aan de gang voor transplantatie en Type 1 diabetes patiënten.
Gezien het belang van deze unieke T-cel subset in zo veel immuunreacties, voelen veel onderzoekers zich nalatig als ze hun celpopulaties van belang immunofenotyperen zonder een Treg meting in de mix op te nemen. Maar het kwantificeren van Tregs kan gecompliceerd zijn.
Wat zijn bijvoorbeeld de beste markers om te gebruiken? Hoe weet je zeker dat je echte suppressor T-cellen meet?
Gating Strategies For Defining Tregs By Flow Cytometry
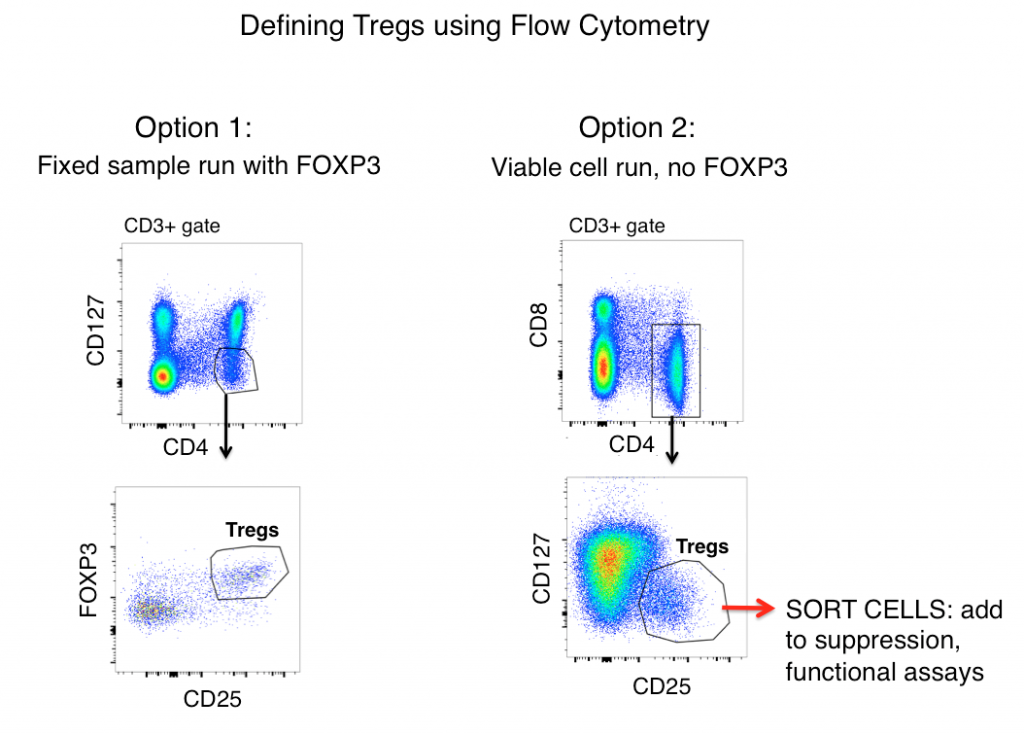
De standaard Treg gating strategie voor zowel muis als mens monsters (na eerst gating out doubletten en gating op levende cellen) omvat de antigenen CD3, CD4, CD25, FOXP3, en CD127.
Wanneer alleen naar antigeenexpressie wordt gekeken, worden Tregs vaak gedefinieerd als CD3+, CD4+, CD25hi, FOXP3+, en CD127lo (in de figuur hieronder weergegeven als optie 1). Met deze markers is vaak een duidelijke populatie zichtbaar van monsters zoals splenocyten van muizen en menselijke PBMC.
Geactiveerde T-cellen hebben echter vaak een up-regulatie van CD25, en FOXP3-expressie is aangetroffen op “effector” (niet-onderdrukkende) T-cellijnen. Daarom, wanneer men alleen vertrouwt op flowcytometrische fenotypering om Tregs te definiëren, kunnen ontstekingsbevorderende T-cellen een wolf in schaapskleren (Tregs) zijn en leiden tot onjuiste gegevensinterpretatie.
Een cel mag er dan uitzien als een eend, maar kwaakt hij ook? Meting van de effector functies van uw mogelijke Treg populatie zal veel helpen ophelderen van de nauwkeurigheid van uw flow gating strategie. Om te bepalen of de cellen die u definieert als Tregs functioneel op hen lijken, omvat optie 2 (zie hieronder) het weglaten van FOXP3 uit uw panel, het sorteren van CD3+, CD4+, CD25hi, CD127lo cellen, en vervolgens het bepalen van de functies van uw “Treg” populatie via cytokine analyse en/of suppressie co-cultuur assays met niet-Treg T-cellen (CD3+ CD4+ CD25-, CD127hi). Typisch kan FOXP3 niet worden opgenomen in panels waar levensvatbare cellen post-sort nodig zijn omdat intracellulaire kleuring vereist is.
Defining The Increasing Variety Of Treg Subsets
Er zijn vele smaken Tregs, waaronder tTregs, pTregs, en iTregs.
Tregs (ook bekend als nTregs) worden bijvoorbeeld gegenereerd in de thymus en hebben een TcR-repertoire dat bevooroordeeld is ten opzichte van zelfpeptiden. Een andere smaak, bekend als pTregs, worden gegenereerd in de periferie, en iTregs worden in cultuur geïnduceerd via TGF-b.
Er zijn makers geassocieerd met deze verschillende Treg-subsets en ze moeten worden overwogen voor opname in een Treg-antilichaam-panel als subsetting van hen van belang is. Bijvoorbeeld, bij de mens, wordt CD39 beschouwd als een betrouwbare tTreg marker. Ook is Helios in zowel muizen als mensen in staat gebleken om tTregs betrouwbaar te onderscheiden van de p- en iTreg-subsets.
Het definiëren van een enkele cel als een Treg – is dat mogelijk?
Een belangrijke beperking in het Treg-veld is het ontbreken van een enkele celonderdrukkingsassay.
Het definiëren van een individuele T-cel als lid van een afzonderlijke geheugenlijn, zoals Th1, Th2 of Th17, kan worden bereikt via analytanalyse met een enkele celresolutie, zoals intracellulaire cytokinekleuring, aangezien deze cellen voornamelijk, zo niet uitsluitend, worden gedefinieerd door welke cytokinen zij produceren.
Om echter aan te tonen dat een enkele cel een Treg is, willen we idealiter kunnen kwantificeren dat deze ene gekozen cel de functie van effector T-cellen (of andere celsubsets) in co-cultuur kan onderdrukken. Momenteel is de enige manier om Treg-onderdrukkende functie te testen een bulkkweek, waar men kan concluderen dat sommige (maar niet alle, mogelijk zelfs niet de meeste) cellen die als Treg worden aangeduid, onderdrukkend zijn.
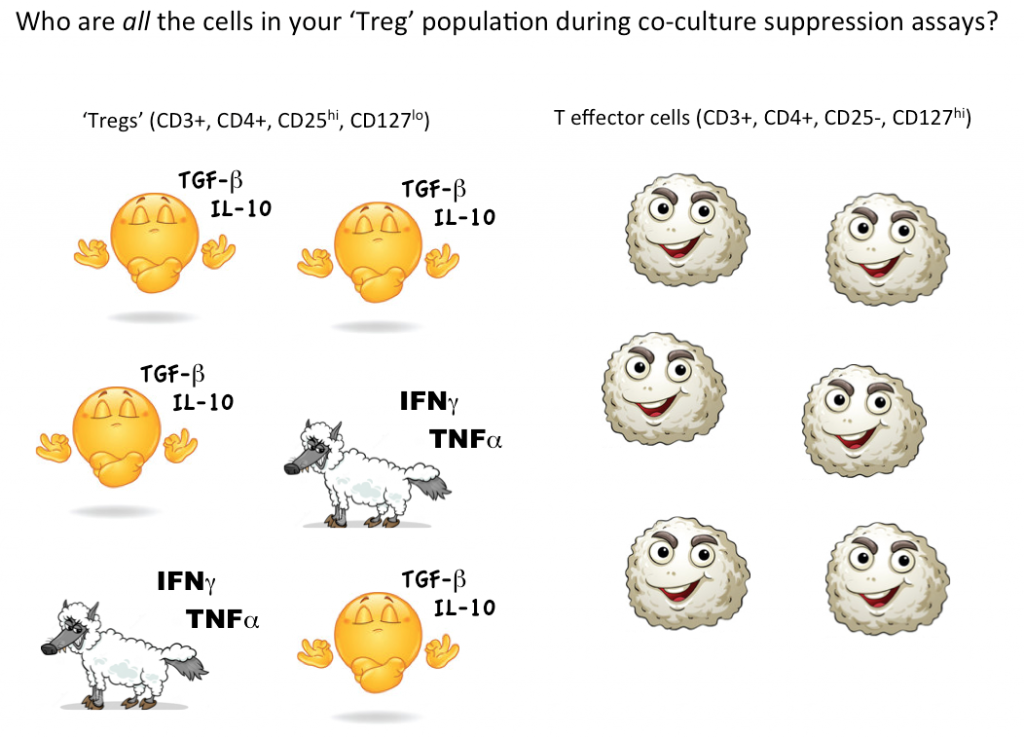
Weer denkend aan de potentiële ‘effector T-cel’-wolven in schaapskleren, weten we gewoon niet hoeveel niet-onderdrukkende, zelfs ontstekingsbevorderende cellen er in onze Treg-roosterstrategie schuilgaan. Het gebruik van flowcytometrie om eerst de gate op te zetten en levensvatbare cellen te sorteren met markers die consistent zijn met Tregs, en vervolgens functioneel te testen om te zien of, als een groep, de cellen die zijn gedefinieerd door uw gating-strategie zich daadwerkelijk gedragen als Tregs, is momenteel de beste manier om Tregs in uw monster te kwantificeren.
Door het uitvoeren van de juiste gating-strategieën voor het definiëren van Tregs door flowcytometrie en rekening houdend met het groeiende aantal Treg-subets, kunt u uw Treg-populaties van belang tevoorschijn halen. De sleutel is om deze populaties functioneel te testen nadat ze zijn geïdentificeerd, omdat het momenteel moeilijk, zo niet onmogelijk is om een enkele cel als een Treg te definiëren. Er wordt echter dagelijks vooruitgang geboekt en uiteindelijk zal het correct labelen van afzonderlijke Treg-cellen mogelijk zijn.
Om meer te leren over het analyseren van T-cellen en andere celtypen met behulp van flowcytometrie, en om toegang te krijgen tot al onze geavanceerde materialen, waaronder 20 trainingsvideo’s, presentaties, werkboeken, en privé groepslidmaatschap, kom op de Flow Cytometry Mastery Class wachtlijst.
