In dit hoofdstuk wordt zoveel behandeld dat de student enig inzicht krijgt in de analysemethoden die bij het technisch onderzoek van ijzer en staal worden gebruikt. De aard van dit werk verhindert een gedetailleerde behandeling van het onderwerp – een behandeling die een schatting van een of meer van de volgende stoffen kan vereisen:-Koolstof (vrij en gecombineerd), zwavel, silicium, fosfor, mangaan, titaan, koper, nikkel, kobalt, chroom, aluminium, arseen, antimoon, tin, wolfraam, vanadium, stikstof, ijzer. In het algemeen zijn de schattingen die het meest nodig zijn, die van koolstof, zwavel, silicium en fosfor. Van de andere genoemde elementen en verbindingen zijn bepalingen van één of meer vereist in het geval van speciaal staal. Voor informatie over deze bepalingen wordt de student verwezen naar Chemical Analysis and Foundry Chemistry, door Crobaugh ; The. Chemical Analysis of Iron, door Blair ; “Carbon in Steel by Direct Combustion,” door Blount, in The Analyst, Jan. 1902; “Sulphur in Wrought Iron and Steel,” door Auchy, in de Jour. Amer. Chem. Soc., maart 1901, en andere artikelen in dezelfde tijdschriften. De student die verder wil gaan, zou, indien mogelijk, toegang moeten krijgen tot de papers en artikelen van Campbell, Drown, en anderen, van tijd tot tijd gepubliceerd in de verschillende chemische en metallurgische tijdschriften.
Om de student een grondiger inzicht in het onderwerp te geven, zullen een paar aantekeningen over de samenstelling en eigenschappen van de beschouwde stoffen niet misstaan. Wat de invloed van de verschillende elementen op staal betreft, raadplege men The Manufacture and Properties of Structural Steel, door H. H. Campbell.
Koolstof bestaat in ijzer in drie toestanden: grafitisch, opgelost, en gecombineerd. Daarnaast zijn er nog andere vormen onder de microscoop geïdentificeerd.
Zwavel bestaat in ijzer voornamelijk als het sulfide FeS. dat oplosbaar is in gesmolten ijzer.
Fosfor bestaat als fosfide van ijzer, dat volledig oplosbaar is in het gesmolten ijzer.
Silicium vormt silicide van ijzer, dat ook oplosbaar is in gesmolten ijzer.
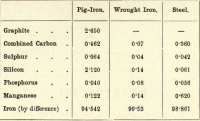
Van deze vier elementen is koolstof dus het enige dat in de vrije staat kan bestaan. De variaties in de verhoudingen van de verschillende aanwezige elementen zijn bijna oneindig, maar de volgende korte tabel geeft bij benadering de samenstelling van ruwijzer, smeedijzer en staal, hoewel elk van deze onderhevig is aan aanzienlijke variatie.
De student moet een schatting maken van het volgende:-
(1) Koolstof,
(a) Totaal.
(b) Grafiet.
(c) Gecombineerd.
(2) Zwavel.
(3) Silicium. (Indien de tijd het toelaat.)
(4) Fosfor. (Als de tijd het toelaat.)
Koolstof Totaal
In deze schatting wordt de koolstof omgezet in CO2, dat wordt geabsorbeerd in bijtende potas. Uit het aldus verkregen gewicht aan CO2 wordt de koolstof berekend.
Op het eerste gezicht lijkt het de eenvoudigste procedure de ijzer- of staalboringen direct in een stroom zuurstof te ontsteken en het aldus gevormde CO2 in KHO op te nemen. Helaas is deze methode tot nu toe ofwel onnauwkeurig gebleken, of daar waar volledige verbranding werd verkregen, was de apparatuur die nodig was om de hoge temperatuur of andere variaties in de behandeling te weerstaan, niet geschikt voor het technische werk (zie de artikelen van Blount in The Analyst). De student zal vaststellen dat de hier gegeven methode uit technisch oogpunt geenszins ideaal is wat betreft gemak en snelheid, en het lijkt waarschijnlijk dat zij in de nabije toekomst zal worden vervangen door een snellere methode van directe oxidatie.
Gebruikte methode.-Onder verwijzing naar de vele werken over dit onderwerp, zal men een grote verscheidenheid van methoden aantreffen. De hier gegeven methode zal met de gebruikelijke zorgvuldigheid nauwkeurige resultaten geven. In het kort komt zij op het volgende neer:-
Het ijzer wordt opgelost in een oplossing van dubbel chloride van kalium en koper, zuur gemaakt met HCl. Metallisch koper wordt neergeslagen en opnieuw opgelost; het ijzer wordt opgelost, waarbij de koolstof in suspensie wordt gelaten. Vervolgens wordt het ijzer opgevangen en in de verbrandingsoven met zuurstof aangestoken, waarna het vrijkomende CO2 wordt gewogen.
Oplossing van het ijzer.-Weg 1 gram gietijzeren boren af. Breng dit over in een bekerglas van 300 c.c.. Voeg 100 cs. CuCl2,2KCl,2H2O oplossing, die als volgt wordt gemaakt. Los in water op 149,1 delen KCl en 170,3 delen gekristalliseerd CuCl2, 2H2O. Damp in en kristalliseer het dubbele chloride uit. Los 300 g van het dubbelzout op in gedestilleerd water. Filtreer door gloeiend asbest en bewaar het in een met glas afgesloten fles.
Voeg aan de inhoud van het bekerglas 7 c.cs. HCl toe om de oplossing zuur te maken. Roer met tussenpozen tot een oplossing van het ijzer is bereikt. Plaats het bekerglas met inhoud naar het einde van de oplossing op een waterbad bij een temperatuur van ongeveer 60° C. De volgende reacties vinden plaats-Fe + CuCl2 = FeCl2 + Cu en Cu + CuCl2 = 2CuCl. De KCl helpt slechts bij het oplossen van het neergeslagen koper. In ongeveer 40 minuten na de toevoeging van de dubbele chloriden moet de oplossing bijna volledig zijn en het meeste koper opgelost. Spoel de wanden van het bekerglas af met een beetje aangezuurde dubbelchloride. Voeg aan de oplossing een weinig aangestoken asbest toe om het koolstofhoudend materiaal te doen bezinken en te voorkomen dat het filter verstopt raakt (zoals aanbevolen door Barba).
Voor het filtreren zijn speciale platinaschuitjes, gemonteerd volgens het principe van de Goochkroes, zeer geschikt. De student kan echter de koolstofhoudende stoffen filtreren met behulp van een Goochkroes, geholpen door kunstmatige afzuiging, waarbij de koolstofhoudende stoffen met een waterstraal worden weggespoeld nadat de vloeistof door het filter is gegaan. Was de koolstof op het filter voorzichtig met heet water. Droog de filterkroes met
inhoud in de luchtoven bij 100 C. De koolstofhoudende massa is nu klaar voor ontbranding.
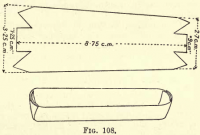
Oxidatie van de koolstof.-Prepareer een platinaschaal door een stuk platinafolie te knippen als in fig. 108 en de zijkanten en uiteinden omhoog te vouwen om een trog te vormen. Breng het koolstofhoudend materiaal en de asbest van de Gooch over in de boot.
De verbrandingsoven, toebehoren en hulpstukken moeten in orde worden gebracht. Het zuurstofzuiveringsapparaat wordt opnieuw gebruikt, doch ditmaal voorzien van een driewegbuis, met kranen tussen de opslag en de zuiveraars. Hierdoor kan een luchtstroom door het apparaat worden getrokken. De verbrandingsbuis kan van hard glas Jena, porselein of platina zijn. Tussen de oven en de potasbollen worden twee U-buizen gebruikt. Het gedeelte van de eerste buis dat zich het dichtst bij de oven bevindt, bevat watervrij CuSO4 en het andere gedeelte watervrij CuCl. De tweede U-buis bevat gedroogd CaCl2. Deze twee buizen vormen de “zuiverende trein”. Het CuCl absorbeert alle Cl, en de andere stoffen alle H2O. Deze set zal voor vele bepalingen dienen. De potasbollen en de beschermbuizen volgen, en een aspirator zou bij de hand moeten zijn om een luchtstroom door het apparaat te leiden wanneer dat nodig is. De potasbollen zijn gevuld met 8E. KHO, en de beschermbuis met CaCl2. Test de oven en de bollen zoals eerder beschreven (zie Steenkool en cokes), waarbij de buis wordt geladen zoals in de schets, en de boot voorlopig in de luchtoven wordt gehouden bij 100° C.
Wanneer alles klaar is, de branders enige tijd hebben gedoofd, wordt de boot met inhoud erin geplaatst. De branders worden aan de voorkant aangestoken, geleidelijk naar achteren gewerkt, en een langzame stroom zuurstof van ongeveer twee belletjes per seconde wordt aangezet totdat de buis vol zuurstof is. Regel de temperatuur tot de boot dof rood is, en als de oplossing in de bollen tekenen vertoont van teruglopen naar de oven, verhoog dan de stroom zuurstof tot drie of vier belletjes per seconde.
Vanaf het moment van inbrengen van de boot is ongeveer vijftig minuten voldoende voor een volledige verbranding. Schakel de zuurstof uit en laat gedurende tien minuten een luchtstroom lopen.
De potasbollen en de beschermbuis worden nu verwijderd en gewogen, en de koolstof wordt op de gebruikelijke wijze berekend.
(b) Grafietkool -Het ijzer wordt door sommigen opgelost in HCl, door anderen in HNO3, waarbij de grafietkool als residu achterblijft. Voor ruwijzer geeft elk van beide methoden, mits voorzichtig uitgevoerd, goede resultaten, maar voor staal dat grafiet bevat, beveelt Blair oplossing in salpeterzuur aan. (Raadpleeg voor deze methode Blair.)
Weeg 5 gram gietijzeren boren af. Los op in 50 c.cs. SE. HCl met behulp van zacht vuur. Kook een paar minuten. Verdun tot 100 c.cs. (bijna). Filtreer door een Goochkroes. Was goed met heet water en vervolgens met kokend E.KHO. (Dit lost eventuele SiO2 op.) Was nogmaals met heet water om de KHO te verwijderen. Droog de filterkroes en de inhoud.
Bepaal de koolstof zoals eerder door verbranding, en bereken het percentage zoals gewoonlijk.
(c) Gecombineerde koolstof (door verschil).-De totale koolstof en de grafietkoolstof zijn bekend, de gecombineerde koolstof wordt verkregen door de grafietkoolstof af te trekken van de totale koolstof.
Voor directe schattingsmethoden raadplege men de genoemde autoriteiten.
ESTIMATIE VAN SULF IN IJZER & STAAL
Er bestaan aanzienlijke meningsverschillen over de beste methode om zwavel in ijzer en staal te schatten. De oude methode met aqua regia oplossing en BaCl2 neerslag is zeer onnauwkeurig; maar langzame oplossing in HNO3, met zeer weinig of geen HCl aanwezig, gevolgd door zorgvuldige neerslag met BaCl2 in aanwezigheid van een zekere overmaat HCl en met de nodige zorg wat betreft tijd en omstandigheden van neerslag, en voorzorgsmaatregelen tegen besmetting van het neerslag door ijzer – met deze en zorgvuldigheid zijn goede resultaten te verkrijgen. Blair daarentegen beveelt oplossing in HCl aan, waarbij het S wordt geëvolueerd als H2S, dat wordt geabsorbeerd in een (alkalische) oplossing van Pb(NO3)2 waarbij PbS wordt gevormd, dat wordt opgelost in HCl + KClO3, en het S wordt neergeslagen als BaSO4. Voor verdere methoden zie Blair, Stillman, Auchy, Crobaugh, en Drown. Een andere veelgebruikte methode is die van de evolutie van het S als H2S, gevolgd door absorptie in een cadmiumchloride-oplossing. Het neergeslagen cadmiumsulfide wordt opgelost in HCl en de S wordt geschat door titratie met een jodiumoplossing, of nog gebruikelijker, de H2S wordt geabsorbeerd in water met pek en dan neergeslagen als BaSO4 of wordt geabsorbeerd in NaOH en getitreerd met jodium; dit laatste is de favoriete methode. (Zie Blair.) De volgende methode wordt hier gegeven:-
Oxidatie door HNO3 (de z.g. Aqua Regia methode).-Weeg 5 gram boringen af en breng ze over in een diep bekerglas van 200 c.c.. Voeg voorzichtig ongeveer 40 c.cs. 16E. HNO3 toe, in hoeveelheden van ongeveer 10 cs. tegelijk, waarbij het bekerglas wordt afgedekt met een groot horlogeglas en ervoor wordt gezorgd dat de werking niet te hevig is. Wanneer de werking kennelijk ophoudt, moet worden nagegaan of alle deeltjes zijn opgelost (behalve de koolstof). Zo niet, verwarm dan op het zandbad en voeg 3 of 4 druppels 16E. HCl toe en verwarm tot de deeltjes zijn opgelost.
Wanneer de oplossing compleet is, voeg dan een beetje Na2CO3 toe om H2SO4 om te zetten in Na2SO4, dat niet vluchtig is bij verdamping.
Haal het zandbad weg en voeg 5 c.c. sterk HCl toe, meer dan nodig is om de ijzerverbindingen op te lossen die door Na2CO3 zijn neergeslagen. Filtreer het SiO2 en C. Was goed. Damp in tot droog om het SiO2 onoplosbaar te maken. Neem op met HCl en damp in tot Fe2Cl6 begint te kristalliseren. Voeg dan 5 c.cs. HCl toe en filtreer als er een residu aanwezig is. (Als er geen residu aanwezig is, was er geen SiO2 in oplossing en kon het indampen achterwege worden gelaten). Filtreer en was het neerslag zorgvuldig in de Gooch, waarbij de vloeistof en het waswater tot ongeveer 100 c.cs. worden gebracht.
Verwarm tot koken. Voeg 10 cs. verzadigde oplossing van BaCl2 toe. Kook gedurende 30 minuten. Laat een nacht staan. Filtreer door een gootsteen. Was met een beetje E. HCl. en daarna met water. Droog, ontsteek en weeg zoals gewoonlijk de BaSO4, die wit moet zijn, en niet verontreinigd met ijzerzouten.
Bereken het percentage S op de gebruikelijke manier. Daar sommige van de gebruikte reagentia zwavel kunnen bevatten, moet een blanco worden verricht, met gebruikmaking van dezelfde hoeveelheden als bij de eigenlijke analyse, en de gevonden zwavel moet van het vorige resultaat worden afgetrokken.
ESTIMATIE VAN SILICON
De hier gegeven methode is die van Drown, en is zowel snel als nauwkeurig. Het ijzer wordt opgelost in HNO3, gevolgd door H2SO4, met verdamping tot droogte. Dit wordt gevolgd door oplossing, waarbij het silicium in het residu achterblijft als SiO2.
Details.-Weeg 2 gram boorsels af en breng ze over in een platina of porseleinen schaal. Voeg 30 c.cs. 8E. HNO3. Wanneer de werking schijnbaar ophoudt, voeg 20 c.cs. 18E. H2SO4 toe en damp in. (Blair beveelt aan een zachte stoot hete lucht op het oppervlak van de vloeistof te laten spelen. De lucht wordt verwarmd door deze door een kleine koperen pijp te voeren die boven een bunsen verwarmd wordt. De verdamping wordt zo versneld en spiraalvorming voorkomen). Ga door met verdampen totdat er overvloedige dampen van SO3 vrijkomen. Koel af en verdun voorzichtig met gedestilleerd water tot 130 c.s. Verwarm tot al het FeSO4 is opgelost. Filtreer en was eerst met een beetje E. HCl en daarna met heet water. Deze filtratie kan het best worden uitgevoerd met een 7 cm. asloos filtreerpapier (controleer de as door twee of drie van de papiertjes aan te steken). Droog ze af, breng ze over in een platina filterkroes, ontsteek ze zoals gewoonlijk en weeg ze. Voeg aan de kroes 5 cs. sterk H2SO4 en 5 cs. sterk HF toe. Damp voorzichtig in tot droog, met een hete luchtstroom om de verdamping te versnellen. Ontsteek en weeg opnieuw. Als H2SO4 en HF zuiver zijn, komt het verschil in gewicht overeen met SiO2. Controleer H2SO4 en HF (vooral HF) door een blanco in te dampen. Een eventueel residu moet in rekening worden gebracht.
ESTIMATIE VAN FOSFORUS
Ook hier worden talrijke methoden gegeven door verschillende autoriteiten, waarvan de meeste nauwkeurige resultaten opleveren wanneer zij zorgvuldig worden gevolgd. De twee methoden die het meest geschikt zijn voor technische analyse zijn de volumetrische reductiemethode die is opgesteld door het subcomité (de heren Barba, Blair, Drown, Dudley en Shimer) van het International Steel Standards Committee, U.S.A., en de gewijzigde reductiemethode zoals gegeven door de heren Dudley en Pease, Jour. Anal. Appl. Chem., vii. 108. De eerste methode wordt volledig besproken in Blair’s Analysis of Iron; de tweede methode wordt hier gegeven.
Het ijzer wordt opgelost en de P wordt neergeslagen als fosfo-molybdaat van ammonium. Dit wordt opgelost, en door de werking van Zn en H2SO4 wordt het MoO3 gereduceerd, en de gereduceerde vloeistof wordt vervolgens getitreerd met K2Mn2O8 (standaardoplossing), en uit het aantal gebruikte c.cs. kan het P-gehalte worden berekend.
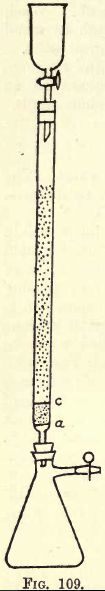
Details. -Wanneer veel werk moet worden verricht, is een schudapparaat noodzakelijk (zie Catalogi van chemische benodigdheden). De leerling kan het nodige schudden echter ook met de hand doen. Alvorens tot de analyse over te gaan, moet het reductieapparaat (een modificatie van de Jones reductor) worden voorbereid (zie fig. 109).
Aan a bevindt zich een fijn geperforeerd schijfje van stevig platinafolie. Tussen a en c ligt ongeveer ¾ duim schoon wit zand, c is een ander geperforeerd platinaschijfje.
Vboven dit schijfje wordt de buis gevuld met fijnkorrelig amalgaamzink, dat als volgt wordt bereid:-Oplos 5 gms. Hg op in 25 c.cs. sterke HNO3, verdunnen met water en de oplossing op 1 liter brengen. Giet in deze oplossing een halve kilo zinkkorrels die wel door een zeef van 20 maar niet door een van 30 gaan. Gedurende een of twee minuten schudden. Giet de oplossing af. Was en droog het zink, dat nu geamalgameerd is. De trechter en de kolf worden op de aangegeven wijze op het apparaat aangesloten.
Bereid de volgende reagentia:-
(a) De sterk oxiderende oplossing van K2Mn2O8. 12 gram zuiver K2Mn2O8 in 1 liter water. Filtreer en bottel.
(b) De molybdaatoplossing.- Los 50 gram. MoO3 op in 200 c.cs, NH4HO (S.G. .96). Filtreer en voeg aan het filtraat 500 cs. HNO3 (S.G. 1.2) TOE. Laat ten minste 24 uur staan alvorens te gebruiken.
(c) De zure ammoniumsulfaatoplossing.-Voeg aan 500 cs. gedestilleerd water 27,5 cs. NH4HO (S.G. 0.96), en vervolgens 24 c.c. zuivere H2SO4 (S.G. 1.84), en verdun tot 1000 c.s.
(d) De Standaard K2Mn2O8 Oplossing.-Los 2 gram gekristalliseerd K2Mn2O8 op in 1000 c.s. gedestilleerd water. Standaardiseer de oplossing als volgt: Weeg 3 partijen van elk 1 tot 3 gram gereinigd ijzerdraad af, waarvan het ijzergehalte bekend is. Breng over in een erlenmeyer van 100 cs. en voeg aan elke erlenmeyer 40 cs. toe. 8E. H2SO4 TOE. Kook na oplossen 5 minuten, vul aan tot 150 cs, spoel door de reductor en breng het volume op 200 cs, zoals aangegeven in de analyse. Titreer elke partij met K2Mn2O8. De resultaten moeten overeenkomen voor metallisch ijzer tot op 1/100 milligram. Houd rekening met de onzuiverheden in de gebruikte draad. Veronderstel 1 c.c. K2Mn2O8 = .0034923 gm, Fe, vermenigvuldig dan deze waarde in Fe met de verhouding van MoO3 tot Fe, namelijk .9076, en het product met de verhouding van de P
present aan de MoO3 namelijk, .019, wij hebben
1 c.c. K2Mn2O8 = .0000602 gm. P
Analyse
Weeg 1 gm. boren af. Breng over in een erlenmeyer van 200 c.c. Voeg 70 cs. 5E. HNO3. Kook, wanneer de oplossing volledig is, een minuut en voeg 10 cs. van de “oxiderende” oplossing van K2Mn2O8 toe. Laat roteren tot de roze kleur verdwijnt en MnO2 zich afscheidt. Verwijder de oplossing en voeg al roerend geleidelijk zuivere (fosforvrije) FeSO4-kristallen toe tot de inhoud helder is. Verwarm de oplossing tot 80° C (als er As aanwezig is, tot 35° C). Voeg 75 c.c. van de molybdaatoplossing toe bij een temperatuur van 27° C. Sluit de kolf af met een rubberstop en schud gedurende 5 minuten. Laat 5 minuten staan. Filtreer vervolgens door een 9 cm filter en was met de zure ammoniumsulfaatoplossing tot enkele druppels van het waswater geen kleur meer geven met ammoniumsulfide.
Verwijder het neerslag op het papier met 5 c.cs. NH4HO (S.G. 0.90) en 25 cs. water en laat de oplossing terugvloeien in de oorspronkelijke kolf, waardoor het aan de wanden klevende neerslag wordt opgelost. Was tot het filtraat en het waswater 150 cs. bedragen. Voeg 10 cs. sterk H2SO4 (S.G. 1.84) toe en verdun tot 200 cs. De oplossing is nu klaar voor reductie.
Giet 100 c.cs. warm ~E/2 H2SO4 in de trechter. Sluit de kolf aan op de filterpomp en open de klem, zodat de oplossing bijna, maar niet helemaal, uit de trechter stroomt. Voeg vervolgens in de trechter de volgende blanco-5 c.cs. toe NH4HO (S.G. 0.90), 10 c.cs. H2SO4 (S.G. 1.84), en 50 c.cs. water, door elkaar gemengd. Open opnieuw de klem, zodat dit mengsel bijna uit de trechter loopt. Voeg nu 200 cs, E/2 H2SO4 toe aan de trechter, en laat dit mengsel bijna doorlopen.
Koppel de kolf los, waarbij eerst de afsluitkraan olie de trechter sluit. Titreer de inhoud van de erlenmeyer met K2Mn2O8. In het algemeen wordt aldus ongeveer 0,1 c.c. permanganaat verbruikt, en deze hoeveelheid moet van latere aflezingen worden afgetrokken.
Nu brengt men de te reduceren oplossing over in de trechter. Bevestig een schone kolf. Sluit de filterpomp aan en start hem. Open de kraan en de klem, zodat de oplossing bijna doorloopt. Spoel de kolf die de oplossing bevatte uit met 100 c.cs. E/2 H2SO4. Voeg dit toe aan de trechter en behandel als tevoren.
Voeg tenslotte nog 100 cs. van het zuur toe en laat het bijna doorlopen.
De gereduceerde oplossing in de filterkolf moet nu helder groen zijn.
Verwijder als tevoren en titreer met de permanganaatoplossing. Het groen verandert in rozebruin, dan in rozegeel, dan in kleurloos en tenslotte wordt een permanent roze verkregen (na één minuut staan). Trek van de verkregen waarde de blancowaarde af en bereken uit de hierboven gegeven gegevens het percentage aanwezige P.
In plaats van deze volumetrische methode geven sommige chemici er de voorkeur aan het gele fosfo-molybdaat neerslag rechtstreeks te wegen. Voor bijzonderheden zie Blair’s Analysis of Iron, blz. 108.
Note.-De student moet, waar mogelijk, gebruik maken van verwijzingen naar speciale autoriteiten. Tegen die tijd moet hij in staat zijn dergelijke materialen te raadplegen, te vergelijken en, tot op zekere hoogte, oordeelkundig te gebruiken. Geen enkel leerboek kan een allesomvattende behandeling geven van “IJzer en Staal,” of, wat dat betreft, van een van de onderwerpen die in deze sectie worden behandeld; daarom moeten de referenties die worden gegeven, samen met de huidige literatuur, zorgvuldig worden doorgenomen door de analist die wil uitblinken in technisch werk. De colorimetrische bepaling van gecombineerde koolstof volgens de methode van Eggertz is gegeven; mangaan kan op enigszins vergelijkbare wijze worden bepaald volgens de colorimetrische methode van Peter, of volgens de acetaatmethode (zie Blair, enz.).