Generieke naam: naftifine hydrochloride
Doseringsvorm: crème
Medisch beoordeeld door Drugs.com. Laatst bijgewerkt op 1 jan 2021.
- Overzicht
- Bijwerkingen
- Dosering
- Professioneel
- Zwangerschap
- Meer
Indicaties en gebruik van Naftifine Crème
Naftifine hydrochloride crème is geïndiceerd voor de behandeling van interdigitale tinea pedis, tinea cruris, en tinea corporis veroorzaakt door het organisme Trichophyton rubrum.
Naftifine Crème Dosering en Toediening
Alleen voor uitwendig gebruik. Naftifine hydrochloride crème is niet voor oogheelkundig, oraal of intravaginaal gebruik. Breng eenmaal daags een dun laagje naftifinehydrochloridecrème aan op de aangedane plekken plus een marge van ½ inch van de gezonde omringende huid gedurende 2 weken.
Doseringsvormen en sterktes
Elke gram bevat 20 mg naftifinehydrochloride (2%) in een witte tot gebroken witte basis.
Contra-indicaties
Geen
Waarschuwingen en voorzorgsmaatregelen
Lokale bijwerkingen
Staak de behandeling indien irritatie of gevoeligheid ontstaat bij het gebruik van naftifine hydrochloride crème. Laat patiënten contact opnemen met hun arts als deze aandoeningen zich ontwikkelen na gebruik van naftifinehydrochloridecrème.
Bijwerkingen
Ervaringen met klinische proeven
Omdat klinische proeven onder sterk uiteenlopende omstandigheden worden uitgevoerd, kunnen de percentages bijwerkingen die zijn waargenomen in de klinische proeven met een geneesmiddel niet direct worden vergeleken met de percentages in de klinische proeven met een ander geneesmiddel en weerspiegelen deze mogelijk niet de percentages die in de klinische praktijk worden waargenomen.
Tijdens klinische proeven werden 903 proefpersonen blootgesteld aan naftifine 1% en 2% crème formuleringen. In totaal werden 564 proefpersonen met interdigitale tinea pedis, tinea cruris, of tinea corporis behandeld met naftifine hydrochloride crème.
In twee gerandomiseerde, voertuiggecontroleerde onderzoeken (400 proefpersonen werden behandeld met naftifine hydrochloride crème). De populatie was 12 tot 88 jaar oud, voornamelijk mannelijk (79%), 48% Kaukasisch, 36% Zwart of Afro-Amerikaans, 40% Hispanic of Latino en had ofwel overwegend interdigitale tinea pedis of tinea cruris. De meeste proefpersonen kregen eenmaal daags een topische dosis gedurende 2 weken om de aangetaste huidgebieden te bedekken plus een marge van ½ inch van de omringende gezonde huid. In de twee gecontroleerde onderzoeken met naftifine hydrochloride crème ondervond 17,5% van de met naftifine hydrochloride crème behandelde proefpersonen een bijwerking, vergeleken met 19,3% van de proefpersonen met naftifine hydrochloride crème. De meest voorkomende bijwerking (groter dan of gelijk aan 1%) is pruritus. De meeste bijwerkingen waren mild van ernst. De incidentie van bijwerkingen in de met naftifine hydrochloride crème behandelde populatie was niet significant anders dan in de met het medium behandelde populatie.
In een derde gerandomiseerde, medium-gecontroleerde studie, werden 116 pediatrische proefpersonen met tinea corporis behandeld met naftifine hydrochloride crème. De populatie was ouder dan of gelijk aan 2 tot jonger dan 18 jaar (gemiddelde leeftijd van 9 jaar), overwegend mannelijk (61%), 47% blank, 51% zwart of Afro-Amerikaans, 92% Hispanic of Latino, en geïnfecteerd met tinea corporis. Naftifine hydrochloride crème werd gedurende 2 weken eenmaal daags topisch aangebracht op alle aangetaste lichaamsoppervlakken met tinea corporis plus een ½ inch marge van gezonde huid rondom de aangetaste laesies. De incidentie van bijwerkingen in de met naftifine hydrochloride crème behandelde populatie was niet significant verschillend van die in de met medium behandelde populatie.
In twee open-label pediatrische farmacokinetiek- en veiligheidstests kregen 49 pediatrische proefpersonen van 2 tot jonger dan 18 jaar met interdigitale tinea pedis, tinea cruris, en tinea corporis naftifine hydrochloride crème. De incidentie van bijwerkingen bij de pediatrische populatie was vergelijkbaar met die waargenomen bij de volwassen populatie.
Postmarketingervaring
De volgende bijwerkingen zijn geïdentificeerd tijdens post-goedkeuringsgebruik van naftifine hydrochloride: roodheid/irritatie, ontsteking, maceratie, zwelling, branderigheid, blaren, sereuze drainage, korstvorming, hoofdpijn, duizeligheid, leukopenie, agranulocytose.
Omdat deze reacties vrijwillig worden gemeld uit een populatie van onzekere omvang, is het niet altijd mogelijk om hun frequentie betrouwbaar te schatten of een causaal verband met blootstelling aan het geneesmiddel vast te stellen.
Gebruik IN SPECIFIEKE POPULATIES
Zwangerschap
Risicosamenvatting
Er zijn geen gegevens beschikbaar met naftifinehydrochloride crème bij zwangere vrouwen om het geneesmiddelgeassocieerde risico op ernstige geboorteafwijkingen en miskraam te bepalen. In voortplantingsstudies bij dieren werden geen nadelige effecten op de embryofetale ontwikkeling gezien bij orale doses toegediend tijdens de periode van organogenese tot 18 maal de maximaal aanbevolen humane dosis (MRHD) bij zwangere ratten of subcutane doses toegediend tijdens de periode van organogenese tot 2 maal de MRHD bij zwangere ratten of 4 maal de MRHD bij zwangere konijnen .
Het geschatte achtergrondrisico van grote geboorteafwijkingen en miskramen voor de aangegeven populatie is onbekend. Alle zwangerschappen hebben een achtergrondrisico van geboorteafwijkingen, verlies, of andere ongunstige resultaten. In de algemene bevolking van de VS is het geschatte achtergrondrisico van ernstige geboorteafwijkingen en miskramen bij klinisch erkende zwangerschappen respectievelijk 2% tot 4% en 15% tot 20%.
Data
Animal Data
Systemische embryofetale ontwikkelingsstudies werden uitgevoerd bij ratten en konijnen. Voor de vergelijking van dier- met humane doses op basis van vergelijking van lichaamsoppervlak (mg/m2) is de MRHD vastgesteld op 8 g 2% crème per dag (2,67 mg/kg/dag voor een persoon van 60 kg).
Orale doses van 30, 100 en 300 mg/kg/dag naftifinehydrochloride werden gedurende de periode van de organogenese toegediend aan zwangere vrouwelijke ratten. Er werden geen behandelingsgerelateerde effecten op de embryofoetale ontwikkeling waargenomen bij doses tot 300 mg/kg/dag (18 maal MRHD). Subcutane doses van 10 en 30 mg/kg/dag naftifinehydrochloride werden gedurende de periode van de organogenese toegediend aan zwangere vrouwtjesratten. Bij 30 mg/kg/dag (2 maal MRHD) werden geen behandelingsgerelateerde effecten op de embryofoetale ontwikkeling geconstateerd. Subcutane doses van 3, 10 en 30 mg/kg/dag naftifinehydrochloride werden gedurende de periode van de organogenese toegediend aan zwangere vrouwelijke konijnen. Er werden geen behandelingsgerelateerde effecten op de embryofoetale ontwikkeling geconstateerd bij 30 mg/kg/dag (4 maal MRHD).
Een peri- en postnataal ontwikkelingsonderzoek werd uitgevoerd bij ratten. Orale doses van 30, 100 en 300 mg/kg/dag naftifinehydrochloride werden toegediend aan vrouwelijke ratten vanaf de zwangerschapsdag 14 tot de lactatiedag 21. Een verminderde gewichtstoename van de wijfjes tijdens de dracht en van de jongen tijdens de lactatie werd geconstateerd bij 300 mg/kg/dag (18 maal MRHD). Er werd geen ontwikkelingstoxiciteit waargenomen bij 100 mg/kg/dag (6 maal MRHD).
Lactatie
Risicosamenvatting
Er is geen informatie beschikbaar over de aanwezigheid van naftifinehydrochloridecrème in humane melk, de effecten van het geneesmiddel op de zuigeling die borstvoeding krijgt, of de effecten van het geneesmiddel op de melkproductie. Het gebrek aan klinische gegevens tijdens de lactatie sluit een duidelijke bepaling van het risico van naftifinehydrochloridecrème voor een zuigeling tijdens de lactatie uit; daarom moeten de ontwikkeling en de gezondheidsvoordelen van borstvoeding worden overwogen samen met de klinische behoefte van de moeder aan naftifinehydrochloridecrème en de mogelijke nadelige effecten op de zuigeling die borstvoeding krijgt van naftifinehydrochloridecrème of van de onderliggende aandoening van de moeder.
Pediatrisch gebruik
De veiligheid en werkzaamheid van naftifine hydrochloride crème zijn vastgesteld bij pediatrische patiënten van 12 jaar en ouder met interdigitale tinea pedis en tinea cruris en van 2 jaar en ouder met tinea corporis .
Gebruik van naftifine hydrochloride crème in deze leeftijdsgroepen wordt ondersteund door bewijs van adequate en goed gecontroleerde onderzoeken bij volwassenen en kinderen, met aanvullende veiligheids- en PK-gegevens van twee open-label onderzoeken uitgevoerd bij 49 pediatrische proefpersonen die zijn blootgesteld aan naftifine hydrochloride crème.
De veiligheid en werkzaamheid van naftifine hydrochloride crème bij de behandeling van tinea cruris en interdigitale tinea pedis bij pediatrische patiënten jonger dan 12 jaar zijn niet vastgesteld. De veiligheid en werkzaamheid van naftifinehydrochloridecrème bij de behandeling van tinea corporis bij pediatrische patiënten jonger dan 2 jaar zijn niet vastgesteld.
Geriatrisch gebruik
Clinische studies van naftifine hydrochloride crème bevatten niet voldoende proefpersonen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere proefpersonen.
Naftifine Crème Beschrijving
Naftifine hydrochloride crème, USP is een witte tot gebroken witte crème uitsluitend voor uitwendig gebruik. Elke gram bevat 20 mg naftifinehydrochloride, USP, (2%), een synthetische allylamine antischimmelverbinding.
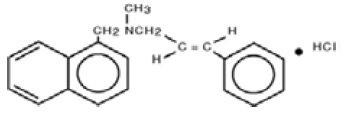
Chemisch gezien is naftifine HCl (E)-N-Cinnamyl-N-methyl-1-naftalenemethylaminehydrochloride.
De molecuulformule is C21H21N-HCl met een molecuulgewicht van 323,86.
De structuurformule van naftifinehydrochloride, USP is:
Naftifinehydrochloridecrème, USP bevat de volgende niet-werkzame bestanddelen: benzylalcohol, cetylalcohol, cetyl esters wax, isopropylmyristaat, polysorbaat 60, gezuiverd water, natriumhydroxide, sorbitaanmonostearaat, en stearylalcohol. Zoutzuur kan worden toegevoegd om de pH aan te passen.
Naftifinecrème – Klinische farmacologie
Werkingsmechanisme
Naftifinehydrochloridecrème is een topisch antischimmelmiddel .
Farmacodynamiek
De farmacodynamiek van naftifinehydrochloridecrème is niet vastgesteld.
Farmacokinetiek
In vitro en in vivo onderzoeken naar biologische beschikbaarheid hebben aangetoond dat naftifine in voldoende concentratie het stratum corneum penetreert om de groei van dermatofyten te remmen.
De farmacokinetiek van naftifine hydrochloride crème werd beoordeeld na eenmaal daagse topische toepassing gedurende 2 weken bij 21 volwassen proefpersonen, zowel mannen als vrouwen, met zowel tinea pedis als tinea cruris. De mediaan van de totale hoeveelheid aangebrachte crème was 6,4 g (range 5,3 g tot 7,5 g) per dag. De resultaten toonden aan dat de systemische blootstelling (d.w.z. maximale concentratie (Cmax) en oppervlakte onder de curve van tijd 0 tot 24 uur (AUC0-24) aan naftifine toenam gedurende de behandelingsperiode van 2 weken bij alle 21 proefpersonen. Het geometrisch gemiddelde (variatiecoëfficiënt of CV%) van de AUC0-24 was 117 (41,2) ng*hr/mL op dag 1, en 204 (28,5) ng*hr/mL op dag 14. Het geometrisch gemiddelde (CV %) van de Cmax was 7 ng/mL (55,6) op dag 1 en 11 ng/mL (29,3) op dag 14. De mediane tijd tot Cmax (Tmax) was 8 uur (bereik 4 tot 24 uur) op dag 1 en 6 uur (bereik 0 tot 16 uur) op dag 14. Accumulatie na 14 dagen van topische toepassing was minder dan tweevoudig. De trogconcentraties stegen in het algemeen gedurende de 14-daagse studieperiode. Naftifine werd nog steeds gedetecteerd in plasma bij 13/21 (62%) proefpersonen op dag 28, de gemiddelde (standaarddeviatie of SD) plasmaconcentraties waren 1,6 ± 0,5 ng/mL (bereik onder de limiet van kwantificering (BLQ) tot 3 ng/mL). In hetzelfde farmacokinetische onderzoek, uitgevoerd bij patiënten met tinea pedis en tinea cruris, was de mediane fractie van de dosis die tijdens de behandelingsperiode in de urine werd uitgescheiden 0,0016% op dag 1 versus 0,0020% op dag 14.
In een tweede onderzoek waaraan 22 proefpersonen deelnamen, werd de farmacokinetiek van naftifine hydrochloride crème beoordeeld bij 20 pediatrische proefpersonen van 13 tot minder dan 18 jaar met zowel tinea pedis als tinea cruris. De proefpersonen werden gedurende 2 weken behandeld met een mediane dosis van 8,1 g (range 6,6 g tot 10,1 g) eenmaal daags aangebracht op de aangetaste gebieden. Uit de resultaten bleek dat de systemische blootstelling toenam tijdens de behandelingsperiode. Geometrisch gemiddelde (CV%) AUC0-24 was 138 (50,2) ng*hr/mL op dag 1, en 192 (74,9) ng*hr/mL op dag 14. De geometrisch gemiddelde (CV%) Cmax was 9,21 ng/mL (48,4) op dag 1 en 12,7 ng/mL (67,2) op dag 14. De mediane fractie van de dosis die tijdens de behandelingsperiode in de urine werd uitgescheiden, was 0,0030% op dag 1 en 0,0033% op dag 14.
In een derde onderzoek werd de farmacokinetiek van naftifinehydrochloridecrème beoordeeld bij 27 pediatrische proefpersonen van 2 tot minder dan 12 jaar met ten minste matige tinea corporis. De proefpersonen werden verdeeld in jongere (leeftijd 2 tot minder dan 6 jaar, 17 proefpersonen) en oudere (6 tot minder dan 12 jaar, 10 proefpersonen) groepen. Mediane doses van 1,3 g (range 1 g tot 3,1 g) en 2,3 g (range 2,2 g tot 4,2 g) werden eenmaal daags gedurende 2 weken aangebracht in respectievelijk de jongere en oudere groep, op het aangetaste gebied plus een marge van ½ inch. Farmacokinetische plasma- en urinebepalingen werden alleen in de oudere groep op dag 1 en in beide groepen op dag 14 uitgevoerd. Alle proefpersonen toonden meetbare niveaus van naftifine in plasma na topische toepassing van naftifine hydrochloride crème. Na een eenmalige dosis op Dag 1 bij proefpersonen van 6 tot jonger dan 12 jaar, waren de geometrisch gemiddelde (CV%) waarden van Cmax en AUC0-24 respectievelijk 3,60 (76,6) ng/mL en 49,8 (64,4) ng*h/mL. Op dag 14 in deze groep waren de Cmax en AUC0-24 respectievelijk 3,31 (51,2) ng/mL en 52,4 (49,2) ng*h/mL. Bij proefpersonen van 2 tot jonger dan 6 jaar op dag 14 waren de Cmax en AUC0-24 respectievelijk 3,98 (186) ng/mL en 54,8 (150) ng*h/mL. In de oudere groep proefpersonen van 6 tot 12 jaar oud, waren de systemische blootstellingen (zowel Cmax als AUC0-24) op Dag 1 en 14 vergelijkbaar. De mediane fractie van de dosis die gedurende 24 uur na toediening van het geneesmiddel op Dag 1 en Dag 14 in de urine werd uitgescheiden, bedroeg respectievelijk 0,0029% en 0,0014%.
Microbiologie
Hoewel het exacte werkingsmechanisme tegen schimmels niet bekend is, lijkt naftifine hydrochloride te interfereren met de sterolbiosynthese door remming van het enzym squalene2, 3-epoxidase.Deze remming van de enzymactiviteit leidt tot verminderde hoeveelheden sterolen, vooral ergosterol, en een overeenkomstige ophoping van squaleen in de cellen.
Resistentiemechanisme
Tot op heden is een resistentiemechanisme tegen naftifine niet geïdentificeerd.
Naftifine is werkzaam gebleken tegen de meeste isolaten van de volgende schimmels, zowel in vitro als bij klinische infecties, zoals beschreven in de rubriek INDICATIES EN GEBRUIK:
Trichophyton rubrum
Nonklinische toxicologie
Carcinogenese, Mutagenese, Vruchtbaarheidsstoornissen
In een 2-jarig huidcarcinogeniteitsonderzoek werd naftifine hydrochloride crème toegediend aan Sprague-Dawley ratten in topische doses van 1%, 2% en 3% (10, 20, en 30 mg/kg/dag naftifine hydrochloride). In dit onderzoek werden geen geneesmiddelgerelateerde tumoren waargenomen tot aan de hoogste in dit onderzoek beoordeelde dosis van 30 mg/kg/dag (12 maal MRHD op basis van AUC-vergelijking).
Naftifinehydrochloride vertoonde geen aanwijzingen voor mutageen of clastogeen potentieel op basis van de resultaten van twee in vitro genotoxiciteitstests (Ames-test en Chinese hamster-ovariumcel-chromosoomafwijkingstest) en één in vivo genotoxiciteitstest (micronucleus-test in het beenmerg van de muis).
Orale toediening van naftifinehydrochloride aan ratten, gedurende de paring, dracht, baring en lactatie, toonde geen effecten op de groei, vruchtbaarheid of voortplanting, bij doses tot 100 mg/kg/dag (6 maal MRHD).
Klinische studies
Tinea Cruris
Naftifine hydrochloride crème is onderzocht op veiligheid en werkzaamheid in een gerandomiseerd, dubbelblind, voertuiggecontroleerd, multi-center onderzoek bij 146 proefpersonen met symptomatische en dermatofytkweek positieve tinea cruris. De proefpersonen werden gerandomiseerd naar naftifine hydrochloride crème of een medium. De proefpersonen brachten gedurende 2 weken eenmaal daags naftifinehydrochloridecrème of een middel aan op het aangetaste gebied plus een rand van een halve centimeter gezonde huid rondom het aangetaste gebied. Tekenen en symptomen van tinea cruris (aan- of afwezigheid van erytheem, pruritus en schilfering) werden beoordeeld, en KOH-onderzoek en dermatofytenkweek werden uitgevoerd op het primaire werkzaamheidseindpunt in week 4.
De gemiddelde leeftijd van de proefpersonen was 47 jaar, 87% was man en 43% was blank. Op baseline werd bevestigd dat de proefpersonen tekenen en symptomen van tinea cruris hadden, positief KOH-onderzoek en bevestigde aanwezigheid van dermatofyten op basis van kweekresultaten van een centraal mycologisch laboratorium. De analyse van de intent-to-treat populatie bestond uit een vergelijking van de proporties proefpersonen met complete genezing bij het bezoek van week 4 (zie tabel 1). Volledige genezing werd gedefinieerd als zowel klinische genezing (afwezigheid van erytheem, pruritus en schilfering) als mycologische genezing (negatieve KOH- en dermatofytenkweek).
Het percentage proefpersonen met klinische genezing en het percentage proefpersonen met mycologische genezing op week 4 worden afzonderlijk weergegeven in tabel 1 hieronder.
|
Endpoint |
Naftifine Hydrochloride Cream, 2% |
Vehicle |
|
N=75 |
N=71 |
|
|
Complete Curea |
19 (25%) |
2 (3%) |
|
Effectieve behandelingb |
45 (60%) |
7 (10%) |
|
Mycologische genezing |
54 (72%) |
11 (16%) |
|
a. Volledige genezing is een samengesteld eindpunt van zowel mycologische genezing als klinische genezing. Klinische genezing wordt gedefinieerd als de afwezigheid van erytheem, pruritus en schilfering (graad 0). |
||
|
b. Effectieve behandeling is een negatief KOH-preparaat en een negatieve dermatofytekweek, erytheem, schilfering en pruritus met de gradaties 0 of 1 (afwezig of bijna afwezig). |
||
|
c. Mycologische genezing wordt gedefinieerd als negatieve KOH- en dermatofytenkweek. |
||
Interdigitale Tinea Pedis
Naftifine hydrochloride crème is onderzocht op werkzaamheid in een gerandomiseerd, dubbelblind, voertuiggecontroleerd, multicenter onderzoek bij 217 proefpersonen met symptomatische en dermatofytenkweekpositieve interdigitale tinea pedis. De proefpersonen werden gerandomiseerd naar naftifine hydrochloride crème of een medium. De proefpersonen brachten naftifine hydrochloride crème of een middel aan op het aangetaste deel van de voet plus een ½-inch marge van gezonde huid rondom het aangetaste deel, eenmaal daags gedurende 2 weken. Tekenen en symptomen van interdigitale tinea pedis (aan- of afwezigheid van erytheem, pruritus en schilfering) werden beoordeeld en KOH-onderzoek en dermatofytenkweek werden uitgevoerd op het primaire werkzaamheidseindpunt in week 6.
De gemiddelde leeftijd van de proefpersonen was 42 jaar, 71% was man en 57% was blank. Op baseline werd bevestigd dat de proefpersonen tekenen en symptomen van interdigitale tinea pedis, positief KOH-onderzoek en bevestigde dermatofytekweek hadden. Het primaire werkzaamheidseindpunt was het percentage proefpersonen met complete genezing bij het bezoek van week 6 (zie tabel 2). Volledige genezing werd gedefinieerd als zowel klinische genezing (afwezigheid van erytheem, pruritus en schilfering) als mycologische genezing (negatieve KOH- en dermatofytekweek).
De werkzaamheidsresultaten op week 6, vier weken na het einde van de behandeling, worden weergegeven in tabel 2 hieronder. Naftifine hydrochloride crème toonde volledige genezing bij proefpersonen met interdigitale tinea pedis, maar volledige genezing bij proefpersonen met alleen moccasin type tinea pedis werd niet aangetoond.
|
Endpoint |
Naftifine hydrochloride Cream, 2% |
Vehicle |
|
N=147 |
N=70 |
|
|
Complete Curea |
26 (18%) |
5 (7%) |
|
Effectieve behandelingb |
83 (57%) |
14 (20%) |
|
Mycologische genezing |
99 (67%) |
15 (21%) |
|
a. Volledige genezing is een samengesteld eindpunt van zowel mycologische genezing als klinische genezing. |
||
|
b. Effectieve behandeling is een negatief KOH-preparaat en een negatieve dermatofytekweek, erytheem, schilfering en pruritus met de gradaties 0 of 1 (afwezig of bijna afwezig). |
||
|
c. Mycologische genezing wordt gedefinieerd als negatieve KOH- en dermatofytenkweek. |
||
Tinea corporis
Naftifine hydrochloride crème is onderzocht op veiligheid en werkzaamheid in een gerandomiseerd, dubbelblind, voertuiggecontroleerd, multicenter onderzoek bij 184 proefpersonen met symptomatische en dermatofytenkweekpositieve tinea corporis. De proefpersonen werden gerandomiseerd naar naftifine hydrochloride crème of een medium. De proefpersonen brachten het studiemiddel gedurende twee weken aan op alle aangetaste lichaamsoppervlakken met tinea corporis plus een marge van een halve centimeter gezonde huid rondom de aangetaste laesies. Tekenen en symptomen van tinea corporis (aan- of afwezigheid van erytheem, verharding en pruritus) werden beoordeeld en KOH-onderzoek en dermatofytekweek werden uitgevoerd voor de beoordeling van het primaire werkzaamheidseindpunt op dag 21.
De onderzoekspopulatie was pediatrisch (ouder dan of gelijk aan 2 tot jonger dan 18 jaar) met een mediane leeftijd van 9 jaar (naftifine hydrochloride crème) of 8 jaar (voertuig); 61% van de proefpersonen was man en 45% was blank. Op baseline werd bevestigd dat de proefpersonen tekenen en symptomen van tinea corporis hadden, positief KOH-onderzoek hadden en een bevestigde dermatofytekweek hadden. Het primaire werkzaamheidseindpunt was het percentage proefpersonen met complete genezing op dag 21 van de behandeling. Volledige genezing werd gedefinieerd als zowel klinische genezing (afwezigheid van erytheem, verharding en pruritus op alle laesies aanwezig op baseline) als mycologische genezing (negatieve KOH- en dermatofytenkweek).
De werkzaamheidsresultaten op dag 21, één week na het einde van de behandeling, worden weergegeven in tabel 3 hieronder.
|
Naftifine Hydrochloride Crème, 2% |
Voertuig |
|
|
Eindpunt |
N=91 |
N=93 |
|
Complete Curea |
42 (46%) |
26 (28%) |
|
Effectieve behandelingb |
53 (58%) |
32 (34%) |
|
Mycologische genezing |
57 (63%) |
36 (39%) |
|
a. Volledige genezing is een samengesteld eindpunt van zowel mycologische genezing als klinische genezing. |
||
|
b. Effectieve behandeling is een negatief KOH-preparaat en een negatieve dermatofytekweek, erytheem, verharding en pruritus met de gradaties 0 of 1 (afwezig of mild). |
||
|
c. Mycologische genezing wordt gedefinieerd als een negatieve KOH- en dermatofytkweek. |
||
HOW SUPPLIED/STORAGE AND HANDLING
Naftifine hydrochloride crème, USP 2%, is een witte tot gebroken witte crème die wordt geleverd in de volgende maat:
45 gram tubes – NDC 70700-161-18
60 gram tubes – NDC 70700-161-17
Bewaar naftifine hydrochloride crème bij 25°C (77°F); uitstapjes toegestaan tot 15° tot 30°C (59° tot 86°F) .
Patient Counseling Information
- Informeer patiënten dat naftifine hydrochloride crème alleen voor uitwendig gebruik is. Naftifine hydrochloride crème is niet bestemd voor oraal, intravaginaal of oogheelkundig gebruik.
- Indien irritatie of gevoeligheid ontstaat bij het gebruik van naftifine hydrochloride crème dient de behandeling te worden gestaakt en een geschikte therapie te worden ingesteld. Patiënten moeten worden geïnstrueerd contact op te nemen met hun arts als deze aandoeningen zich ontwikkelen na gebruik van naftifinehydrochloridecrème.
Gedistribueerd door:
Xiromed, LLC,
Florham Park, NJ 07932
Rev. 09/2020
PI-161-00
PAKKET LABEL PRINCIPAAL DISPLAY PANEL SECTION – 45g Tube

NDC 70700-161-18
Naftifine Cream, 2%
Xiromed, LLC
Voor uitsluitend topisch gebruik
Niet voor oogheelkundig gebruik, oraal of intravaginaal gebruik
45 g
Rx Only
PAKKET LABEL PRINCIPAL DISPLAY PANEL SECTION – 60g Tube

NDC 70700-161-17
Naftifine Cream, 2%
Xiromed, LLC
Alleen voor uitwendig gebruik
Niet voor oogheelkundig gebruik, oraal of intravaginaal gebruik
60 g
Rx Only
| NAFTIFINE HYDROCHLORIDE naftifine hydrochloride crème |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Etiketteerder – Xiromed, LLC (080228637)
Registrant – Xiromed Pharma España, S.L. (468835741)
Meer over naftifine topical
- Bijwerkingen
- Tijdens zwangerschap of borstvoeding
- Doseringsinformatie
- Prijzen & Coupons
- En Español
- 7 Beoordelingen
- Gedragsklasse: topische antischimmelmiddelen
Consumenteninformatie
- Patiënteninformatie
- Naftifine Topical (Geavanceerd lezen)
Professionele informatie
- Voorschrijfinformatie
- Naftifine (Professioneel patiëntenadvies)
- Naftifine Gel (FDA)
Andere merken Naftin
Gerelateerde behandelingsgidsen
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Medische disclaimer