Energia de ionização dos elementos s- e p-Block
Energia de ionização dos elementos da terceira fila da tabela periódica apresentam o mesmo padrão que os elementos da tabela periódica (Li) e Be (Tabela 2)): as energias de ionização sucessivas aumentam constantemente à medida que os elétrons são removidos dos orbitais de valência (3s ou 3p, neste caso), seguido por um aumento especialmente grande da energia de ionização quando os elétrons são removidos dos níveis do núcleo preenchido, como indicado pela linha diagonal em negrito na tabela. Assim, na terceira linha da tabela periódica, o maior aumento da energia de ionização corresponde à remoção do quarto elétron do \ (Al), do quinto elétron do Si, e assim por diante – isto é, a remoção de um elétron de um íon que tem a configuração de elétron de valência do gás nobre anterior. Este padrão explica porque a química dos elementos normalmente envolve apenas elétrons de valência. É necessária muita energia para remover ou compartilhar os elétrons internos.
| Element | \(I_1\) | \(I_2\) | (I_3\) | (I_4\) | (I_5\) | (I_6\) | (I_7\) | |
|---|---|---|---|---|---|---|---|---|
| *Inner-electrão da casca | ||||||||
| Na | 495.8 | 4562.4* | – | – | – | – | – | – |
| Mg | 737.7 | 1450.7 | 7732.7 | – | – | – | – | – |
| Al | 577.4.4 | 1816.7 | 2744.8 | 11.577,4,4 | – | – | – | – |
| Si | 786,5 | 1577,1 | 3>3231,6 | 4355,5 | 16.090.6 | — | — | |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | — | |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4,3 | |
| Cl | 1251,2 | 2297,7 | 3822 | 5158.6 | 6540 | 9362 | 11,018.2 | |
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 | |
Exemplo \(\PageIndex{1}\PageIndex{1}): Maior Energia de Quarta Ionização
Das suas localizações na tabela periódica, prever qual destes elementos tem a maior energia de quarta ionização: B, C, ou N.
Dado: três elementos
Passado para: elemento com maior energia de quarta ionização
Estratégia:
- Lista a configuração eletrônica de cada elemento.
- Determinar se os elétrons estão sendo removidos de uma casca de valência cheia ou parcialmente cheia. Prever qual elemento tem a maior energia de quarta ionização, reconhecendo que a maior energia corresponde à remoção de elétrons de um núcleo de elétrons cheio.
Solução:
A Estes elementos encontram-se todos na segunda linha da tabela periódica e têm as seguintes configurações de electrões:
- B: 2s22p1
- C: 2s22p2
- N: 2s22p3
B A quarta energia de ionização de um elemento (I_4\) é definida como a energia necessária para remover o quarto electrão:
Porque o carbono e o azoto têm quatro e cinco electrões de valência, respectivamente, as suas energias de quarta ionização correspondem à remoção de um electrão de uma casca de valência parcialmente cheia. A quarta energia de ionização para o boro, no entanto, corresponde à remoção de um elétron da subesfera 1s2 preenchida. Isto deve requerer muito mais energia. Os valores reais são os seguintes: B, 25.026 kJ/mol; C, 6223 kJ/mol; e N, 7475 kJ/mol.
Exercicio \(\PageIndex{1}}): Energia de Segunda Ionização mais baixa
Das suas localizações na tabela periódica, preveja qual destes elementos tem a menor energia de segunda ionização: Sr, Rb, ou Ar.
Resposta
({Sr})
A primeira coluna de dados na tabela {2}(PageIndex{3}) mostra que as energias de primeira ionização tendem a aumentar na terceira linha da tabela periódica. Isso ocorre porque os elétrons de valência não se exibem muito bem uns aos outros, permitindo que a carga nuclear efetiva aumente de forma constante ao longo da linha. Os elétrons de valência são, portanto, atraídos mais fortemente para o núcleo, de modo que os tamanhos atômicos diminuem e as energias de ionização aumentam. Estes efeitos representam dois lados da mesma moeda: interações eletrostáticas mais fortes entre os elétrons e o núcleo aumentam ainda mais a energia necessária para remover os elétrons.
No entanto, a energia da primeira ionização diminui em Al (3s23p1) e em S (3s23p4). As configurações eletrônicas destas “exceções” fornecem a resposta porquê. Os elétrons da subesfera de alumínio 3s2 preenchidos são melhores no rastreamento do elétron 3p1 do que no rastreamento um do outro a partir da carga nuclear, de modo que os elétrons s penetram mais perto do núcleo do que o elétron p e o elétron p é mais facilmente removido. A diminuição em S ocorre porque os dois elétrons no mesmo orbital p se repelem um ao outro. Isto torna o átomo S ligeiramente menos estável do que seria de esperar, como é o caso de todos os elementos do grupo 16.
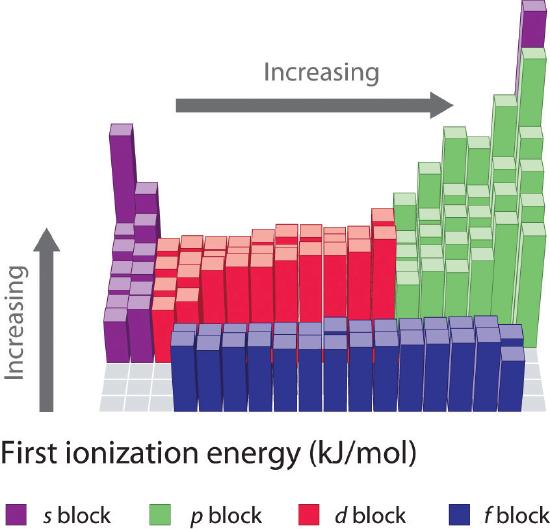
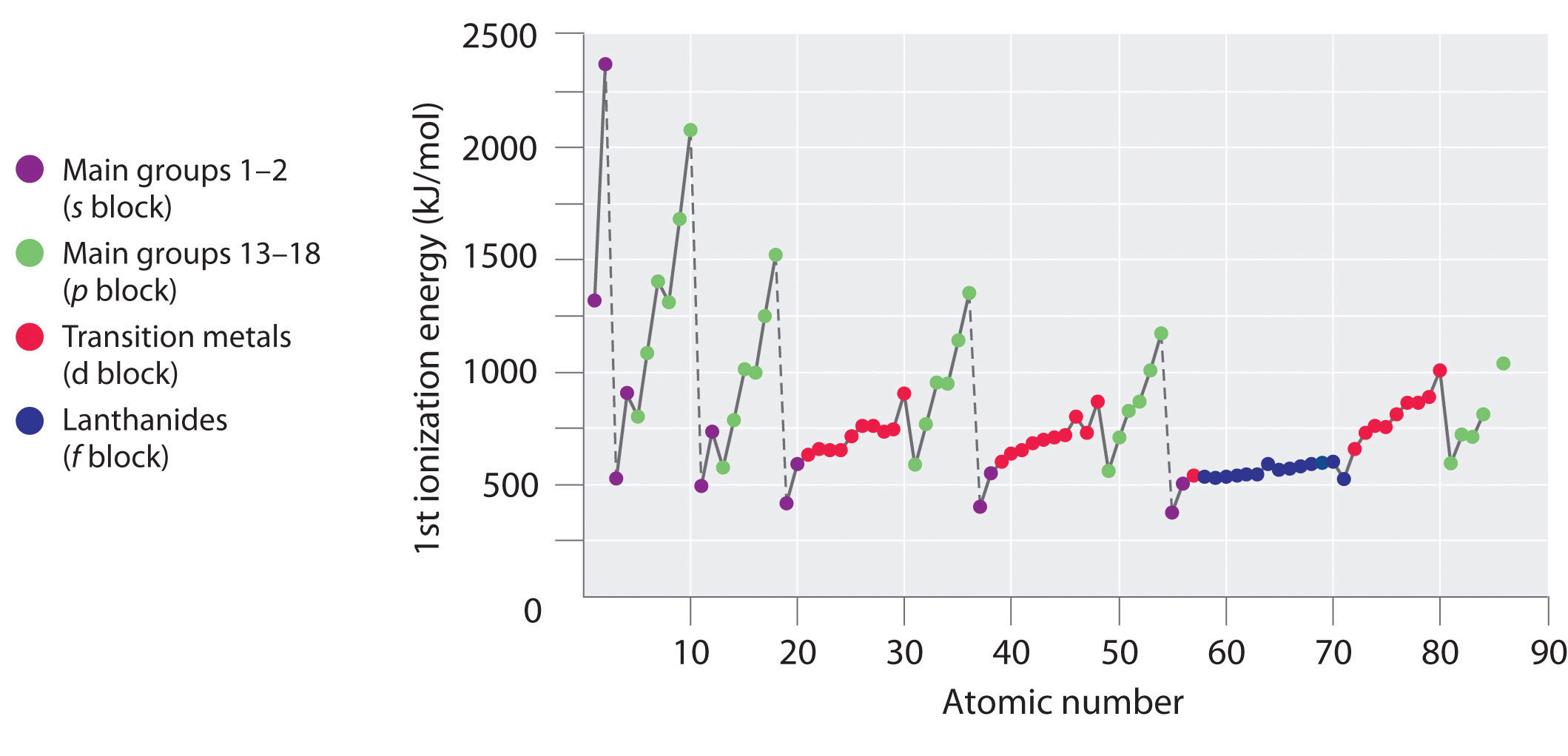
As primeiras energias de ionização dos elementos nas primeiras seis linhas da tabela periódica estão plotadas na Figura {1}(PageIndex{2}) e são apresentadas numérica e graficamente na Figura {2}(PageIndex{3}). Estas figuras ilustram três importantes tendências:
- As mudanças observadas na segunda (Li a Ne), quarta (K a Kr), quinta (Rb a Xe), e sexta (Cs a Rn) linhas dos blocos s e p seguem um padrão semelhante ao padrão descrito para a terceira linha da tabela periódica. Os metais de transição estão incluídos na quarta, quinta e sexta linhas, no entanto, e os lantanídeos estão incluídos na sexta linha. As primeiras energias de ionização dos metais de transição são um pouco semelhantes umas às outras, assim como as dos lantanídeos. As energias de ionização aumentam da esquerda para a direita em cada linha, com discrepâncias ocorrendo em ns2np1 (grupo 13), ns2np4 (grupo 16), e ns2(n – 1)d10 (grupo 12).
- As energias de ionização inicial geralmente diminuem em uma coluna. Embora o número quântico principal n aumente para baixo de uma coluna, as conchas internas preenchidas são efetivas na triagem dos elétrons de valência, portanto há um aumento relativamente pequeno na carga nuclear efetiva. Consequentemente, os átomos tornam-se maiores à medida que adquirem elétrons. Os elétrons de valência que estão mais distantes do núcleo são menos vinculados, tornando-os mais fáceis de remover, o que faz com que as energias de ionização diminuam. Um raio maior corresponde tipicamente a uma menor energia de ionização.
- Por causa das duas primeiras tendências, os elementos que mais facilmente formam íons positivos (têm as menores energias de ionização) ficam no canto inferior esquerdo da tabela periódica, enquanto os que são mais difíceis de ionizar ficam no canto superior direito da tabela periódica. Consequentemente, as energias de ionização geralmente aumentam diagonalmente do canto inferior esquerdo (Cs) para o superior direito (He).

Geralmente, \(I_1\) aumenta diagonalmente da parte inferior esquerda da tabela periódica para a parte superior direita.
Gallium (Ga), que é o primeiro elemento após a primeira linha de metais de transição, tem a seguinte configuração de elétrons: 4s23d104p1. Sua primeira energia de ionização é significativamente menor que a do elemento imediatamente anterior, o zinco, porque a subesfera cheia de gálio 3d10 está dentro da subesfera 4p, protegendo o único elétron 4p do núcleo. As experiências têm revelado algo de ainda maior interesse: o segundo e terceiro elétrons que são removidos quando o gálio é ionizado vêm do orbital 4s2, não da subesfera 3d10. A química do gálio é dominada pelo íon Ga3+ resultante, com a sua configuração de elétrons 3d10. Esta e outras configurações elétricas similares são particularmente estáveis e são frequentemente encontradas nos elementos mais pesados do bloco p. Por vezes são referidas como configurações pseudo-gás nobres. De facto, para os elementos que apresentam estas configurações, não são conhecidos compostos químicos nos quais os electrões são removidos do sub-concha (n – 1)d10 preenchidos.