Células T-regulatórias (Tregs), anteriormente conhecidas como células supressoras T, são um subconjunto de células T com papéis diretos tanto na auto-imunidade quanto nas respostas aos patógenos.
Tregs diminuem a inflamação através da secreção de citocinas imunossupressoras (IL-10, TGF-b) e também através da supressão directa de células T de efeito inflamatório (como as células Th1 e Th17).
Tregs controlam e provavelmente previnem doenças auto-imunes, contribuindo para a manutenção da tolerância aos auto-antigénios. O benefício terapêutico da transferência de Treg está bem estabelecido em modelos animais e estão em curso esforços para iniciar terapias com Treg humano para transplantes e pacientes com diabetes tipo 1.
Dada a importância deste subconjunto único de células T em tantas respostas imunológicas, muitos investigadores sentem-se negligentes se imunofenotiparem as suas populações celulares de interesse sem incluir uma medida de Treg na mistura. Mas quantificar Tregs pode ser complicado.
Por exemplo-Quais são os melhores marcadores a usar? Como você sabe com certeza que está medindo células T verdadeiramente supressoras?
Estratégias de datação para definir Tregs por citometria de fluxo
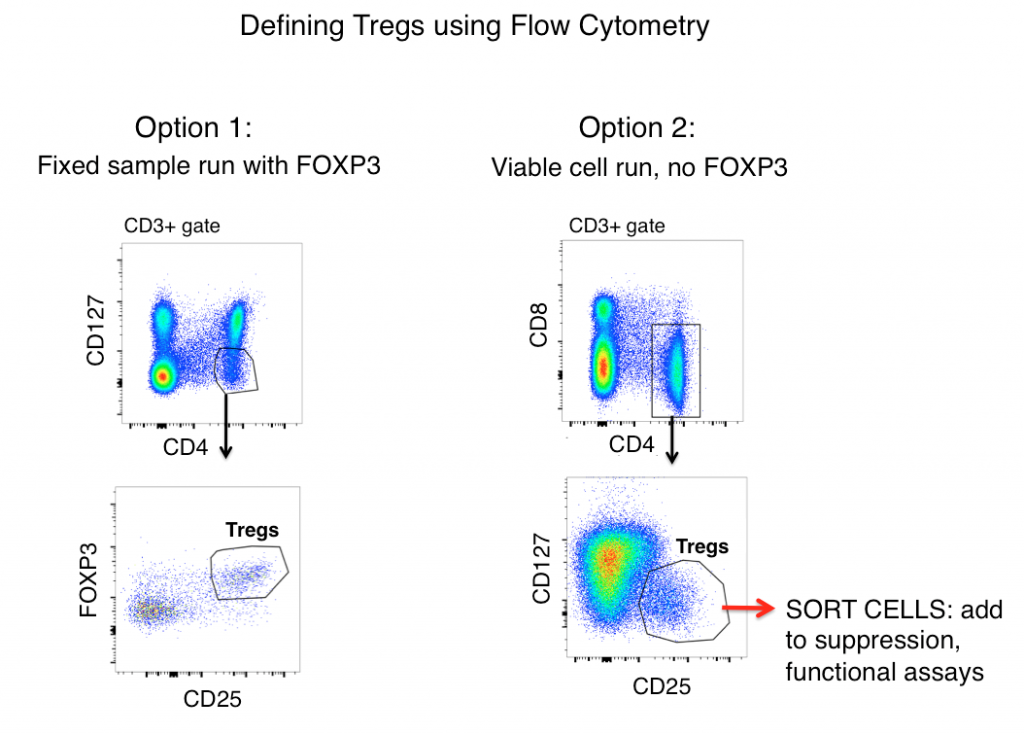
A estratégia padrão de datação Treg tanto para amostras de camundongos quanto para amostras humanas (após a primeira datação para fora dos doublets e datação em células vivas) inclui os antígenos CD3, CD4, CD25, FOXP3 e CD127.
Ao olhar apenas para a expressão antigênica, Tregs são frequentemente definidos como CD3+, CD4+, CD25hi, FOXP3+, e CD127lo (mostrado na figura abaixo como Opção 1). Usando estes marcadores, uma população clara é frequentemente visível a partir de amostras como esplenócitos de rato e PBMC humano.
No entanto, células T activadas frequentemente aumentam a regulação do CD25, e a expressão FOXP3 foi encontrada em linhagens de células T ‘effector’ (não-supressivas). Portanto, quando se depende apenas da citometria de fluxo fenotípica para definir Tregs, células T inflamatórias podem ser um lobo em pele de carneiro (Treg) e levar a uma interpretação incorreta dos dados.
Uma célula pode parecer um pato, mas será que ela se acobarda? A medição das funções do efetor de sua possível população de Treg ajudará muito a elucidar a precisão de sua estratégia de portões de fluxo. A fim de determinar se as células que você está definindo como Tregs se parecem funcionalmente com elas, a Opção 2 (veja abaixo) inclui omitir FOXP3 do seu painel, ordenando as células CD3+, CD4+, CD25hi, CD127lo, e então determinar as funções da sua população ‘Treg’ via análise de citocinas e/ou ensaios de co-cultura de supressão com células T não-Treg (CD3+ CD4+ CD25-, CD127hi). Tipicamente FOXP3 não pode ser incluído em painéis onde células viáveis são necessárias após a ordenação como a coloração intracelular é necessária.
>
>
Definindo a variedade crescente dos subconjuntos Treg
Existem muitos sabores de Tregs, incluindo tTregs, pTregs e iTregs.
Por exemplo, tTregs (também conhecido como nTregs) são gerados no timo e têm um repertório de TcR que é tendencioso para os autopeptídeos. Outro sabor, conhecido como pTregs, é gerado na periferia, e iTregs são induzidos na cultura via TGF-b.
Existem fabricantes associados a estes vários subconjuntos Treg e eles devem ser considerados para inclusão em um painel Treg anti-corpo, se a sua sub-configuração for de interesse. Por exemplo, em humanos, o CD39 é considerado um marcador tTreg confiável. Também, tanto em ratos quanto em humanos, Helios foi encontrado para distinguir tTregs de forma confiável dos subconjuntos p, e iTreg.
Definindo uma única célula como um Treg-Is It Possible?
Uma grande limitação no campo Treg é a falta de um ensaio de supressão de uma única célula.
Definir uma célula T individual como membro de uma linhagem de memória distinta, como Th1, Th2, ou Th17, pode ser realizado através da análise do analito com resolução de célula única, como a coloração intracelular de citocinas, já que estas células são primariamente, se não exclusivamente, definidas pelas citocinas que produzem.
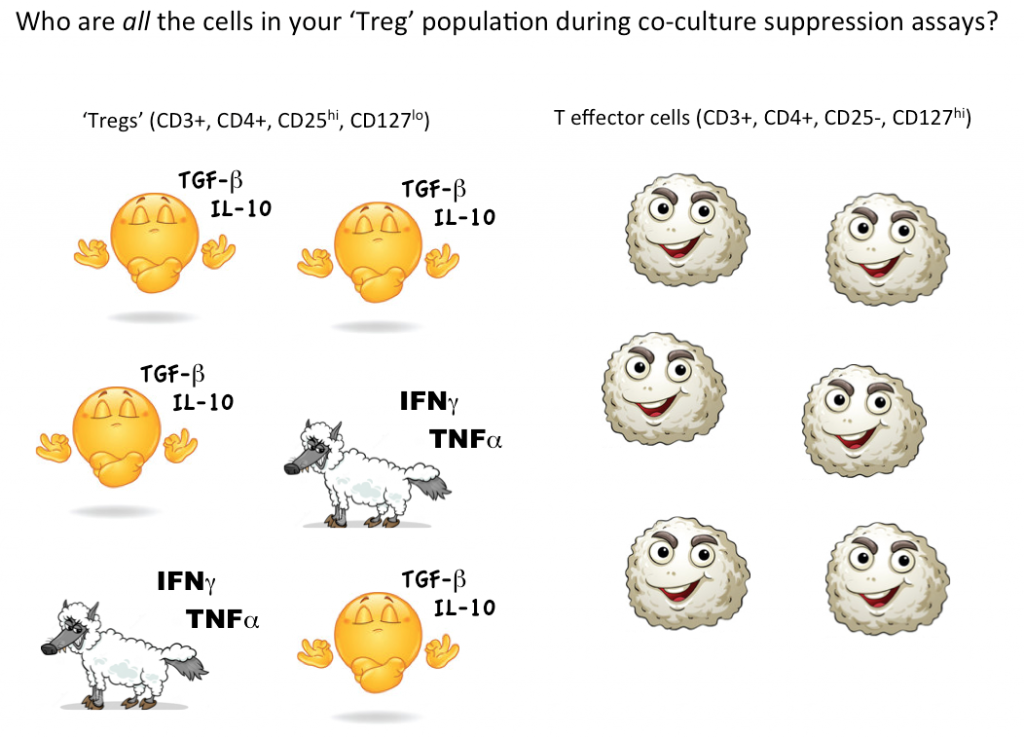
No entanto, para mostrar que uma única célula é um Treg, idealmente queremos ser capazes de quantificar que esta célula escolhida pode suprimir a função das células effector T (ou outros subconjuntos de células) em co-cultura. Atualmente a única maneira de testar a função supressora do Treg é em uma cultura a granel, onde se pode concluir que algumas (mas não todas, possivelmente nem mesmo a maioria) das células designadas como Tregs são supressoras.
>
 >
>>
>
Pensando novamente nos potenciais lobos ‘células T effector’ em roupas de ovelha, nós simplesmente não sabemos quantas células não supressoras, mesmo inflamatórias, estão escondidas em nossa estratégia de comedouros Treg. Usando a citometria de fluxo para primeiro gate on e classificar as células viáveis com marcadores consistentes com Tregs, depois testando funcionalmente para ver se, como um grupo, as células definidas pela sua estratégia de comutação realmente agem como Tregs, é atualmente a melhor maneira de quantificar Tregs na sua amostra.
Executando as estratégias corretas de comutação para definir Tregs por citometria de fluxo e contabilizando o número crescente de subconjuntos de Treg, você pode provocar as suas populações de Treg de interesse. A chave é testar funcionalmente essas populações após identificá-las, pois atualmente é difícil, senão impossível, definir uma única célula como Treg. No entanto, avanços estão sendo feitos diariamente e eventualmente a etiquetagem correta de células Treg simples será possível.
Para aprender mais sobre a análise de células T e outros tipos de células por citometria de fluxo, e para ter acesso a todos os nossos materiais avançados, incluindo 20 vídeos de treinamento, apresentações, livros de exercícios e membros de grupos privados, entre na lista de espera da Classe de Masterização em Ciclometria de Fluxo.
