Esta matéria é apresentada neste capítulo, pois dará ao aluno alguma visão dos métodos de análise utilizados no exame técnico do ferro e do aço. A natureza deste trabalho impede um tratamento detalhado do assunto – um tratamento que pode exigir uma estimativa de uma ou mais das seguintes substâncias:-Carbono (livre e combinado), enxofre, silício, fósforo, manganês, titânio, cobre, níquel, cobalto, cromo, alumínio, arsênico, antimônio, estanho, tungstênio, vanádio, nitrogênio, ferro. Geralmente, as estimativas mais necessárias são as de carbono, enxofre, silício e fósforo. Dos outros elementos e compostos mencionados, são necessárias determinações de um ou mais elementos no caso dos aços especiais. Para informações sobre essas determinações, o aluno é encaminhado para Análise Química e Química de Fundição, por Crobaugh ; The. Chemical Analysis of Iron, de Blair ; “Carbon in Steel by Direct Combustion”, de Blount, em The Analyst, Jan. 1902; “Sulphur in Wrought Iron and Steel”, de Auchy, na Jour. Amer. Chem. Soc., março de 1901, e outros artigos nos mesmos periódicos. O estudante que desejar ir mais longe deve, se possível, obter acesso aos artigos e artigos de Campbell, Drown, e outros, publicados de tempos em tempos nas várias revistas químicas e metalúrgicas.
Como o tempo do aluno é limitado, ele pode por enquanto adiar a estimativa de silício e fósforo, embora estes sejam dados por causa de sua importância tanto para o metalúrgico quanto para o fundidor.
Para que o aluno possa obter uma compreensão mais completa do assunto, algumas notas 0n a composição e propriedades das substâncias consideradas não estarão fora do lugar. Sobre a influência dos vários elementos no aço, consulte A Fabricação e Propriedades do Aço Estrutural, de H. H. Campbell.
O carbono existe no ferro em três estados – gráfico, dissolvido e combinado. Além destas, outras formas foram identificadas pelo microscópio.
Sulfuro existe no ferro principalmente como o sulfeto FeS. que é solúvel no ferro fundido.
Fósforo existe como fosforeto do ferro, que é completamente solúvel no ferro fundido.
Silício forma silicida do ferro, que também é solúvel no ferro fundido.
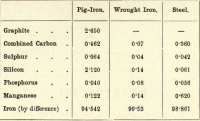
Destes quatro elementos, então, o carbono é o único que pode existir no estado livre. As variações nas proporções dos vários elementos presentes são quase infinitas, mas a seguinte breve tabulação dá a composição aproximada de ferro-gusa, ferro forjado e aço, embora cada um deles esteja sujeito a variações consideráveis.
O aluno deve estimar o seguinte:-
(1) Carbono,
(a) Total.
(b) Gráfico.
(c) Combinado.
(2) Enxofre.
(3) Silício. (Se o tempo permitir.)
(4) Fósforo. (Se o tempo permitir.)
CARBONO Total
Nesta estimativa o carbono é convertido em CO2 que é absorvido em potássio cáustico. A partir do peso de CO2 assim obtido o carbono é calculado.
À primeira vista parece que o procedimento mais simples seria acender os furos de ferro ou aço diretamente em uma corrente de oxigênio e absorver o CO2 assim formado em KHO. Infelizmente, este método, até agora, provou ser impreciso, ou onde a combustão completa foi obtida, o aparelho necessário para suportar a alta temperatura ou outras variações no tratamento não era adequado ao trabalho técnico (ver artigos de Blount em The Analyst). O aluno descobrirá que o método aqui apresentado não é de forma alguma ideal, do ponto de vista técnico, na pontuação de conveniência e rapidez, e parece haver uma probabilidade de ser substituído num futuro próximo por algum método de oxidação directa mais rápido.
Método adoptado.-Em referência aos muitos trabalhos sobre este assunto, será encontrada uma grande variedade de métodos. O método aqui dado dará resultados precisos com os cuidados habituais. Resumidamente é o seguinte:-
O ferro é dissolvido numa solução de cloreto duplo de potássio e cobre, feito ácido com HCl. O cobre metálico é precipitado e redissolvido; o ferro é dissolvido, sendo o carbono deixado em suspensão. É então recolhido e inflamado no forno de combustão com oxigênio, e o CO2 evoluído é pesado.
Solução do Ferro -Pesar 1 grama de brocas de ferro-gusa. Transferência para um copo de 300 c.c. Adicionar 100 c.cs. CuCl2,2KCl,2H2O solução, que é feita da seguinte forma. Dissolver em água 149,1 partes de KCl e 170,3 partes de CuCl2, 2H2O cristalizados. Evaporar e cristalizar o cloreto duplo. Dissolver 300 gms. do sal duplo em água destilada. Filtrar através do amianto inflamado, e conservar em garrafas com rolha de vidro.
Ao conteúdo do copo adicionar 7 c.cs. HCl para tornar a solução ácida. Mexer intermitentemente até que a solução do ferro seja efetuada. Colocar o copo e o conteúdo no final da solução num banho de água a uma temperatura de cerca de 60° C. Estão a ocorrer as seguintes reacções-Fe + CuCl2 = FeCl2 + Cu e Cu + CuCl2 = 2CuCl. O KCl simplesmente auxilia a solução do cobre precipitado. Em cerca de 40 minutos após a adição dos cloretos duplos, a solução deve estar quase completa e a maior parte do cobre dissolvido. Lave as laterais do copo com um pouco de cloreto duplo acidulado. À solução, adicionar um pouco de amianto inflamado para assentar a matéria carbonada e evitar que esta entupa o filtro (como recomendado por Barba).
Para filtração, barcos especiais de platina, montados no princípio do cadinho da Gooch, são muito convenientes. O aluno pode, no entanto, filtrar a matéria carbonada por meio de um cadinho Gooch auxiliado por sucção artificial, sendo a matéria carbonada lavada com um jacto de água depois de o líquido ter passado pelo filtro. Lavar cuidadosamente o carbono no filtro com água quente. Seque o cadinho e
contentes no forno de ar a 100 C. A matéria carbonada está agora pronta para a ignição.
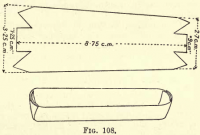
Oxidação do Carbono.-Prepare um barco de platina cortando um pedaço de folha de platina como na fig. 108, dobrando os lados e as extremidades para formar um cocho. Transferir a matéria carbonada e o amianto da Gooch para o barco.
O forno de combustão, acessórios e acessórios devem ser colocados em ordem. O aparelho de purificação de oxigênio é novamente utilizado, mas desta vez é fornecido com um tubo de três vias, com torneiras inseridas entre o armazenamento e os purificadores. Isto permite que uma corrente de ar seja aspirada através do aparelho. O tubo de combustão pode ser de vidro duro Jena, porcelana ou platina. Dois tubos U são utilizados entre o forno e as lâmpadas de potássio. O membro do primeiro tubo mais próximo do forno contém o CuSO4 anidro e o outro membro o CuCl anidro. O segundo tubo de U contém CaCl2 seco. Estes dois tubos formam o ‘trem purificador’. O CuCl absorve qualquer Cl, e as outras substâncias qualquer H2O. Este conjunto servirá para muitas determinações. Seguem-se as lâmpadas de potássio e os tubos de protecção, e um aspirador deve ser útil para extrair uma corrente de ar através do aparelho, quando necessário. As lâmpadas potássicas são carregadas com 8E. KHO, e o tubo de guarda com CaCl2. Teste o forno e as lâmpadas como descrito anteriormente (ver Carvão e Coque), sendo o tubo carregado como em esboço, sendo o barco para o presente mantido no forno de ar a 100° C.
Quando tudo estiver pronto, tendo os queimadores sido desligados há algum tempo, o barco e o conteúdo são inseridos. Os queimadores são acendidos da parte da frente, trabalhando gradualmente para trás, e uma corrente lenta de oxigénio cerca de duas bolhas por segundo tendo sido previamente ligado até que o tubo esteja cheio de oxigénio. Regule a temperatura até que o barco esteja em um vermelho baço, e se a solução nas lâmpadas mostrar sinais de corrida de volta para o forno, aumente a corrente de oxigênio para três ou quatro bolhas por segundo.
Desde o momento de colocar no barco cerca de cinqüenta minutos será suficiente para uma combustão completa. Desligue o oxigênio e passe uma corrente de ar por dez minutos.
As lâmpadas de potássio e o tubo de guarda são agora removidos e pesados, e o carbono calculado como de costume.
(b) Carbono Gráfico – O ferro é, por alguns, dissolvido em HCl, por outros em HNO3 quando o carbono gráfico permanece como um resíduo. Para o ferro-gusa qualquer dos métodos, com cuidado, dá bons resultados, mas para os aços contendo grafite Blair recomenda solução em ácido nítrico. (Para este método consultar Blair.)
Pesar 5 gms. de brocas de ferro-gusa. Dissolver em 50 c.cs. SE. HCl com auxílio de calor suave. Ferver durante alguns minutos. Diluir até 100 c.cs. (quase). Filtrar através de um cadinho de Gooch. Lavar bem com água quente e depois com E. KHO em ebulição. (Isto dissolve qualquer SiO2.) Lavar novamente com água quente para remover o KHO. Seque o cadinho e o conteúdo.
Estime o carbono como antes por combustão, e calcule a percentagem como habitualmente.
(c) Carbono Combinado (por diferença).- Sendo o carbono total e o carbono gráfico conhecido, o carbono combinado é obtido subtraindo o gráfico do carbono total.
Para métodos diretos de estimativa consultar as autoridades mencionadas.
ESTIMATIVO DO SULFUR EM FERRO & AÇO
Existem consideráveis diferenças de opinião quanto ao melhor método de estimativa do enxofre em ferro e aço. A antiga solução aqua regia e o método de precipitação BaCl2 é admitida como muito imprecisa; mas a solução lenta em HNO3, com muito pouco ou nenhum HCl presente, seguida de precipitação cuidadosa por BaCl2 na presença de um excesso definido de HCl e com os devidos cuidados quanto ao tempo e condições de precipitação, e precauções contra a contaminação do precipitado por ferro – com estes e cuidados bons resultados são possíveis de se obter. Blair, por outro lado, recomenda solução em HCl, sendo o S evoluído como H2S, que é absorvido em uma solução (alcalina) de Pb(NO3)2 formando PbS, que é dissolvido em HCl + KClO3, e o S precipitado como BaSO4. Para mais métodos ver Blair, Stillman, Auchy, Crobaugh, e Drown. Outro método de uso comum é o da evolução do S como H2S, seguido da absorção em solução de cloreto de cádmio. O sulfureto de cádmio precipitado é dissolvido em HCl e o S estimado por titulação com uma solução de iodo, ou mais comum ainda, o H2S é absorvido em água br. e depois precipitado como BaSO4 ou é absorvido em NaOH e titulado com iodo; sendo este último o método preferido. (Veja Blair.) O seguinte método é dado aqui:-
Oxidação por HNO3 (o chamado método Aqua Regia).-Pesar 5 gms. de brocas e transferir para um copo de 200 c.c. profundo. Adicione cuidadosamente cerca de 40 c.cs. 16E. HNO3, em lotes de cerca de 10 c.c. de cada vez, cobrindo o copo com um grande vidro de relógio e tendo cuidado para que a acção não seja demasiado violenta. Quando a ação aparentemente cessar, note se todas as partículas estão dissolvidas (exceto qualquer carbono). Se não, aqueça no banho de areia e adicione 3 ou 4 gotas de 16E. HCl, e aquecer até dissolver.
Quando a solução estiver completa, adicionar um pouco de Na2CO3 para converter qualquer H2SO4 em Na2SO4, que é não volátil na evaporação.
Remover do banho de areia, e adicionar 5 c.c. de HCl forte em excesso do necessário para apenas dissolver qualquer composto de ferro precipitado pelo Na2CO3. Filtrar o SiO2, e C. Lavar bem. Evaporar até à secura para tornar o SiO2 insolúvel. Absorver com HCl e evaporar até que o Fe2Cl6 comece a cristalizar. Em seguida, adicionar 5 c.cs. HCl. e filtrar se algum resíduo estiver presente. (Se nenhum estiver presente, nenhum SiO2 estava em solução, e a evaporação poderia ter sido omitida). Filtrar e lavar cuidadosamente o precipitado na Gooch, levando o líquido e as lavagens até cerca de 100 c.cs.
Calor a ferver. Adicione 10 cs. de solução saturada de BaCl2. Ferva durante 30 minutos. Deixar repousar durante a noite. Filtrar através de uma Gooch. Lave com um pouco de E. HCl. e depois com água. Secar, inflamar e pesar como habitualmente o BaSO4, que deve ser branco, e não contaminado com sais de ferro.
Calcular a percentagem de S da forma habitual. Como alguns dos reagentes usados podem conter enxofre, deve-se executar um branco, usando as mesmas quantidades da análise real, e qualquer enxofre encontrado deve ser deduzido do resultado anterior.
ESTIMO DE SILICON
O método aqui dado é o de Drown, e é rápido e exato. O ferro é dissolvido em HNO3, seguido por H2SO4, com evaporação até a secura. Segue-se a solução, deixando o silício no resíduo como SiO2.
Details.-Pesar 2 gms de brocas, e transferir para uma placa de platina ou porcelana. Adicione 30 c.cs. 8E. HNO3 Quando a ação aparentemente cessar, adicione 20 c.cs. 18E. H2SO4, e evapore. (Blair recomenda uma suave explosão de ar quente tocando na superfície do líquido. O ar é aquecido passando por uma pequena espiral de tubo de cobre aquecido sobre um bunsen. A evaporação é assim apressada e evitada em espiral). Continuar a evaporação até que os vapores copiosos de SO3 saiam. Arrefeça, e dilua cuidadosamente com água destilada até 130 c.cs. Aqueça até que todo o FeSO4 seja dissolvido. Filtrar, e lavar primeiro com um pouco de E. HCl, e depois com água quente. Esta filtração é melhor realizada com um papel de filtro sem cinzas de 7 cm. (verifique as cinzas acendendo dois ou três dos papéis). Secar; transferir para um cadinho de platina; acender como de costume e pesar. Ao cadinho adicionar 5 c.cs. de H2SO4 e 5 c.cs. de HF forte. Evaporar cuidadosamente até à secura, utilizando um jacto de ar quente para acelerar a evaporação. Acender, e pesar novamente. Desde que o H2SO4 e o HF sejam puros, a diferença de peso representa SiO2. Verificar o H2SO4 e HF (particularmente este último) evaporando um branco. Qualquer resíduo encontrado deve ser permitido para.
ESTIMO DO FÓSFORO
Aqui, novamente, vários métodos são dados por diferentes autoridades, a maioria deles produzindo resultados precisos quando cuidadosamente seguidos. Os dois métodos mais adequados à análise técnica são o método de redução volumétrica preparado pelo sub-comitê (Srs. Barba, Blair, Drown, Dudley e Shimer) do International Steel Standards Committee, E.U.A., e o método de redução modificada, como dado pelos Srs. Dudley e Pease, Jour. Anal. Chem., vii. 108. O primeiro método é totalmente discutido em Blair’s Analysis of Iron; o segundo método é dado aqui.
O ferro é dissolvido, e o P precipitado como fosfo-molibdato de amônio. Este é dissolvido, e pela ação de Zn e H2SO4 o MoO3 é reduzido, e o líquido reduzido é então titulado com K2Mn2O8 (solução padrão), e a partir do número de c.cs. utilizado o conteúdo de P pode ser calculado.
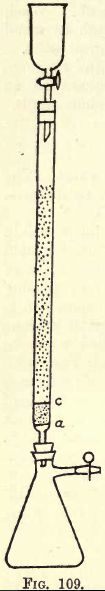
Detalhes. -Onde muito trabalho deve ser feito, é necessário um aparelho de agitação (ver Catálogos de Abastecimento Químico). O aluno, no entanto, pode realizar o tremor necessário à mão. Antes de proceder à análise, o aparelho redutor (uma modificação do redutor Jones) deve ser preparado (ver fig. 109).
Em a é um disco finamente perfurado de folha de platina robusta. Entre a e c está cerca de ¾ polegada de areia branca limpa, c é outro disco de platina perfurado.
Acima deste disco o tubo é preenchido com zinco amalgamado granulado fino, preparado assim:-Dissolver 5 gms. Hg em 25 c.cs. de HNO3 forte, diluindo com água e fazendo a solução até 1 litro. Nesta solução
dissolver meio quilo de zinco granulado que passa por uma peneira de 20 mas não de 30. Agitar durante um ou dois minutos. Despeje a solução. Lave e seque o zinco, que agora está amalgamado. O funil e o frasco são colocados no aparelho como mostrado.
Preparar os seguintes Reagentes :-
(a) A Solução Oxidante Forte de K2Mn2O8. 12 gms. de K2Mn2O8 puro em 1 litro de água. Filtro e frasco.
(b) A Solução de Molibdato.-Dissolver 50 gms. MoO3 em 200 c.cs, NH4HO (S.G. .96). Filtrar, e ao filtrado adicionar 500 c.cs. HNO3 (S.G. .1.2). Deixe repousar pelo menos 24 horas antes de usar.
(c) A Solução Ácida de Sulfato de Amônia. -Para 500 c.cs. água destilada adicione 27,5 c.cs. NH4HO (S.G. 0.96), e depois 24 c.cs. de H2SO4 puro (S.G. 1.84), e diluir a 1000 c.cs.
(d) A Solução Padrão K2Mn2O8.-Dissolver 2 gms. de K2Mn2O8 cristalizado em 1000 c.cs de água destilada. Padronize a solução da seguinte forma : Pesar 3 lotes de .1 a .3 gm. cada um dos fios de ferro completamente limpos, cujo conteúdo de ferro é conhecido. Transferir para 100 c.c. Erlenmeyer, e adicionar a cada 40 c.cs. 8E. H2SO4. Quando dissolvido, ferver 5 minutos; diluir a 150 c.c., e passar pelo redutor e lavar, levando o volume até 200 c.c., como indicado na análise. Titular cada lote com tlie K2Mn2O8. Os resultados devem concordar para o ferro metálico a 1/100 miligrama. Fazer a devida consideração para as impurezas no fio tomado. Suponha 1 c.c. K2Mn2O8 = .0034923 gm, Fe, depois multiplique este valor em Fe pela razão de MoO3 para Fe, nomeadamente, .9076, e o produto pela razão do P
presente para MoO3 nomeadamente, .019, temos
1 c.c. K2Mn2O8 = .0000602 gm. P
Análise
Pesar 1 gm. de furos. Transferir para um balão Erlenmeyer de 200 c.c. Adicionar 70 c.cs. 5E. HNO3. Quando a solução estiver completa, ferver um minuto, e adicionar 10 c.c. da solução ‘oxidante’ de K2Mn2O8. Roil till the pink color disap disapare e MnO2 separates out. Remover, e adicionar gradualmente com cristais agitadores de FeSO4 puro (livre de fósforo) até que o conteúdo se dissipe. Aqueça a solução a 80° C. (se As estiver presente, a 35° C.). Adicione 75 c.cs. da solução de molibdato a uma temperatura de 27° C. Feche o frasco com uma rolha de borracha e agite durante 5 minutos. Deixe repousar durante 5 minutos. Depois filtrar através de um filtro de 9 cm e lavar com a solução ácida de sulfato de amónio até que algumas gotas da lavagem não dêem cor com sulfureto de amónio.
Dissolver o precipitado sobre o papel com 5 c.cs. NH4HO (S.G. 0.90) e 25 c.cs. de água, deixando a solução correr de volta para o frasco original, dissolvendo assim qualquer precipitado aderido aos seus lados. Lavar até filtrar e as lavagens chegam a 150 c.cs. Adicionar 10 cs. de H2SO4 forte (S.G. 1.84), e diluir até 200 cs. A solução está agora pronta para a redução.
Derramar 100 c.cs. quente ~E/2 H2SO4 no funil. Conecte o frasco à bomba do filtro e abra a pinça, de modo que a solução quase, mas não completamente, escorra para fora do funil. Depois ao funil adicione o seguinte branco-5 c.cs. NH4HO (S.G. 0.90), 10 c.cs. H2SO4 (S.G. 1.84), e 50 c.cs. de água, misturados entre si. Abrir novamente a pinça, de modo a quase esgotar esta mistura do funil. Agora adicione 200 c.cs, E/2 H2SO4 ao funil, e passe quase através de.
Desligue o frasco, primeiro fechando o óleo da torneira do funil. Titular o conteúdo do frasco com K2Mn2O8. Geralmente cerca de 0,1 c.cs. permanganato são assim consumidos, e esta quantidade deve ser deduzida de leituras futuras.
Transfira agora a solução a ser reduzida para o funil. Anexe um frasco limpo. Ligue e ligue a bomba do filtro. Abra a torneira e a pinça, de modo a quase passar através da solução. Lave o frasco que continha a solução com 100 c.cs. E/2 H2SO4. Adicione isto ao funil, e trate como antes.
Finalmente, adicione e quase passe por mais 100 cs. do ácido.
A solução reduzida no frasco do filtro deve agora ser verde brilhante.
Remova como antes e titule com a solução permanganato. O verde muda para castanho-rosado, depois amarelo-rosado, depois incolor e finalmente obtém-se um rosa permanente (após um minuto de repouso). Da leitura obtida deduz-se a leitura em branco, e calcula-se a percentagem de P presente a partir dos dados acima indicados.
Em vez deste método volumétrico, alguns químicos preferem pesar directamente o precipitado amarelo de fosfo-molibdato. Para detalhes ver Blair’s Analysis of Iron, p. 108.
Note.-O aluno deve, sempre que possível, tirar proveito das referências a autoridades especiais. Por esta altura ele deve ser capaz de consultar, comparar, e, até certo ponto, usar judiciosamente tais materiais. Nenhum livro-texto pode dar um tratamento abrangente de ‘ Ferro e Aços’, ou, aliás, de qualquer um dos assuntos tratados nesta seção; portanto, as referências que são dadas, juntamente com a literatura atual, devem ser cuidadosamente examinadas pelo analista que deseja se sobressair no trabalho técnico. A determinação colorimétrica do carbono combinado pelo Método de Eggertz foi dada; o manganês pode ser determinado de forma algo semelhante pelo Método Colorimétrico de Peter, ou pelo Método do Acetato (ver Blair, etc.).