Partículas Subatómicas
Todos os elementos são compostos por partículas de matéria extremamente pequenas chamadas átomos. Podemos definir um átomo como a partícula mais simples de um elemento que tem as propriedades químicas desse elemento. As propriedades químicas incluem o estado físico do elemento (gás, líquido ou sólido), os tipos de ligações que o elemento pode formar, como ele reage com outros elementos, etc. Portanto, todos os átomos que compõem o elemento carbono têm as mesmas propriedades químicas.
Os físicos conseguiram jatear átomos separados em dezenas de partículas subatômicas diferentes, entretanto, apenas 3 delas são estáveis. Estes são os prótons, nêutrons e elétrons. Os prótons são partículas com carga positiva, têm massa e estão localizados no centro, ou núcleo do átomo. Os neutrões não têm carga, têm massa, e também estão localizados no núcleo do átomo. Os neutrões ligam-se com prótons de uma forma que ajuda a estabilizar o núcleo. Neutrons demais ou poucos podem resultar em um núcleo atômico que é instável e pode se decompor para formar outros elementos. Nós nos referimos a esses átomos como sendo radioativos. Embora a massa do nêutron seja ligeiramente maior que a de um próton, podemos atribuir a ambos a massa relativa de 1 (1 unidade de massa atômica ou amu). Os neutrões e prótons constituem quase toda a massa de um átomo. O terceiro tipo de partícula estável é o elétron. Os elétrons têm uma carga negativa mas são extremamente pequenos e têm uma massa de apenas 1/1850 a de um próton ou nêutron. São tão pequenos que, para fins práticos, não contribuem para a massa do átomo. Os elétrons se movem em torno do núcleo a velocidades tremendamente altas, viajando na verdade a uma velocidade próxima à da luz. Embora muitas vezes descrevamos os elétrons como residindo em órbitas que circundam o núcleo, como os planetas que orbitam o Sol, a física moderna nos ensina que este modelo é incorreto. Estas “orbitais” são na verdade áreas no espaço ao redor do núcleo onde os elétrons estarão localizados a maior parte do tempo. Esta área é frequentemente referida como a “nuvem” de electrões. É verdade, ainda é uma área específica, mas é um pouco mais amorfa do que uma órbita esférica. Para simplificar, porém, muitas vezes pensamos nelas como orbitais circulares parecidas com satélites. A imagem abaixo representa nosso modelo atual de um átomo de nitrogênio.
O núcleo de nitrogênio contém 7 prótons (laranja) e 7 nêutrons (verde). As áreas sombreadas ao redor do núcleo representam as orbitais dos elétrons (nuvens). Elétrons (azul) serão encontrados em algum lugar dentro destas orbitais. (Nota: a imagem não é desenhada à escala. Foi sugerido que se o núcleo fosse do tamanho de uma bola de basquete os elétrons estariam a cerca de seis quilômetros ou 3¾ milhas de distância!)
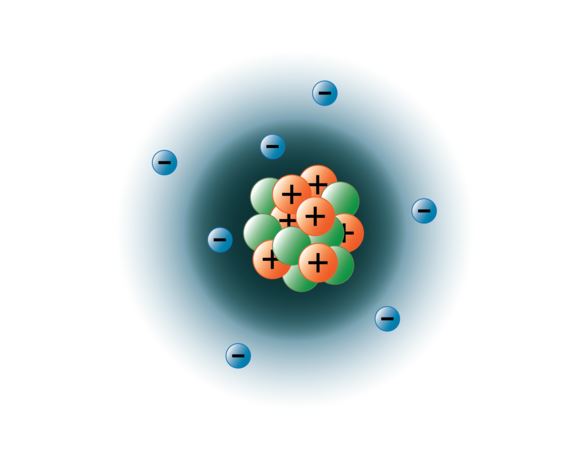
imagem criada pela estudante BYU-I Hannah Crowder Fall 2013
Número Atômico
Dê uma olhada na tabela periódica novamente e observe o número no topo de cada caixa. Este número é o número atómico para o elemento e é único para cada elemento diferente. Por exemplo, o número atómico para o hidrogénio é 1. Nenhum outro elemento tem um número atómico de 1. Para o carbono, o número atómico é 6 e, mais uma vez, nenhum outro elemento tem um número atómico de 6. O significado do número atómico é que nos diz o número de prótons no núcleo de cada elemento. Portanto, todos os átomos de hidrogênio têm 1 próton e todos os átomos de carbono têm 6 prótons. Além disso, como os átomos têm uma carga neutra, o número atómico também nos diz o número de electrões no átomo. Na notação química, o número atómico de um elemento é expresso como um subscrito que precede o símbolo do elemento. Por exemplo, o carbono seria expresso como 6C.
Número de massa (massa atómica)
O número de massa de um átomo, como o nome indica, diz a massa total do átomo. Como a massa de um elétron é extremamente pequena (insignificante), não é usada no cálculo do número de massa. Lembre-se também que a massa de cada próton e de cada nêutron é 1 unidade de massa atômica. Portanto, o número de massa é a soma dos prótons e nêutrons no átomo. Como o número de massa é o número de prótons mais o número de nêutrons e o número atômico é o número de prótons, você pode encontrar o número de nêutrons simplesmente subtraindo o número atômico do número de massa. Como exemplo, suponha que temos um elemento com um número atómico de 8 e um número de massa de 17. A partir desta informação pode-se deduzir que este elemento tem 8 prótons, 8 elétrons e 9 nêutrons (17-8=9). Agora deixe-me atirar-lhe uma bola curva. Como mencionado acima, todos os átomos de um dado elemento têm o mesmo número de prótons (número atômico), entretanto, átomos diferentes de um dado elemento podem ter números diferentes de nêutrons. Nós dizemos que estes são isótopos diferentes do elemento. Por exemplo, existem três isótopos de hidrogênio. O isótopo mais comum compreendendo 99,98% de todos os átomos de hidrogênio tem um número de massa de 1, portanto é composto de 1 próton, sem nêutrons e um elétron. Os outros isótopos menos abundantes de hidrogênio têm números de massa de 2 e 3, respectivamente. Estes isótopos diferem no número de neutrões nos seus núcleos, mas todos os três têm um protão e um electrão. Na realidade existem isótopos de cada elemento que ocorrem naturalmente, cada um com o seu número de massa único. Na notação química, o número de massa de um determinado isótopo é expresso como um superescrito que precede o símbolo do elemento. Os três isótopos para hidrogênio seriam expressos como 1H, 2H, e 3H. Como cada elemento é composto de vários isótopos, uma questão que se coloca é “qual é a massa real de um dado elemento? Novamente, se você olhar para a tabela periódica acima, você notará um número na parte inferior de cada caixa. Este é o peso atómico para o elemento. Por exemplo, o peso atómico para o hidrogénio é 1.00794 amu. Este número foi obtido através do cálculo da massa média dos 3 isótopos de hidrogênio. Por exemplo, suponhamos que tínhamos 10 rapazes na nossa classe. Se quiséssemos saber o peso médio dos rapazes, somaríamos os seus pesos individuais e depois dividiríamos o total por 10. Isto dar-nos-ia o peso médio deles. Isto é essencialmente como os pesos atómicos são determinados. Como 1H é o isótopo mais abundante de hidrogênio, faz sentido que o peso atômico para hidrogênio seja muito próximo da massa atômica de 1H.
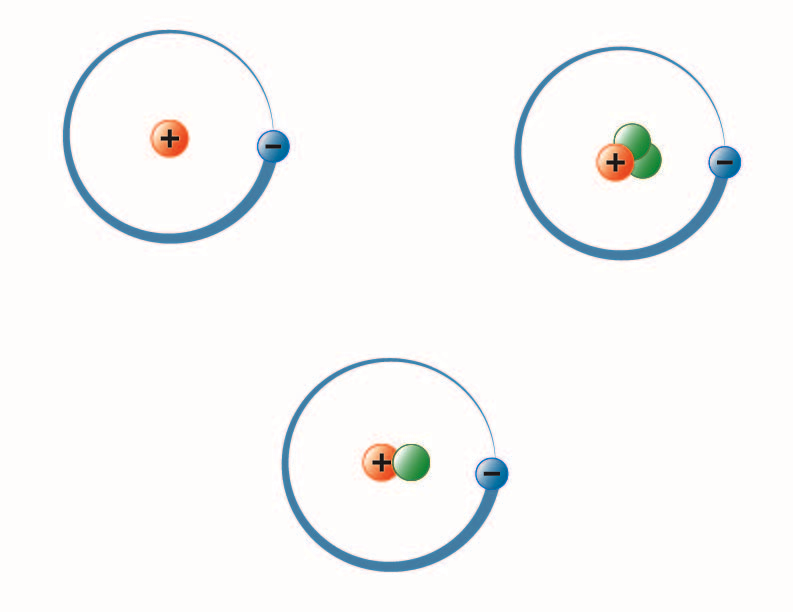
imagem criada pela estudante BYU-I Hannah Crowder Fall 2013
A imagem acima representa os três isótopos de hidrogênio. O mais comum (canto superior esquerdo) tem um próton e nenhum nêutron no núcleo. Deutério (inferior) tem um próton e um nêutron e Trítio (superior direito) tem um próton e dois nêutrons.
**Você pode usar os botões abaixo para ir para a próxima leitura ou para a anterior neste Módulo***

