Figure 1. Caminho de sinalização de portagens
O que é um receptor de portagens?
>
Receptores semelhantes a toll-like (TLRs) são uma classe de proteínas que desempenham um papel fundamental na imunidade inata. São receptores trans-membranas de domínio único que pertencem a receptores de reconhecimento de padrões (PRRs) que geralmente são expressos em células sentinela, como as células dendríticas de macrófagos e muitas outras células não-imunes, como fibroblastos e células epiteliais. Eles reconhecem moléculas estruturalmente conservadas derivadas de micróbios que são chamadas padrões moleculares associados a patógenos (PAMPs) ou moléculas auto-derivadas derivadas de células danificadas, referidas como padrões de moléculas associadas a danos (DAMPs). PAMPs incluem vários componentes da parede celular bacteriana como lipopolissacarídeo (LPS), peptidoglicano (PGN) e lipopeptídeos, assim como flagelina, DNA bacteriano e RNA viral de dupla cadeia. Os DAMPs incluem proteínas intracelulares como as proteínas de choque térmico, bem como fragmentos de proteínas da matriz extracelular. Os PRRs ativam vias de sinalização a jusante que levam à indução de respostas imunes inatas, produzindo citocinas inflamatórias, interferon tipo I (IFN), e outros mediadores. Estes processos não só despoletam respostas defensivas imediatas do hospedeiro, tais como inflamação, mas também respostas imunitárias adaptativas específicas do antígeno principal e do orquestrado. Estas respostas são essenciais para a eliminação de micróbios infectantes bem como cruciais para a consequente instrução de respostas imunitárias adaptativas específicas de antigénios.
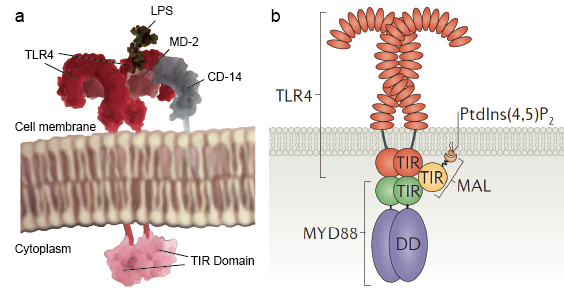
Figure 2. O diagrama esquemático da estrutura molecular das TLRs.
>
Família receptora tipo TLR
A família TLR compreende 10 membros (TLR1-TLR10) em humano e 12 (TLR1-TLR9, TLR11-TLR13) em rato. Os TLRs localizam-se na superfície celular ou em compartimentos intracelulares como o ER, endossoma e lisossoma. Os TLRs da superfície celular incluem TLR1, TLR2, TLR4, TLR5, TLR6 e TLR10, enquanto os TLRs intracelulares estão localizados no endossomo e incluem TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 e TLR13 (Figura 1). Os TLRs de superfície celular reconhecem principalmente componentes da membrana microbiana, como lipídios, lipoproteínas e proteínas. As TLRs intracelulares reconhecem ácidos nucleicos derivados de bactérias e vírus, e também reconhecem ácidos auto-nucleicos em condições de doença como auto-imunidade.
A função do receptor tipo Toll-like geralmente baseado em um processo de dimerização de duas moléculas de TLR, mas nem sempre. Por exemplo, TLR-1 e TLR-2 ligam-se um ao outro para formar um dimmer quando reconhecem moléculas PAMPs principalmente incluindo lipoproteínas, peptidoglicanos, ácidos lipotecóicos (LTA, Gram-), zymosan, mannan, e tGPI-mucin. TLR-2 também pode formar um dimmer com TLR-6 quando eles reconhecem os mesmos PAMPs listados acima. O TLR-4 pode reconhecer lipopolissacarídeo (LPS, Gram+) e formar um homodímero com outra molécula de TLR-4. TLR-5 pode reconhecer flagelina bacteriana, mas eles não formam um dimmer. O TLR-11 é funcional em ratos e reconhece principalmente bactérias uropatogênicas. TLR-3, 7, 8, 9, 13 são expressos na superfície do endossoma no citoplasma. TLR3 reconhece RNA viral de cadeia dupla (dsRNA), pequenos RNAs interferentes e auto-RNAs derivados de células danificadas. O TLR-7 é predominantemente expresso em DCs plasmocitóides (pDCs) e reconhece RNA de corda única (ss) a partir de vírus. Também reconhece o RNA de bactérias estreptococos B em CD convencionais (cDCs). O TLR8 responde ao RNA viral e bacteriano. O TLR-9 reconhece o DNA bacteriano e viral que é rico em motivos CpG-DNA não metilados. O TLR13 reconhece o rNA 23S bacteriano e componentes desconhecidos do vírus da estomatite vesicular.
Embora existam tantos tipos de moléculas de TLR que reconhecem uma vasta gama de ligandos, todos estes TLR partilham uma estrutura estrutural comum nos seus domínios extracelulares, ligando os ligandos. Todos estes domínios adotam estruturas em forma de ferradura construídas a partir de motivos de repetição ricos em leucina. Tipicamente, na ligação ligante, dois domínios extracelulares formam um sanduíche de dímeros em forma de ”m”-dímeros em forma de “m”, que trazem os domínios transmembrana e citoplasmática em estreita proximidade e desencadeando uma cascata de sinalização a jusante (Figura 2).
Percurso de sinalização do receptor em forma de “m”
1. Cascata de sinalização do receptor semelhante a uma portagem
Receptores semelhantes a uma portagem permitem às células sentinela, tais como macrófagos, detectar micróbios através de PAMPs, tais como LPS. O LPS é um componente da parede celular bacteriana. O mecanismo de reconhecimento de lipopolissacarídeos pelos receptores tipo Toll- é complexo e requer várias proteínas acessórias. Uma proteína sérica, a proteína de ligação LPS, liga monômeros LPS e a transfere para uma proteína chamada CD14. A CD14 pode ser solúvel ou ligar-se à superfície celular através de uma âncora de glicosilfosfatidilinositol. O CD 14 entrega e carrega o LPS para o domínio extracelular de receptores tipo Toll-. Os TLRs são capazes de detectar o LPS com a ajuda de uma proteína acessória chamada MD-2. Em seguida, a homodimerização dos TLRs é induzida quando o LPS se liga ao complexo de TLR-CD14-MD2. A mudança conformacional dos domínios extracelulares inicia a dimerização do domínio do receptor IL-1 do citoplasma (TIR). A mudança conformacional TIR fornece um novo andaime que permite o recrutamento de proteínas adaptadoras para formar um complexo de sinalização pós receptor. O TIR contendo um adaptador proteína mielóide de diferenciação primária 88 (MyD88).
MyD88 funciona como um adaptador ligando TLRs/IL-1Rs com moléculas de sinalização a jusante que têm DDs. Ele reconhece a mudança conformacional no domínio TIR dos TLRs, liga-se ao novo complexo receptor e transfere a sinalização por interação de amino (N)-terminal death domain (DD) com kinases associadas ao IL-1R (IRAKs). Isto resulta numa cascata complexa com inventos de sinalização que avisa a célula da invasão de patógenos. Existem 4 IRAKs (IRAK 1, 2, 4, M). Eles contêm um DD N-terminal e um domínio central sereno/teronino-quinase. IRAK1 e IRAK4 têm atividade cinase intrínseca, enquanto IRAK2 e IRAK-M não têm atividade cinase detectável. O IRAK4 é ativado pelo MyD88 e continua a ativar o IRAK1. Em seguida, o IRAK1 activa o TRAF6 a jusante. O TRAF6 é um membro da família de receptores do fator de necrose tumoral (TNFR) associado ao fator TRAF, que medeia as vias de sinalização das citocinas. Após a estimulação, o TRAF6 é recrutado para o complexo receptor e ativado pelo IRAK-1 que se liga ao domínio TRAF do TRAF6. Em seguida, o complexo IRAK-1/TRAF6 dissocia-se do receptor e associa-se à quinase 1 (TAK1) e às proteínas de ligação TAK1, TAB1 e TAB2 activadas pelo TGF. O complexo TRAF6, TAK1, TAB1 e TAB2 move-se para o citoplasma, onde forma um grande complexo com outras proteínas, tais como as ligases E2 Ubc13 e Uev1A. O complexo Ubc13 e Uev1A demonstrou catalisar a síntese de uma cadeia de poliubiquitina ligada a Lys 63 do TRAF6 e assim induzir a ativação do TAK1 e finalmente do NF-kB mediada pelo TRAF6. Esta via de sinal descrita acima é chamada via dependente de MyD88, uma vez que o sinal está começando a partir da molécula MyD88. Há também outro caminho chamado MyD88-independedt pathway, cuja sinalização não começa em MyD88. Em vez disso, o sinal começa a partir da proteína TRIF. O TRIF interage com TRAF6 e TRAF3.TRAF6 recruta a kinase RIP-1, que por sua vez interage e ativa o complexo TAK1, levando à ativação de NF-kB e MAPKs e à indução de citocinas inflamatórias. Em contraste, o TRAF3 recruta as kinasesTBK1 e IKKi relacionadas com o IKK, juntamente com o NEMO para a fosforilação e ativação do IRF3. O IRF3 forma um dímero e transloca para o núcleo a partir do citoplasma, induz a expressão do tipo I IFN.
2. Sinalização a jusante
TLRs sinalizam na verdade principalmente através do recrutamento de moléculas adaptadoras específicas, levando à ativação dos fatores de transcrição NF-kB e IRFs, que ditam o resultado das respostas imunes inatas. Assim, este caminho de sinalização a jusante é activar o factor de transcrição IRFs, o caminho de sinalização NF-kB e o caminho de MAKP. Você pode encontrar mais informações detalhadas sobre o caminho de sinalização NF-kB e MAKP em:
NF-kB, caminho de sinalização P38 e caminho de sinalização MAKP.
3. Regulação da via
De causar alguma regulação negativa por várias moléculas através de vários mecanismos para prevenir ou terminar as respostas imunológicas excessivas que levam a consequências prejudiciais associadas com a auto-imunidade e doenças inflamatórias. A activação da via dependente de MyD88 é suprimida por ST2825, SOCS1, e Cbl-b, e a activação da via dependente de TRIF é suprimida por SARM e TAG. Estas moléculas associam-se com MyD88 ou TRIF para evitar que elas se liguem a TLRs ou moléculas a jusante. A activação do TRAF3 é regulada negativamente por SOCS3 e DUBA. TRAF6 é alvo de várias moléculas inibitórias, como A20, USP4, CYLD, TANK, TRIM38 e SHP. A ativação do TAK1 é inibida pelo TRIM30a e A20.
4. Relação com doenças
Como o TLR está envolvido na detecção do LPS e pode ter um papel na sepse, a focalização do TLR é importante para o tratamento de várias doenças. Além de interferir nas respostas de TLR para tratar infecções patogênicas, uma aplicação clínica óbvia do conhecimento adquirido com os estudos de TLR foi a utilização de ligandos de TLR como adjuvantes de vacinas. Além disso, a inibição da TLR também foi tentada na clínica, cujo objetivo é limitar a inflamação excessiva que é presumivelmente causada pela ativação excessiva de uma determinada TLR.
| Takeda, Kiyoshi, e Shizuo Akira. “Caminhos de sinalização TLR.” Seminários em imunologia. Vol. 16. No. 1. Academic Press, 2004. | |
| Akira, Shizuo, e Kiyoshi Takeda. “Sinalização tipo receptor de portagem.” Nature reviews immunology 4.7 (2004): 499-511. | |
| Lim, Kian-Huat, e Louis M. Staudt. “Sinalização do receptor de pedágio”. Cold Spring Harbor perspectives in biology 5.1 (2013): a011247. | |
| andTaro Kawai, Takumi Kawasaki. “Caminhos de sinalização de portagens”. Pattern Recognition Receptors and Cancer 8916 (2015): 7. | |
| Gay, Nicholas J., et al. “Assembly and localization of Toll-like receptor signalling complexes.” Nature reviews Immunology 14.8 (2014): 546-558. | |
| O’Neill, Luke AJ, Douglas Golenbock, e Andrew G. Bowie. “A história dos receptores de Toll-like redefinindo a imunidade inata.” Nature Reviews Immunology 13.6 (2013): 453-460. | |
| Botos, Istvan, David M. Segal, e David R. Davies. “A biologia estrutural dos receptores de Toll-like”. Estrutura 19.4 (2011): 447-459. |