US Pharm. 2009;34(11):26-39.
A incerteza é alta quando se trata de selecionar o antidepressivo apropriado para pacientes diagnosticados com distúrbio depressivo maior (DMD), não só porque estudos não relataram diferenças na eficácia entre os agentes, mas também porque apenas 11% a 30% dos pacientes alcançarão remissão com o tratamento inicial, mesmo após um ano.1,2 Isto, consequentemente, levou os clínicos a praticarem de forma experimental e errónea o tratamento da depressão.3 Além disso, a última grande revisão do Manual de Diagnóstico e Estatística dos Transtornos Mentais (DSM-IV-TR) foi produzida em 2000.4 Em 2005, foi publicada uma diretriz para revisar importantes preocupações de segurança que tinham surgido sobre alguns agentes, como a nefazodona, bem como para revisar dois novos antidepressivos aprovados naquele ano, escitalopram e duloxetina.5 A revisão e atualização do DSM-IV-TR (manuscrito do DSM-V) só está prevista para maio de 2012. Portanto, há necessidade de uma revisão atualizada para ajudar os clínicos a decidir sobre os agentes adequados para tratar pacientes individuais.
O estudo STAR*D (2007 Sequenced Treatment Alternatives to Relieve Depression) tentou desenvolver e avaliar estratégias de tratamento viáveis para melhorar os resultados clínicos de pacientes com depressão resistente ao tratamento que foram identificados com um episódio depressivo importante atual.6 Especificamente, o STAR*D teve como objetivo determinar qual dos vários tratamentos é o “próximo passo” mais eficaz para pacientes que não alcançam remissão com um tratamento inicial ou subsequente ou que não podem tolerar o tratamento. Os resultados gerais deste estudo demonstraram que as diferenças farmacológicas entre os medicamentos psicotrópicos não se traduziram em diferenças clínicas substanciais, embora a tolerabilidade tenha sido diferente.6
O objetivo deste artigo é rever as evidências de tratamento disponíveis na literatura, a fim de fornecer uma referência rápida que ajude os clínicos a decidir sobre o agente apropriado, levando em consideração os efeitos adversos, as interações medicamentosas e a segurança do medicamento, bem como as características do paciente.
O que é depressão?
Depressão pode ser um distúrbio mental crônico ou recorrente que apresenta vários sintomas como humor depressivo, perda de interesse ou prazer, sentimentos de culpa, sono ou apetite perturbado, baixa energia e dificuldade de pensar.7 A depressão pode levar a um comprometimento substancial da capacidade de um indivíduo de cuidar das responsabilidades diárias. A depressão também pode levar ao suicídio, uma tragédia responsável pela perda de cerca de 850.000 vidas no mundo todo a cada ano.7
Populações em prevalência e em risco
Existem cerca de 121 milhões de pessoas em todo o mundo afetadas pela depressão.7 Em 2000, a depressão foi o quarto maior contribuinte para a carga global de doenças entre todas as doenças, e em 2020 prevê-se que ela subirá para o segundo maior contribuinte para a carga global de doenças, atrás apenas das doenças cardíacas.7
Populações com maior risco de desenvolver depressão incluem mulheres, pessoas entre 24 e 45 anos de idade, e aqueles com parentes de primeiro grau com depressão. As mulheres correm maior risco de depressão até os 50 anos de idade, e seu risco de vida é duas vezes maior que o dos homens. Pessoas entre 24 e 45 anos de idade apresentam a maior taxa de depressão. Finalmente, parentes de primeiro grau de pacientes deprimidos são 1,5 a 3 vezes mais propensos a experimentar depressão do que outros.4,8
Patofisiologia e Farmacoterapia Rationale
Causas biológicas e psicossociais têm sido hipotéticas na tentativa de descrever a patofisiologia da depressão. Os agentes farmacológicos terão como alvo as causas biológicas ligadas à desregulação dos neurotransmissores. Esta desregulação é frequentemente descrita como uma deficiência nos níveis dos neurotransmissores cerebrais. Os níveis de norepinefrina, serotonina e dopamina podem ser reduzidos em pacientes com depressão, associando assim uma quantidade reduzida de neurotransmissores com o distúrbio.8 A lógica da farmacoterapia tem sido aumentar essas deficiências, bloqueando a recaptação ou prevenindo o metabolismo enzimático dos neurotransmissores através de antidepressivos. Em geral, estes mecanismos visam aumentar o nível de neurotransmissores, forçando o neurônio a disparar mais frequentemente e produzir mais neurotransmissores ou prevenindo a degradação do próprio neurotransmissor.
Agentes farmacológicos
As classes de agenteseveracionais estão atualmente disponíveis para tratar a depressão. Eles incluem inibidores seletivos da recaptação de serotonina (IRSS), antidepressivos tricíclicos (TCAs), inibidores da monoamina oxidase (IMAO), e inibidores da recaptação de serotonina-norepinefrina (IRSN), entre outros.
Antidepressivos têm sido associados a um risco aumentado de pensamento suicida e suicídio em crianças, adolescentes e adultos jovens em estudos de curta duração controlados por placebo de MDD. Qualquer pessoa que considere o uso de qualquer antidepressivo em uma criança, adolescente ou adulto jovem deve equilibrar esse risco com a necessidade clínica. Estudos de curto prazo não demonstraram um aumento no risco de suicídio com antidepressivos em comparação com placebo em adultos acima de 24 anos de idade, e houve uma redução no risco com antidepressivos em comparação com placebo em adultos com 65 anos de idade ou mais. A depressão e outros distúrbios psiquiátricos estão eles próprios associados ao aumento do risco de suicídio. Pacientes de todas as idades que são iniciados na terapia antidepressiva devem ser monitorados apropriadamente e observados de perto para piora clínica, suicídio ou alterações incomuns no comportamento.9
Inibidores seletivos de recaptação de serotonina4,10: Os IRSS são considerados agentes de primeira linha quando se trata de tratar pacientes com depressão. Esses medicamentos incluem citalopram, escitalopram, fluoxetina, fluvoxamina, paroxetina e sertralina (TABELA 1). Os principais efeitos adversos desta classe incluem náuseas, vômitos e diarréia, que são efeitos dose-dependentes e tendem a se dissipar após as primeiras semanas de tratamento. Em alguns pacientes, os SSRIs podem causar agitação e distúrbios do sono, que também se dissiparão com o tempo. A disfunção sexual é um efeito secundário presente com todos os antidepressivos, mas parece ser mais comum com os SSRIs.
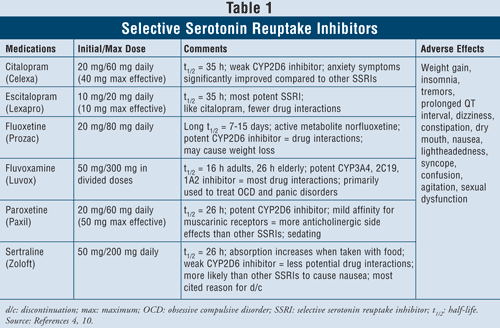
Serotonina (ou seja, dor abdominal, diarréia, sudorese, alteração do estado mental, insuficiência renal, choque cardiovascular e possivelmente morte) é um efeito adverso raro dos IRSS. A síndrome de serotonina pode ocorrer com um aumento na dose de SSRI ou tomando SSRIs com ervas como a erva de São João ou com drogas ilícitas. Finalmente, a combinação de SSRIs com MAOIs também pode levar a interações medicamentosas letais com o desenvolvimento da síndrome da serotonina. Quando os clínicos sentem a necessidade de mudar de uma classe de agentes para outra, sugere-se que pelo menos cinco meia-vidas passem entre o momento em que a IRSS é interrompida e o início da IMAO.4 De todos os agentes da classe, a mina de fluvoxa tem a maior taxa de interações medicamentosas, uma vez que inibe várias enzimas hepáticas como o CYP450 1A2, 2C19, 2C9, 2D6, e 3A4. A fluoxetina segue de perto a taxa de interação medicamentosa da fluvoxamina com a inibição do CYP 2C9, 2D6, e 3A4. Finalmente, o citalopram e o escitalopram têm as menores interações medicamentosas, uma vez que inibem as enzimas 2D6 em menor grau.
Ao considerar as características e segurança dos pacientes, os ISRS são seguros para uso na maioria dos grupos de pacientes, incluindo aqueles com doença cardíaca pré-existente, asma, demência e hipertensão. Os idosos, que são particularmente propensos à hipotensão ortostática, bem como à perda de peso, podem se beneficiar mais do uso de SSRIs, uma vez que esses agentes produzem ganho de peso e falta de atividade anticolinérgica.
Anticolíclicos antidepressivos4,10: Os TCAs bloqueiam a recaptação de norepinefrina e serotonina, mas também têm afinidade pelos receptores alfa1, H1 e muscarínicos, causando assim efeitos adversos anticolinérgicos. Há duas subclasses de agentes disponíveis dentro desta classe, os TCAs terciários e secundários de aminas (TABELA 2). Os TCAs de amina secundários (desipramina, maprotilina, nortriptilina) têm menos afinidade com os receptores alfa1, H1 e muscarínicos, causando assim menos efeitos adversos anticolinérgicos do que os TCAs de amina terciária (por exemplo, amitriptilina, amoxapina, clomipramina, doxepina, imipramina).
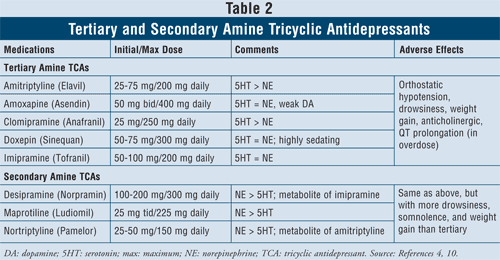
Os principais efeitos adversos desta classe de agentes são hipotensão ortostática, prolongamento do QT, sonolência, boca seca, visão turva, obstipação e ganho de peso. Em geral, os TCAs de amina terciária têm mais atividade de serotonina versus os TCAs de amina secundários, que têm mais atividade de norepinefrina, causando assim menos sonolência, sonolência e ganho de peso.
Sabe-se que os TCAs inibem as enzimas CYP 2C19 e 2D6.11 Eles também são metabolizados em menor grau pelas enzimas CYP 1A2 e 3A4.12 Por este motivo, embora as interações medicamentosas com estes agentes possam não ser a principal preocupação, é aconselhável ter cuidado ao combinar os TCAs com os SSRIs, uma vez que o nível plasmático dos TCAs tem o potencial de aumentar em até quatro vezes, possivelmente levando a efeitos tóxicos.13,14
Ao considerar as características e segurança do paciente, os TCAs estão contra-indicados em algumas condições cardíacas específicas, como pacientes com histórico de arritmias, disfunção dos nós sinusais ou defeitos de condução. É aconselhável ter cuidado com os idosos, pois eles são mais sensíveis ao bloqueio colinérgico, bem como à hipotensão ortostática. Além disso, os indivíduos que também sofrem de demência serão particularmente suscetíveis aos efeitos tóxicos do bloqueio muscarínico sobre a memória e a capacidade de atenção e geralmente fariam melhor se fossem administrados antidepressivos com o menor grau de efeitos anticolinérgicos. Finalmente, deve-se ter cuidado ao considerar iniciar TCAs em pacientes com pensamentos suicidas devido a altos riscos de letalidade com overdose. A dose letal é apenas oito vezes a dose terapêutica, portanto, se os TCAs forem ingeridos em uma overdose, eles podem bloquear o nó sinoatrial no coração.
Inibidores de monoaminoxidase4,10: As IMAO disponíveis incluem isocarboxazida, fenelzina, selegilina e tranilcipromina (TABELA 3). Além da selegilina, que é um inibidor seletivo da MAO B, todos os outros agentes inibem tanto a MAO A quanto as enzimas B responsáveis pela serotonina, norepinefrina e o metabolismo da dopamina no cérebro. Devido aos graves efeitos adversos e restrições dietéticas requeridas, as IMAO são geralmente reservadas para pacientes que falharam com outros antidepressivos.
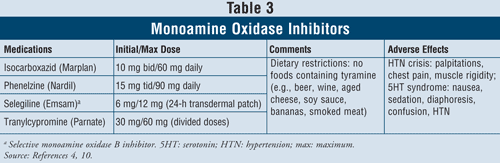
Crise tiptensiva pode ocorrer quando pacientes que tomam IMAO ingerem alimentos contendo tiramina, como cerveja, vinho, queijo envelhecido, e carne fumada. Esta reacção apresenta-se como um início agudo de dor de cabeça grave, náuseas, rigidez do pescoço, palpitações cardíacas, dores no peito e confusão. A IMAO também pode causar a síndrome da serotonina. Como mencionado anteriormente, esta síndrome ocorre mais comumente quando as IMAO são tomadas concomitantemente com outros agentes serotonérgicos como a SSRIs ou se a venlafaxina, uma SNRI, é administrada logo após uma IMAO. Quando os pacientes são trocados de uma IRSS com meia-vida curta para uma IMAO, é importante que seja respeitado um período de 2 semanas de washout entre a descontinuação da IRSS e o início da IMAO. Se a fluoxetina for a IESS, que tem uma meia-vida longa, o período de washout deve ser de 5 semanas.4 Outros efeitos adversos podem ocorrer com a IMAO, tais como hipotensão ortostática, ganho de peso, disfunção sexual e insônia.
Devido à alta taxa de interações medicamentosas com estes agentes, deve-se ter cuidado quando prescrito a pacientes com asma usando broncodilatadores simpaticomiméticos. Em pacientes com hipertensão, as IMAO podem induzir hipotensão ortostática, especialmente com tratamentos diuréticos simultâneos.
Serotonina-Norepinefrina Inibidores de Reabsorção4,10: Os SNRIs como desvenlafaxina, duloxetina e venlafaxina também podem ser usados como agentes de primeira linha (TABELA 4). Esses medicamentos são mais seguros que os TCAs, e seus efeitos adversos são semelhantes aos dos SSRIs, incluindo náuseas, vômitos e disfunção sexual, bem como pressão sanguínea elevada.
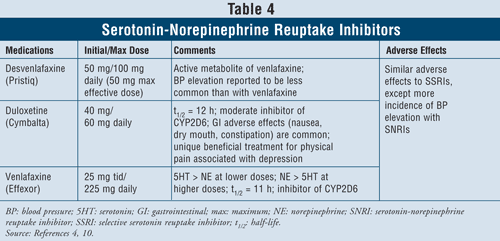
Venlafaxina tem demonstrado causar aumento da pressão arterial em 3% a 13% dos casos, enquanto desvenlafaxina foi relatada como causadora de aumento da pressão arterial em apenas 1% a 2% dos casos.10 Assim, recomenda-se evitar o uso de venlafaxina em pacientes com hipertensão descontrolada, uma vez que o agente pode exacerbar a condição. A Duloxetina tem mais atividade norepinefrina do que os dois agentes acima mencionados, sendo assim útil com sintomas físicos como dores musculares, dores de cabeça, problemas estomacais e dor generalizada, muitas vezes ocorrendo com pacientes gravemente deprimidos. Devido à sua eficácia nos sintomas da dor, a duloxetina também tem sido aprovada para outras indicações como fibromialgia e dor neuropática periférica diabética.15 Finalmente, todos os três agentes têm mais atividade de serotonina que norepinefrina em doses menores e mais norepinefrina que serotonina em doses maiores, tendo assim efeitos adversos dependentes da dose.
Outros Antidepressivos4,10: Existem vários outros antidepressivos que diferem no seu mecanismo de acção das classes de medicamentos descritos anteriormente.
>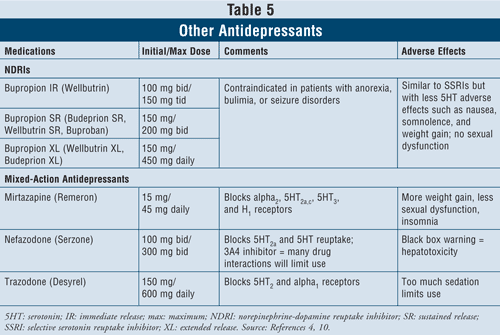
Os inibidores de recaptação da norepinefrina (NDRIs) como o Wellbutrin de libertação imediata (IR) da marca bupropion (também disponível em formas de dosagem de acção prolongada como Wellbutrin XL, Wellbutrin SR, Budeprion SR, Budeprion XL e Buproban) podem ser usados como agentes de primeira linha para tratar a depressão (TABELA 5). Seus efeitos adversos são similares aos dos SSRIs, com efeitos mínimos de serotonina como náuseas e ganho de peso e pouca ou nenhuma disfunção sexual. Bupropiona tem mostrado efeitos benéficos nos sintomas da doença de Parkinson em alguns pacientes, mas também pode induzir alguns sintomas psicóticos, talvez por causa de sua ação agonística no sistema dopaminérgico.16
Finalmente, há mais três antidepressivos com ação mista disponíveis: mirtazapina, nefazodona e trazodona (TABELA 5). Todos os três agentes bloqueiam diferentes receptores de serotonina, tendo assim efeitos distintos. A mirtazapina causa mais ganho de peso ao aumentar o apetite. A nefazodona tem usos limitados devido à hepatotoxicidade e à inibição da enzima CYP3A4, o que leva a interações medicamentosas. A trazodona bloqueia os receptores de serotonina em grande medida, com fraca ligação aos receptores muscarínicos. Podem ocorrer efeitos adversos, como sedação, dor de cabeça, perda de memória, boca seca e prisão de ventre. Cuidado também é aconselhado com o uso de tracodona nos homens devido ao risco de priapismo.
Conclusão
Em geral, os medicamentos antidepressivos têm demonstrado ser igualmente eficazes; Portanto, a escolha do medicamento deve ser baseada em efeitos adversos, interações medicamentosas, segurança e preferências do paciente. Vários algoritmos estão disponíveis para orientar o clínico durante o tratamento do paciente, particularmente o algoritmo recentemente atualizado do Departamento de Serviços de Saúde do Texas para o tratamento de MDD (atualizado em julho de 2008).17 Se os pacientes apresentarem resposta parcial, os clínicos podem optar por aumentar a dose, mudar para um agente alternativo, ou dar uma combinação de antidepressivos. Pelo contrário, se os pacientes não responderem ou não puderem tolerar o medicamento, a mudança para um agente alternativo também é apropriada, levando em consideração que os efeitos terapêuticos geralmente ocorrem entre 4 a 6 semanas, mesmo que os efeitos adversos possam aparecer após 1 semana de tratamento.4,17 Além disso, enquanto os efeitos adversos aparecem no início do tratamento, eles geralmente se dissipam após 2 a 3 semanas.4,17 No entanto, o antidepressivo que mais provavelmente garantirá a melhoria e segurança do paciente pode ser determinado, pelo menos parcialmente, por tentativa e erro. Dada a dificuldade em prever qual medicação será simultaneamente eficaz e tolerada por um paciente individual, a familiaridade com um amplo espectro de antidepressivos é prudente e útil.
1. Song F, Freemantle N, Sheldon TA, et al. Inibidores seletivos de recaptação de serotonina: meta-análise da eficácia e aceitabilidade. BMJ. 1993;306:683-687.
2. Geddes JR, Freemantle N, Mason J, et al. SSRIs versus outros antidepressivos para distúrbios depressivos. Cochrane Database Syst Rev. 2000;(2):CD001851.
3. Rush AJ, Wisniewski SR, Warden D, et al. Selecionando entre as monoterapias de medicação antidepressiva de segundo passo: valor preditivo das características clínicas, demográficas, ou de tratamento de primeiro passo. Psiquiatria Arch Gen. 2008;65:870-881.
4. Associação Psiquiátrica Americana. Manual de Diagnóstico e Estatística dos Transtornos Mentais, Quarta Edição, Revisão de Texto (DSM-IV-TR). Washington, DC: Associação Psiquiátrica Americana; 2000.
5. Grupo de Trabalho sobre Transtorno Depressivo Maior. Guideline Watch: Diretrizes Práticas para o Tratamento de Pacientes com Transtorno Depressivo Grave. 2ª ed. Washington, DC: Associação Psiquiátrica Americana; 2005.
6. Cain RA. Navigating the Sequenced Treatment Alternatives to Relieve Depression (STAR*D) study: practical outcomes and implications for depression treatment in primary care. Prática da Clínica de Cuidados Primários. 2007;34:505-519.
7. Depression. Organização Mundial da Saúde. www.who.int/mental_health/management/depression/definition/en. Acesso 5 de outubro de 2009.
8. Dipiro JT, Talbert RL, Yee GC, et al. Farmacoterapia: A Pathophysiologic Approach. 6ª ed. Nova York, NY: McGraw-Hill; 2005.
9. Revisões para rotulagem de produtos. Suicidalidade e medicamentos antidepressivos. FDA. www.fda.gov/downloads/Drugs/DrugSafety/InformationbyDrugClass/UCM173233.pdf. Acesso em 5 de outubro de 2009.
10. Informação sobre medicamentos. Micromedex Healthcare Series. Greenwood Village, CO: Thomson Micromedex. www.micromedex.com. Acesso em 5 de outubro de 2009.
11. Shin J-G, Park J-Y, Kim M-J, et al. Efeitos inibidores dos antidepressivos tricíclicos sobre o citocromo humano P450 enzimas in vitro: mecanismo de interação medicamentosa entre TCAs e fenitoína. Eliminação do Metab. 2002;30:1102-1107.
12. CH. castanho. Overview of drug-drug interactions with SSRIs. US Pharm. 2008;33(1):HS3-HS19.
13. Spina E, Scordo MG, D’Arrigo C. Interações de drogas metabólicas com novos agentes psicotrópicos. Fundam Clin Pharmacol. 2003;17:517-538.
14. Bergstrom RF, Peyton AL, Lemberger L. Quantificação e mecanismo da interação fluoxetina e antidepressiva tricíclica. Clin Pharmacol Ther. 1992;51:239-248.
15. Inserção da embalagem de Cymbalta (cloridrato de duloxetina). Indianapolis, IN: Eli Lilly and Company; Fevereiro de 2009. http://pi.lilly.com/us/cymbalta-pi.pdf. Acesso em 5 de outubro de 2009.
16. Goetz CG, Tanner CM, Klawans HL. Bupropiona na doença de Parkinson. Neurologia. 1984;34:1092-1094.
17. Suehs B, Argo TR, Bendele SD, et al. Texas Medication Algorithm Project Procedural Manual de Procedimentos do Projeto. Major Depressive Disorder Algorithms. Texas Department of State Health Services; Julho de 2008. www.dshs.state.tx.us/mhprograms/pdf/TIMA_MDD_Manual_080608.pdf. Acessado em 5 de outubro de 2009.
Para comentar este artigo, contate [email protected].