Partículas subatómicas
Todos los elementos están compuestos por partículas de materia extremadamente pequeñas llamadas átomos. Podemos definir un átomo como la partícula más simple de un elemento que tiene las propiedades químicas de ese elemento. Las propiedades químicas incluyen el estado físico del elemento (gas, líquido o sólido), los tipos de enlaces que el elemento puede formar, cómo reacciona con otros elementos, etc. Por lo tanto, todos los átomos que componen el elemento carbono tienen las mismas propiedades químicas.
Los físicos han conseguido dividir los átomos en docenas de partículas subatómicas diferentes, sin embargo, sólo 3 de ellas son estables. Son los protones, los neutrones y los electrones. Los protones son partículas con carga positiva, tienen masa y se encuentran en el centro o núcleo del átomo. Los neutrones no tienen carga, tienen masa y también se encuentran en el núcleo del átomo. Los neutrones se unen a los protones de forma que ayudan a estabilizar el núcleo. Un número excesivo o insuficiente de neutrones puede dar lugar a un núcleo atómico inestable que puede decaer y formar otros elementos. Se dice que estos átomos son radiactivos. Aunque la masa del neutrón es ligeramente mayor que la del protón, podemos asignar a ambos la masa relativa de 1 (1 unidad de masa atómica o amu). Los neutrones y los protones constituyen casi toda la masa de un átomo. El tercer tipo de partícula estable es el electrón. Los electrones tienen carga negativa pero son extremadamente pequeños y tienen una masa de sólo 1/1850 de la de un protón o un neutrón. Son tan pequeños que, a efectos prácticos, no contribuyen a la masa del átomo. Los electrones se mueven alrededor del núcleo a velocidades tremendamente altas, llegando a viajar casi a la velocidad de la luz. Aunque a menudo describimos los electrones como si residieran en órbitas que rodean el núcleo, como los planetas que orbitan alrededor del sol, la física moderna nos enseña que este modelo es incorrecto. Estos «orbitales» son en realidad áreas en el espacio alrededor del núcleo donde los electrones se encuentran la mayor parte del tiempo. Esta zona suele denominarse «nube» de electrones. Es cierto que sigue siendo un área específica, pero es un poco más amorfa que un orbital esférico. Sin embargo, para simplificar, solemos pensar en ellas como orbitales circulares tipo satélite. La imagen siguiente representa nuestro modelo actual de un átomo de nitrógeno.
El núcleo de nitrógeno contiene 7 protones (naranja) y 7 neutrones (verde). Las áreas sombreadas alrededor del núcleo representan los orbitales de los electrones (nubes). Los electrones (azul) se encuentran en algún lugar de estos orbitales. (Nota: la imagen no está dibujada a escala. Se ha sugerido que si el núcleo fuera del tamaño de una pelota de baloncesto los electrones estarían a unos seis kilómetros o 3¾ millas de distancia!)
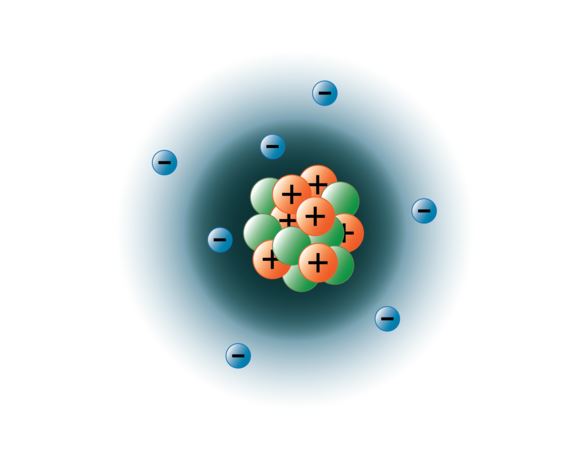
imagen creada por la estudiante de la BYU-I Hannah Crowder Otoño 2013
Número atómico
Vuelve a mirar la tabla periódica y fíjate en el número que aparece en la parte superior de cada caja. Este número es el número atómico del elemento y es único para cada elemento. Por ejemplo, el número atómico del hidrógeno es 1. Ningún otro elemento tiene un número atómico de 1. Para el carbono, el número atómico es 6 y, de nuevo, ningún otro elemento tiene un número atómico de 6. El significado del número atómico es que nos indica el número de protones en el núcleo de cada elemento. Por lo tanto, todos los átomos de hidrógeno tienen 1 protón y todos los átomos de carbono tienen 6 protones. Además, como los átomos tienen una carga neutra, el número atómico también nos indica el número de electrones del átomo. En la notación química, el número atómico de un elemento se expresa como un subíndice que precede al símbolo del elemento. Por ejemplo, el carbono se expresaría como 6C.
Número de masa (masa atómica)
El número de masa de un átomo, como su nombre indica, indica la masa total del átomo. Dado que la masa de un electrón es extremadamente pequeña (insignificante) no se utiliza en el cálculo del número de masa. Además, hay que recordar que la masa de cada protón y de cada neutrón es de 1 unidad de masa atómica. Por tanto, el número másico es la suma de los protones y neutrones del átomo. Como el número de masa es el número de protones más el número de neutrones y el número atómico es el número de protones, se puede encontrar el número de neutrones simplemente restando el número atómico del número de masa. Como ejemplo, supongamos que tenemos un elemento con un número atómico de 8 y un número másico de 17. De esta información puedes deducir que este elemento tiene 8 protones, 8 electrones y 9 neutrones (17-8=9). Ahora déjame lanzarte una bola curva. Como se ha mencionado anteriormente, todos los átomos de un elemento determinado tienen el mismo número de protones (número atómico), sin embargo, diferentes átomos de un elemento determinado pueden tener diferentes números de neutrones. Decimos que se trata de diferentes isótopos del elemento. Por ejemplo, hay tres isótopos del hidrógeno. El isótopo más común, que comprende el 99,98% de todos los átomos de hidrógeno, tiene un número de masa de 1. Por tanto, está compuesto por 1 protón, ningún neutrón y un electrón. Los otros isótopos menos abundantes del hidrógeno tienen números de masa 2 y 3, respectivamente. Estos isótopos difieren en el número de neutrones en sus núcleos, pero los tres tienen un protón y un electrón. En realidad, hay isótopos naturales de cada elemento, cada uno de los cuales tiene su propio número másico. En la notación química, el número de masa de un isótopo determinado se expresa como un superíndice que precede al símbolo del elemento. Los tres isótopos del hidrógeno se expresarían como 1H, 2H y 3H. Dado que cada elemento se compone de varios isótopos una pregunta que surge es «¿cuál es la masa real de un elemento determinado?» De nuevo, si miras la tabla periódica de arriba notarás un número en la parte inferior de cada casilla. Es el peso atómico del elemento. Por ejemplo, el peso atómico del hidrógeno es 1,00794 amu. Este número se obtuvo calculando la masa media de los 3 isótopos del hidrógeno. Por ejemplo, supongamos que tenemos 10 chicos en nuestra clase. Si quisiéramos saber el peso medio de los chicos, sumaríamos sus pesos individuales y luego dividiríamos el total entre 10. Esto nos daría su peso medio. Esto nos daría su peso medio. Así es como se determinan los pesos atómicos. Dado que el 1H es el isótopo más abundante del hidrógeno, tiene sentido que el peso atómico para el hidrógeno esté muy cerca de la masa atómica del 1H.
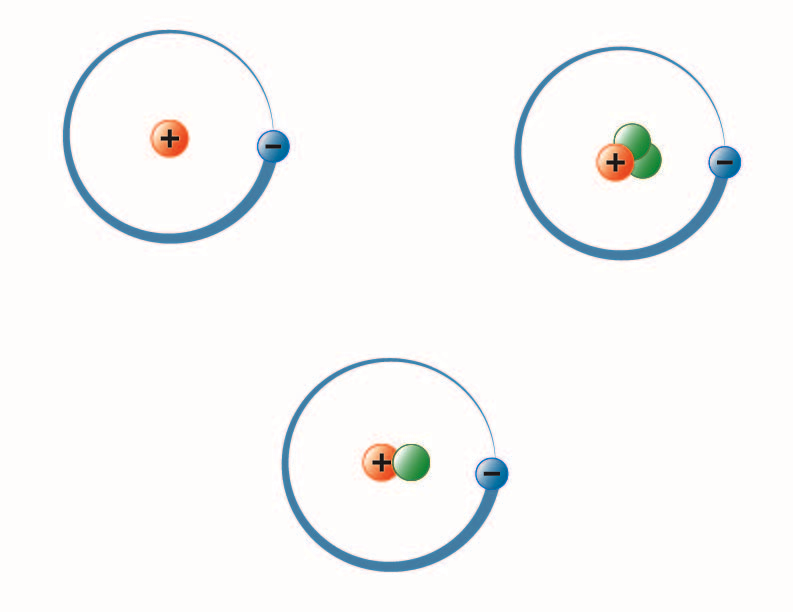
Imagen creada por la estudiante de la BYU-I Hannah Crowder Otoño 2013
La imagen de arriba representa los tres isótopos del hidrógeno. El más común (arriba a la izquierda) tiene un protón y ningún neutrón en el núcleo. El deuterio (abajo) tiene un protón y un neutrón y el tritio (arriba a la derecha) tiene un protón y dos neutrones.
**Puedes usar los botones de abajo para ir a la lectura siguiente o anterior de este Módulo**

