Figura 1. Vía de señalización del receptor Toll-like
¿Qué es el receptor Toll-like?
Los receptores tipo Toll (TLR) son una clase de proteínas que desempeñan un papel clave en la inmunidad innata. Son receptores transmembrana de dominio único que pertenecen a los receptores de reconocimiento de patrones (PRR) y que suelen expresarse en células centinelas como los macrófagos, las células dendríticas y muchas otras células no inmunes como los fibroblastos y las células epiteliales. Reconocen moléculas estructuralmente conservadas derivadas de microbios que se denominan patrones moleculares asociados a patógenos (PAMP) o moléculas derivadas de células dañadas, denominadas patrones moleculares asociados a daños (DAMP). Los PAMP incluyen varios componentes de la pared celular bacteriana, como el lipopolisacárido (LPS), el peptidoglicano (PGN) y los lipopéptidos, así como la flagelina, el ADN bacteriano y el ARN viral de doble cadena. Los DAMPs incluyen proteínas intracelulares como las proteínas de choque térmico, así como fragmentos de proteínas de la matriz extracelular. Los PRR activan vías de señalización descendentes que conducen a la inducción de respuestas inmunitarias innatas mediante la producción de citoquinas inflamatorias, interferón tipo I (IFN) y otros mediadores. Estos procesos no sólo desencadenan respuestas defensivas inmediatas del huésped, como la inflamación, sino que también preparan y orquestan respuestas inmunitarias adaptativas específicas a los antígenos. Estas respuestas son esenciales para la eliminación de los microbios infecciosos, así como cruciales para la consiguiente instrucción de respuestas inmunitarias adaptativas específicas de antígeno.
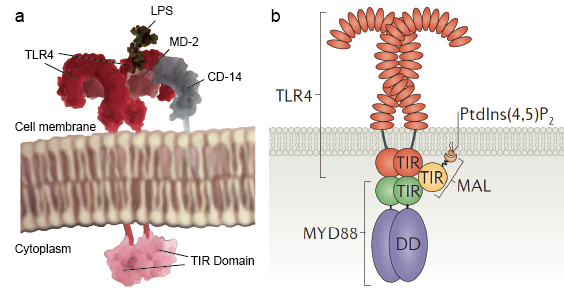
Figura 2. Diagrama esquemático de la estructura molecular de los TLRs.
Familia de receptores similares a los TLRs
La familia de los TLRs comprende 10 miembros (TLR1-TLR10) en humanos y 12 (TLR1-TLR9, TLR11-TLR13) en ratones. Los TLR se localizan en la superficie celular o en compartimentos intracelulares como el RE, el endosoma y el lisosoma. Los TLR de la superficie celular incluyen TLR1, TLR2, TLR4, TLR5, TLR6 y TLR10, mientras que los TLR intracelulares se localizan en el endosoma e incluyen TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 y TLR13 (Figura 1). Los TLR de la superficie celular reconocen principalmente componentes de la membrana microbiana como lípidos, lipoproteínas y proteínas. Los TLR intracelulares reconocen ácidos nucleicos derivados de bacterias y virus, y también reconocen ácidos autonucleicos en condiciones de enfermedad como la autoinmunidad.
La función del receptor tipo Toll suele basarse en un proceso de dimerización de dos moléculas TLR, pero no siempre. Por ejemplo, TLR-1 y TLR-2 se unirán entre sí para formar un dimerizado cuando reconozcan moléculas PAMPs que incluyen principalmente lipoproteínas, peptidoglicanos, ácidos lipotecoicos (LTA, Gram-), zimosán, manano y tGPI-mucina. TLR-2 también puede formar un atenuador con TLR-6 cuando reconocen los mismos PAMPs enumerados anteriormente. TLR-4 puede reconocer el lipopolisacárido (LPS, Gram+) y formar un homodímero con otra molécula TLR-4. TLR-5 puede reconocer la flagelina bacteriana, pero no forman un dímero. TLR-11 es funcional en ratones y reconoce principalmente a las bacterias uropatógenas. TLR-3, 7, 8, 9, 13 se expresan en la superficie del endosoma en el citoplasma. El TLR3 reconoce el ARN viral de doble cadena (dsRNA), los pequeños ARN de interferencia y los ARN propios derivados de células dañadas. El TLR-7 se expresa predominantemente en las DCs plasmocitoides (pDCs) y reconoce el ARN monocatenario (ss) de los virus. También reconoce el ARN de la bacteria streptococcus B en las DCs convencionales (cDCs). El TLR8 responde al ARN viral y bacteriano. El TLR-9 reconoce el ADN bacteriano y viral que es rico en motivos de CpG-ADN no metilados. TLR13 reconoce el ARNr 23S bacteriano y componentes desconocidos del virus de la estomatitis vesicular.
Aunque hay muchos tipos de moléculas TLR que reconocen una amplia gama de ligandos, todos estos TLR comparten un marco estructural común en sus dominios extracelulares de unión al ligando. Todos estos dominios adoptan estructuras en forma de herradura construidas a partir de motivos de repetición ricos en leucina. Normalmente, al unirse el ligando, dos dominios extracelulares forman un dímero en forma de »m» que intercala la molécula de ligando, acercando los dominios transmembrana y citoplásmico y desencadenando una cascada de señalización posterior (Figura 2).
Vía de señalización del receptor tipo Toll
1. Cascada de señalización de los receptores Toll-like
Los receptores Toll-like permiten a las células centinela, como los macrófagos, detectar microbios a través de PAMPs como el LPS. El LPS es un componente de la pared celular bacteriana. El mecanismo de reconocimiento del lipopolisacárido por los receptores Toll-like es complejo y requiere varias proteínas accesorias. Una proteína del suero, la proteína de unión al LPS, se une a los monómeros del LPS y los transfiere a una proteína llamada CD14. CD14 puede ser soluble o unirse a la superficie celular a través de un anclaje de glucosilfosfatidilinositol. CD 14 entrega y carga el LPS al dominio extracelular de los receptores tipo Toll. Los TLR son capaces de detectar el LPS con la ayuda de una proteína accesoria llamada MD-2. Entonces se induce la homodimerización de los TLR cuando el LPS se une al complejo de TLR-CD14-MD2. El cambio conformacional de los dominios extracelulares inicia la dimerización del dominio citoplasmático del receptor Toll IL-1 (TIR). El cambio conformacional del TIR proporciona un nuevo andamiaje que permite el reclutamiento de proteínas adaptadoras para formar un complejo de señalización post-receptor. El TIR contiene una proteína adaptadora, la proteína de respuesta primaria a la diferenciación mieloide 88 (MyD88).
MyD88 funciona como un adaptador que une los TLRs/IL-1Rs con las moléculas de señalización posteriores que tienen DDs. Reconoce el cambio conformacional en el dominio TIR de los TLRs, se une al nuevo complejo de receptores y transfiere la señalización mediante la interacción del dominio de muerte (DD) amino (N) terminal con las quinasas asociadas a IL-1R (IRAKs). Esto da lugar a una compleja cascada con inventos de señalización que advierten a la célula de la invasión de patógenos. Existen 4 IRAKs (IRAK 1, 2, 4, M). Contienen un DD N-terminal y un dominio central de serina/treonina-quinasa. IRAK1 e IRAK4 tienen actividad quinasa intrínseca, mientras que IRAK2 e IRAK-M no tienen actividad quinasa detectable. IRAK4 es activada por MyD88 y continúa activando a IRAK1. A continuación, IRAK1 activa la corriente descendente TRAF6. TRAF6 es un miembro de la familia del factor asociado al receptor del factor de necrosis tumoral (TNFR) que media en las vías de señalización de las citoquinas. Tras la estimulación, TRAF6 es reclutado al complejo del receptor y activado por IRAK-1 que se une al dominio TRAF de TRAF6. A continuación, el complejo IRAK-1/TRAF6 se disocia del receptor y se asocia con la quinasa 1 activada por TGF-beta (TAK1) y con las proteínas de unión a TAK1, TAB1 y TAB2. El complejo de TRAF6, TAK1, TAB1 y TAB2 se traslada al citoplasma, donde forma un gran complejo con otras proteínas, como las ligasas E2 Ubc13 y Uev1A. Se ha demostrado que el complejo Ubc13 y Uev1A cataliza la síntesis de una cadena de poliubiquitina ligada a Lys 63 de TRAF6 y, por tanto, induce la activación mediada por TRAF6 de TAK1 y, finalmente, de NF-kB. Esta vía de señalización descrita anteriormente se denomina vía dependiente de MyD88, ya que la señal parte de la molécula MyD88. También existe otra vía denominada vía independiente de MyD88, cuya señalización no parte de MyD88. En su lugar, la señal parte de la proteína TRIF. TRIF interactúa con TRAF6 y TRAF3.TRAF6 recluta a la quinasa RIP-1, que a su vez interactúa con el complejo TAK1 y lo activa, dando lugar a la activación de NF-kB y MAPKs y a la inducción de citoquinas inflamatorias. En cambio, TRAF3 recluta a las quinasas relacionadas con IKKTBK1 e IKKi junto con NEMO para la fosforilación y activación de IRF3. IRF3 forma un dímero y se transloca al núcleo desde el citoplasma, induciendo la expresión de IFN de tipo I.
2. Señalización descendente
Los TLRs señalan en realidad principalmente a través del reclutamiento de moléculas adaptadoras específicas, conduciendo a la activación de los factores de transcripción NF-kB e IRFs, que dictan el resultado de las respuestas inmunes innatas. Así que esta vía de señalización descendente es para activar el factor de transcripción IRFs, la vía de señalización NF-kB y la vía MAKP. Puede encontrar información más detallada sobre la vía NF-kB y MAKP en:
Vía de señalización NF-kB, vía de señalización P38 y vía de señalización MAKP.
3. Regulación de la vía
De hecho, existe cierta regulación negativa por parte de una serie de moléculas a través de varios mecanismos para prevenir o poner fin a las respuestas inmunitarias excesivas que conducen a consecuencias perjudiciales asociadas con la autoinmunidad y la enfermedad inflamatoria. La activación de la vía dependiente de MyD88 es suprimida por ST2825, SOCS1 y Cbl-b, y la activación de la vía dependiente de TRIF es suprimida por SARM y TAG. Estas moléculas se asocian con MyD88 o TRIF para evitar que se unan a los TLRs o a las moléculas posteriores. La activación de TRAF3 está regulada negativamente por SOCS3 y DUBA. TRAF6 está dirigido por una serie de moléculas inhibidoras como A20, USP4, CYLD, TANK, TRIM38 y SHP. La activación de TAK1 es inhibida por TRIM30a y A20.
4. Relación con las enfermedades
Como el TLR está implicado en la detección de LPS y podría tener un papel en la sepsis, la orientación de los TLR es importante para el tratamiento de varias enfermedades. Además de interferir en las respuestas de los TLR para tratar las infecciones por patógenos, una aplicación clínica obvia de los conocimientos adquiridos a partir de los estudios sobre los TLR fue utilizar los ligandos de los TLR como adyuvantes de vacunas. Por otra parte, también se ha intentado la inhibición de los TLR en la clínica, cuyo objetivo es limitar la inflamación excesiva que presumiblemente es impulsada por la sobreactivación de un TLR en particular.
| Takeda, Kiyoshi, y Shizuo Akira. «Vías de señalización de los TLR». Seminarios de inmunología. Vol. 16. No. 1. Academic Press, 2004. | |
| Akira, Shizuo, y Kiyoshi Takeda. «Señalización del receptor Toll-like». Nature reviews immunology 4.7 (2004): 499-511. | |
| Lim, Kian-Huat, y Louis M. Staudt. «Señalización del receptor Toll-like». Cold Spring Harbor perspectivas en biología 5.1 (2013): a011247. | |
| yTaro Kawai, Takumi Kawasaki. «Vías de señalización de los receptores Toll-like». Receptores de reconocimiento de patrones y cáncer 8916 (2015): 7. | |
| Gay, Nicholas J., et al. «Ensamblaje y localización de complejos de señalización del receptor Toll-like». Nature reviews Immunology 14.8 (2014): 546-558. | |
| O’Neill, Luke AJ, Douglas Golenbock, y Andrew G. Bowie. «La historia de los receptores tipo Toll redefiniendo la inmunidad innata». Nature Reviews Immunology 13.6 (2013): 453-460. | |
| Botos, Istvan, David M. Segal, y David R. Davies. «La biología estructural de los receptores tipo Toll». Structure 19.4 (2011): 447-459. |