US Pharm. 2009;34(11):26-39.
La incertidumbre es alta cuando se trata de seleccionar el antidepresivo apropiado para los pacientes diagnosticados de trastorno depresivo mayor (TDM), no sólo porque los estudios no han informado de diferencias en la eficacia entre los agentes, sino también porque sólo entre el 11% y el 30% de los pacientes alcanzarán la remisión con el tratamiento inicial, incluso después de un año.1,2 En consecuencia, esto ha llevado a los clínicos a practicar el ensayo y error para tratar la depresión.3 Además, la última revisión importante del Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-IV-TR) se produjo en el año 2000.4 En 2005, se publicó una guía de vigilancia para revisar las importantes preocupaciones de seguridad que habían surgido sobre algunos agentes, como la nefazodona, así como para revisar dos nuevos antidepresivos aprobados ese año, el escitalopram y la duloxetina.5 La revisión y actualización del DSM-IV-TR (manuscrito DSM-V) no está prevista hasta mayo de 2012. Por lo tanto, es necesaria una revisión actualizada para ayudar a los clínicos a decidir sobre los agentes apropiados para tratar a los pacientes individuales.
El estudio Sequenced Treatment Alternatives to Relieve Depression (STAR*D) de 2007 intentó desarrollar y evaluar estrategias de tratamiento factibles para mejorar los resultados clínicos de los pacientes con depresión resistente al tratamiento a los que se les identificó un episodio depresivo mayor actual.6 En concreto, STAR*D pretendía determinar cuál de varios tratamientos es el «siguiente paso» más eficaz para los pacientes que no alcanzan la remisión con un tratamiento inicial o posterior o que no toleran el tratamiento. Los resultados generales de este estudio demostraron que las diferencias farmacológicas entre los medicamentos psicotrópicos no se tradujeron en diferencias clínicas sustanciales, aunque la tolerabilidad fue diferente.6
El propósito de este artículo es revisar las pruebas de tratamiento disponibles en la literatura con el fin de proporcionar una referencia rápida que ayude a los clínicos a decidir sobre el agente apropiado, teniendo en cuenta los efectos adversos, las interacciones farmacológicas y la seguridad de la medicación, así como las características del paciente.
¿Qué es la depresión?
La depresión puede ser un trastorno mental crónico o recurrente que se presenta con varios síntomas como un estado de ánimo deprimido, pérdida de interés o placer, sentimientos de culpa, alteración del sueño o del apetito, baja energía y dificultad para pensar.7 La depresión puede llevar a un deterioro sustancial de la capacidad de un individuo para ocuparse de sus responsabilidades diarias. La depresión también puede conducir al suicidio, una tragedia que supone la pérdida de unas 850.000 vidas en todo el mundo cada año.7
Prevalencia y poblaciones de riesgo
Se calcula que hay 121 millones de personas afectadas por la depresión en todo el mundo.7 En el año 2000, la depresión era el cuarto factor que más contribuía a la carga mundial de morbilidad entre todas las enfermedades, y se prevé que para el año 2020 pase a ser el segundo factor que más contribuye a la carga mundial de morbilidad, sólo superado por las enfermedades cardíacas.7
Las poblaciones con mayor riesgo de desarrollar depresión son las mujeres, las personas de entre 24 y 45 años de edad y las que tienen familiares de primer grado con depresión. Las mujeres tienen un mayor riesgo de depresión hasta los 50 años, y su riesgo a lo largo de la vida es dos veces mayor que el de los hombres. Las personas de entre 24 y 45 años experimentan la mayor tasa de depresión. Por último, los familiares de primer grado de los pacientes deprimidos tienen entre 1,5 y 3 veces más probabilidades de sufrir depresión que los demás.4,8
Fisiopatología y fundamento farmacoterapéutico
Se han formulado hipótesis sobre las causas biológicas y psicosociales en un intento de describir la fisiopatología de la depresión. Los agentes farmacológicos se dirigen a las causas biológicas relacionadas con la desregulación de los neurotransmisores. Esta desregulación suele describirse como una deficiencia en los niveles de neurotransmisores cerebrales. Los niveles de norepinefrina, serotonina y dopamina pueden estar disminuidos en los pacientes con depresión, por lo que se asocia una disminución de la cantidad de neurotransmisores con el trastorno.8 El fundamento de la farmacoterapia ha sido potenciar estas deficiencias bloqueando la recaptación o impidiendo el metabolismo enzimático de los neurotransmisores mediante los antidepresivos. En general, estos mecanismos pretenden aumentar el nivel de neurotransmisores, ya sea forzando a la neurona a disparar más a menudo y a producir más neurotransmisores o impidiendo la degradación del propio neurotransmisor.
Agentes farmacológicos
Hay varias clases de agentes disponibles actualmente para tratar la depresión. Incluyen los inhibidores selectivos de la recaptación de serotonina (ISRS), los antidepresivos tricíclicos (ATC), los inhibidores de la monoaminooxidasa (IMAO) y los inhibidores de la recaptación de serotonina-norepinefrina (IRSN), entre otros.
Los antidepresivos se han asociado con un aumento del riesgo de ideación suicida y de suicidio en niños, adolescentes y adultos jóvenes en estudios a corto plazo controlados con placebo sobre el MDD. Cualquiera que considere el uso de cualquier antidepresivo en un niño, adolescente o adulto joven debe equilibrar este riesgo con la necesidad clínica. Los estudios a corto plazo no mostraron un aumento del riesgo de suicidio con los antidepresivos en comparación con el placebo en adultos de más de 24 años, y hubo una reducción del riesgo con los antidepresivos en comparación con el placebo en adultos de 65 años o más. La depresión y otros trastornos psiquiátricos se asocian a su vez a un mayor riesgo de suicidio. Los pacientes de todas las edades que inician un tratamiento antidepresivo deben ser controlados adecuadamente y observados de cerca para detectar un empeoramiento clínico, suicidio o cambios inusuales en el comportamiento.9
Inhibidores selectivos de la recaptación de serotonina4,10: Los ISRS se consideran agentes de primera línea cuando se trata de tratar a pacientes con depresión. Estos fármacos incluyen el citalopram, el escitalopram, la fluoxetina, la fluvoxamina, la paroxetina y la sertralina (TABLA 1). Los principales efectos adversos de esta clase incluyen náuseas, vómitos y diarrea, que son efectos dependientes de la dosis y tienden a disiparse después de las primeras semanas de tratamiento. En algunos pacientes, los ISRS pueden causar agitación y trastornos del sueño, que también se disipan con el tiempo. La disfunción sexual es un efecto secundario presente con todos los antidepresivos, pero parece ser más común con los ISRS.
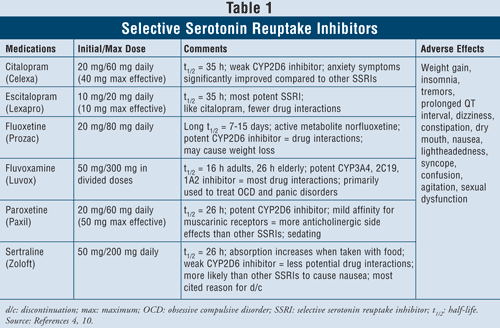
El síndrome de la serotonina (es decir, dolor abdominal, diarrea, sudoración, cambio del estado mental, insuficiencia renal, choque cardiovascular y posiblemente la muerte) es un efecto adverso poco frecuente de los ISRS. El síndrome de la serotonina puede ocurrir con un aumento de la dosis de ISRS o al tomar ISRS con hierbas como la hierba de San Juan o con drogas ilícitas. Por último, la combinación de ISRS con IMAO también puede dar lugar a interacciones farmacológicas letales con el desarrollo del síndrome serotoninérgico. Cuando los clínicos sientan la necesidad de cambiar de una clase de agente a la otra, se sugiere que transcurran al menos cinco semividas entre el momento en que se deja de tomar el ISRS y se empieza a tomar el IMAO.4 De todos los agentes de la clase, la fluvoxa mina tiene la tasa más alta de interacciones farmacológicas, ya que inhibe varias enzimas hepáticas como la CYP450 1A2, 2C19, 2C9, 2D6 y 3A4. La fluoxetina sigue de cerca la tasa de interacción farmacológica de la fluvoxamina con la inhibición del CYP 2C9, 2D6 y 3A4. Por último, el citalopram y el escitalopram son los que menos interacciones farmacológicas presentan, ya que inhiben en menor medida las enzimas 2D6.
Considerando las características y la seguridad de los pacientes, los ISRS son seguros de usar en la mayoría de los grupos de pacientes, incluyendo aquellos con enfermedades cardíacas preexistentes, asma, demencia e hipertensión. Los ancianos, que son particularmente propensos a la hipotensión ortostática, así como a la pérdida de peso, pueden beneficiarse más del uso de los ISRS, ya que estos agentes producen un aumento de peso y carecen de actividad anticolinérgica.
Antidepresivos tricíclicos4,10: Los ATC bloquean la recaptación de norepinefrina y serotonina, pero también tienen afinidad por los receptores alfa1, H1 y muscarínicos, lo que provoca efectos adversos anticolinérgicos. Hay dos subclases de agentes disponibles dentro de esta clase, los ATC de aminas terciarias y secundarias (TABLA 2). Los ATC de aminas secundarias (desipramina, maprotilina, nortriptilina) tienen menos afinidad por los receptores alfa1, H1 y muscarínicos, por lo que causan menos efectos adversos anticolinérgicos que los ATC de aminas terciarias (por ejemplo, amitriptilina, amoxapina, clomipramina, doxepina, imipramina).
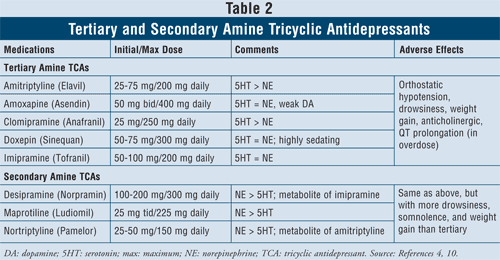
Los principales efectos adversos de esta clase de agentes son hipotensión ortostática, prolongación del QT, somnolencia, sequedad de boca, visión borrosa, estreñimiento y aumento de peso. En general, los ATC de aminas terciarias tienen más actividad de serotonina que los ATC de aminas secundarias, que tienen más actividad de norepinefrina, por lo que causan menos somnolencia y aumento de peso.
Se sabe que los ATC inhiben las enzimas CYP 2C19 y 2D6.11 También son metabolizados en menor medida por las enzimas CYP 1A2 y 3A4.12 Por esta razón, aunque las interacciones farmacológicas con estos agentes podrían no ser la principal preocupación, se aconseja tener precaución cuando se combinen ATC con ISRS, ya que el nivel plasmático del fármaco de los ATC tiene el potencial de aumentar hasta cuatro veces, lo que podría provocar efectos tóxicos.13,14
Considerando las características y la seguridad de los pacientes, los ATC están contraindicados en algunas condiciones cardíacas específicas como los pacientes con antecedentes de arritmias, disfunción del nódulo sinusal o defectos de conducción. Se recomienda tener precaución con los ancianos, ya que son más sensibles al bloqueo colinérgico, así como a la hipotensión ortostática. Además, los individuos que también padecen demencia serán especialmente susceptibles a los efectos tóxicos del bloqueo muscarínico sobre la memoria y la capacidad de atención y, por lo general, les irá mejor si se les administran antidepresivos con el menor grado de efectos anticolinérgicos. Por último, debe tenerse precaución al considerar el inicio de los ATC en pacientes con pensamientos suicidas debido a los altos riesgos de letalidad con la sobredosis. La dosis letal es sólo ocho veces la dosis terapéutica, por lo que si los ATC se ingieren en sobredosis, pueden bloquear el nodo sinoauricular del corazón.
Inhibidores de la monoamino oxidasa4,10: Los IMAO disponibles incluyen isocarboxazida, fenelzina, selegilina y tranilcipromina (TABLA 3). Aparte de la selegilina, que es un inhibidor selectivo de la MAO B, todos los demás agentes inhiben las enzimas MAO A y B responsables del metabolismo de la serotonina, la norepinefrina y la dopamina en el cerebro. Debido a los graves efectos adversos y a las restricciones dietéticas necesarias, los IMAO se reservan generalmente para los pacientes a los que les han fallado otros antidepresivos.
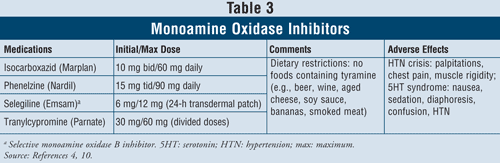
La crisis hipertensiva puede producirse cuando los pacientes que toman IMAO ingieren alimentos que contienen tiramina, como la cerveza, el vino, el queso curado y la carne ahumada. Esta reacción se presenta como una aparición aguda de dolor de cabeza intenso, náuseas, rigidez de cuello, palpitaciones, dolor de pecho y confusión. Los IMAO también pueden causar el síndrome de la serotonina. Como se ha mencionado anteriormente, este síndrome se produce con mayor frecuencia cuando los IMAO se toman de forma concomitante con otros agentes serotoninérgicos como los ISRS o si se administra venlafaxina, un IRSN, poco después de un IMAO. Cuando los pacientes pasan de un ISRS con una vida media corta a un IMAO, es importante que se respete un período de lavado de 2 semanas entre la interrupción del ISRS y el inicio del IMAO. Si el ISRS es la fluoxetina, que tiene una vida media larga, el período de lavado debe ser de 5 semanas.4 Pueden producirse otros efectos adversos con los IMAO, como hipotensión ortostática, aumento de peso, disfunción sexual e insomnio.
Debido a la alta tasa de interacciones farmacológicas con estos agentes, se debe tener precaución cuando se prescriban a pacientes con asma que utilicen broncodilatadores simpaticomiméticos. En pacientes con hipertensión, los IMAO pueden inducir hipotensión ortostática, especialmente con tratamientos diuréticos concurrentes.
Inhibidores de la recaptación de serotonina-norepinefrina4,10: Los IRSN como desvenlafaxina, duloxetina y venlafaxina también pueden utilizarse como agentes de primera línea (TABLA 4). Estos medicamentos son más seguros que los ATC, y sus efectos adversos son similares a los de los ISRS, incluyendo náuseas, vómitos y disfunción sexual, así como elevación de la presión arterial.
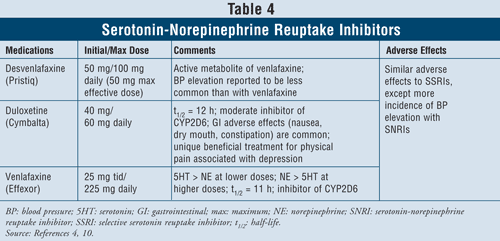
Se ha demostrado que la venlafaxina provoca un aumento de la presión arterial en el 3% al 13% de los casos, mientras que se ha informado de que la desvenlafaxina provoca un aumento de la presión arterial sólo en el 1% al 2% de los casos.10 Por lo tanto, se recomienda evitar el uso de venlafaxina en pacientes con hipertensión no controlada, ya que el agente puede exacerbar la condición. La duloxetina tiene más actividad de norepinefrina que los dos agentes mencionados, por lo que es útil con síntomas físicos como dolores musculares, dolores de cabeza, problemas estomacales y dolor generalizado, que suelen darse en pacientes con depresión grave. Debido a su eficacia en los síntomas de dolor, la duloxetina también ha sido aprobada para otras indicaciones como la fibromialgia y el dolor neuropático periférico diabético.15 Por último, los tres agentes tienen más actividad de serotonina que de norepinefrina a dosis bajas y más actividad de norepinefrina que de serotonina a dosis altas, por lo que tienen efectos adversos dependientes de la dosis.
Otros antidepresivos4,10: Existen otros antidepresivos que difieren en su mecanismo de acción de las clases de medicamentos descritas anteriormente.
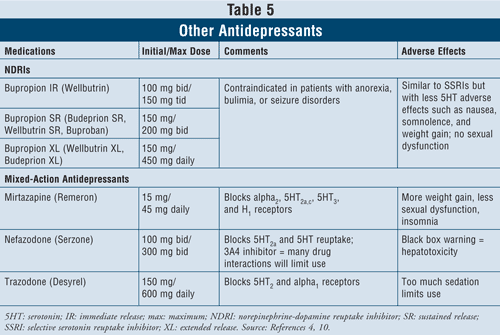
Los inhibidores de la recaptación de norepinefrina-dopamina (IRND) como el bupropión de liberación inmediata (IR) de la marca Wellbutrin (también disponible en formas farmacéuticas de acción prolongada como Wellbutrin XL, Wellbutrin SR, Budeprion SR, Budeprion XL y Buproban) pueden utilizarse como agentes de primera línea para tratar la depresión (TABLA 5). Sus efectos adversos son similares a los de los ISRS, con efectos mínimos sobre la serotonina, como náuseas y aumento de peso, y poca o ninguna disfunción sexual. Se ha demostrado que el bupropión ejerce efectos beneficiosos sobre los síntomas de la enfermedad de Parkinson en algunos pacientes, pero también puede inducir algunos síntomas psicóticos, tal vez debido a su acción agonista sobre el sistema dopaminérgico.16
Por último, existen otros tres antidepresivos de acción mixta disponibles: mirtazapina, nefazodona y trazodona (TABLA 5). Los tres agentes bloquean diferentes receptores de serotonina, por lo que tienen efectos distintos. La mirtazapina provoca un mayor aumento de peso al incrementar el apetito. La nefazodona tiene usos limitados debido a la hepatotoxicidad y a la inhibición de la enzima CYP3A4, que da lugar a interacciones farmacológicas. La trazodona bloquea en gran medida los receptores de serotonina, con escasa unión a los receptores muscarínicos. Pueden producirse efectos adversos como sedación, dolor de cabeza, deterioro de la memoria, sequedad de boca y estreñimiento. También se recomienda precaución con el uso de trazodona en hombres debido al riesgo de priapismo.
Conclusión
En general, los medicamentos antidepresivos han demostrado ser igualmente eficaces; Por lo tanto, la elección de la medicación debe basarse en los efectos adversos, las interacciones farmacológicas, la seguridad y las preferencias del paciente. Existen varios algoritmos para guiar al clínico durante el tratamiento del paciente, en particular el recientemente actualizado algoritmo del Departamento Estatal de Servicios de Salud de Texas para el tratamiento del MDD (actualizado en julio de 2008).17 Si los pacientes muestran una respuesta parcial, los clínicos pueden optar por aumentar la dosis, cambiar a un agente alternativo o administrar una combinación de antidepresivos. Por el contrario, si los pacientes no responden o no pueden tolerar el fármaco, el cambio a un agente alternativo también es apropiado, teniendo en cuenta que los efectos terapéuticos suelen producirse entre 4 y 6 semanas, aunque los efectos adversos puedan aparecer después de 1 semana de tratamiento.4,17 Además, aunque los efectos adversos aparecen al principio del tratamiento, generalmente se disipan después de 2 a 3 semanas.4,17 No obstante, el antidepresivo que con mayor probabilidad garantizará la mejoría y la seguridad de un paciente puede determinarse, al menos parcialmente, por ensayo y error. Dada la dificultad de predecir qué medicamento será eficaz y tolerado por un paciente individual, es prudente y útil familiarizarse con un amplio espectro de antidepresivos.
1. Song F, Freemantle N, Sheldon TA, et al. Inhibidores selectivos de la recaptación de serotonina: meta-análisis de eficacia y aceptabilidad. BMJ. 1993;306:683-687.
2. Geddes JR, Freemantle N, Mason J, et al. SSRIs versus other antidepressants for depressive disorder. Cochrane Database Syst Rev. 2000;(2):CD001851.
3. Rush AJ, Wisniewski SR, Warden D, et al. Selección entre monoterapias de medicación antidepresiva de segundo paso: valor predictivo de las características clínicas, demográficas o del tratamiento de primer paso. Arch Gen Psychiatry. 2008;65:870-881.
4. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition, Text Revision (DSM-IV-TR). Washington, DC: American Psychiatric Association; 2000.
5. Grupo de Trabajo sobre el Trastorno Depresivo Mayor. Guideline Watch: Guías de práctica para el tratamiento de pacientes con trastorno depresivo mayor. 2nd ed. Washington, DC: American Psychiatric Association; 2005.
6. Cain RA. Navegando por el estudio Sequenced Treatment Alternatives to Relieve Depression (STAR*D): resultados prácticos e implicaciones para el tratamiento de la depresión en atención primaria. Prim Care Clin Office Pract. 2007;34:505-519.
7. Depression. Organización Mundial de la Salud. www.who.int/mental_health/management/depression/definition/en. Consultado el 5 de octubre de 2009.
8. Dipiro JT, Talbert RL, Yee GC, et al. Pharmacotherapy: A Pathophysiologic Approach. 6th ed. New York, NY: McGraw-Hill; 2005.
9. Revisiones del etiquetado de los productos. Suicidalidad y fármacos antidepresivos. FDA. www.fda.gov/downloads/Drugs/DrugSafety/InformationbyDrugClass/UCM173233.pdf. Consultado el 5 de octubre de 2009.
10. Información sobre medicamentos. Micromedex Healthcare Series. Greenwood Village, CO: Thomson Micromedex. www.micromedex.com. Consultado el 5 de octubre de 2009.
11. Shin J-G, Park J-Y, Kim M-J, et al. Inhibitory effects of tricyclic antidepressants on human cytochrome P450 enzymes in vitro: mechanism of drug interaction between TCAs and phenytoin. Drug Metab Dispos. 2002;30:1102-1107.
12. Brown CH. Visión general de las interacciones farmacológicas con los ISRS. US Pharm. 2008;33(1):HS3-HS19.
13. Spina E, Scordo MG, D’Arrigo C. Interacciones farmacológicas metabólicas con nuevos agentes psicotrópicos. Fundam Clin Pharmacol. 2003;17:517-538.
14. Bergstrom RF, Peyton AL, Lemberger L. Quantification and mechanism of the fluoxetine and tricyclic antidepressant interaction. Clin Pharmacol Ther. 1992;51:239-248.
15. Prospecto de Cymbalta (hidrocloruro de duloxetina). Indianápolis, IN: Eli Lilly and Company; febrero de 2009. http://pi.lilly.com/us/cymbalta-pi.pdf. Consultado el 5 de octubre de 2009.
16. Goetz CG, Tanner CM, Klawans HL. Bupropión en la enfermedad de Parkinson. Neurology. 1984;34:1092-1094.
17. Suehs B, Argo TR, Bendele SD, et al. Texas Medication Algorithm Project Procedural Manual. Major Depressive Disorder Algorithms. Departamento Estatal de Servicios de Salud de Texas; julio de 2008. www.dshs.state.tx.us/mhprograms/pdf/TIMA_MDD_Manual_080608.pdf. Consultado el 5 de octubre de 2009.
Para comentar este artículo, contacte con [email protected].