Pyroxeny jsou nejvýznamnější a nejhojnější skupinou horninotvorných feromagnezitických silikátů. Vyskytují se téměř ve všech druzích vyvřelých hornin a vyskytují se v horninách velmi různého složení, které vznikly v podmínkách regionálního a kontaktního metamorfismu. Název pyroxen je odvozen z řeckého pyro, což znamená „oheň“, a xenos, což znamená „cizí“, a byl dán Haüyem nazelenalým krystalům nalezeným v mnoha lávách, které se tam podle něj dostaly náhodou.
Chemické složení minerálů pyroxenové skupiny lze vyjádřit obecným vzorcem:
XYZ2O6
v němž X = Na+, Ca2+, Mn2+, Fe2+, Mg2+, Li+; Y = Mn2+, Fe2+, Mg2+, Fe3+, Al3+, Cr3+, Ti4+; a Z = Si4+, Al3+. Rozsah možných chemických substitucí v pyroxenu je omezen velikostí dostupných míst ve struktuře a nábojem substituujících kationtů. Místa pro kationty X jsou obecně větší než místa pro kationty Y. Mezi ideálními složeními koncových členů dochází k rozsáhlé atomové substituci. Většina pyroxenů má pouze omezenou substituci hliníku za křemík v Z (tetraedrickém) místě. Pokud se substituující iont liší nábojem, je elektrická neutralita udržována spřaženými substitucemi. Například dvojice tvořená Na+ a Al3+ substituuje 2Mg2+.
Nejběžnější pyroxeny lze reprezentovat jako součást chemického systému CaSiO3 (wollastonit, pyroxenoid), MgSiO3 (enstatit) a FeSiO3 (ferrosilit). (Obr. 1). Protože neexistují žádné pravé pyroxeny s obsahem vápníku vyšším než ve spoji diopsid-hedenbergit, nazývá se část tohoto systému pod tímto spojem pyroxenový čtyřúhelník.
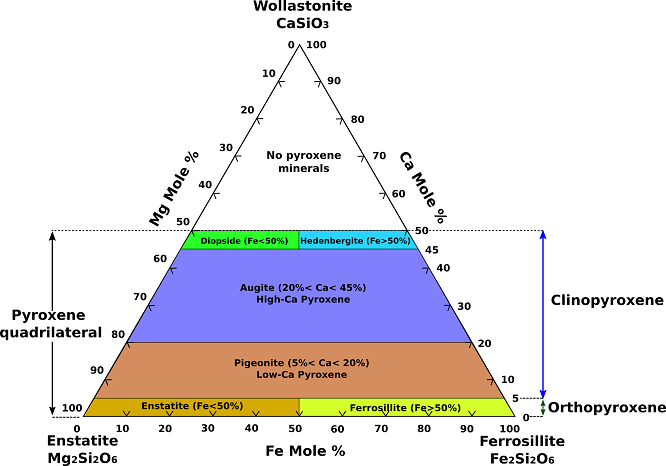
Obr.1: Ternární diagram složení pyroxenů.
Úplná substituce existuje mezi enstatitem (Mg2Si2O6) a ferosilitem (Fe2Si2O6) a úplný pevný roztok železa za hořčík existuje mezi diopsidem (CaMgSi2O6) a hedenbergitem (CaFeSi2O6). Uvnitř pyroxenového čtyřúhelníku leží augit, subkalcický augit a holubit. Složením je augit příbuzný členům diopsid-hedenbergitové řady s omezenou substitucí Na+ za Ca2+, Al3+ za Mg2+ a Fe2+ a Al3+ za Si4+ v Z (tetraedrickém) místě. Augity s významným obsahem hliníku nebo sodíku nemohou být striktně zastoupeny ve čtyřúhelníkové rovině. Monoklinický holubit zahrnuje pole pevných roztoků hořčíku a železa s mírně vyšším obsahem vápníku než orthorombická řada enstatit-ortoferosilit.
Spojenými substitucemi zahrnujícími Na+, Li+ nebo Al3+ za Mg2+ ve struktuře enstatitu vznikají pyroxeny, které leží mimo pole čtyřbokého složení. Spřažená substituce Na+ a Al3+ za 2Mg2+ v enstatitu dává pyroxen jadeit. Spřažená substituce Na+ a Fe3+ za 2Mg2+ vytváří pyroxen aegirin (akmit). Substitucí Li+ a Al3+ za 2Mg2+ vzniká spodumen. Záměnou Al3+ za Mg2+ a Al3+ za Si4+ vzniká ideální složka tschermakitu MgAlSiAlO6. Mezi další méně běžné pyroxeny se složením mimo pyroxenový čtyřúhelník patří johannsenit , a kosmochlor (ureyit) . Johannsenit zahrnuje záměnu manganu za železo v hedenbergitu. Kosmochlor má místo železa nebo hliníku v sodném pyroxenu chrom (Cr).
Při vysokých teplotách mají pyroxeny rozsáhlejší pole pevného roztoku než při nižších. V důsledku toho s klesající teplotou pyroxen upravuje své složení v pevném stavu exsolvací samostatné fáze ve formě lamel uvnitř hostitelského pyroxenového zrna. Lamely jsou exsolvovány podél specifických krystalografických směrů a vytvářejí orientované prorostlice s paralelní a rybí strukturou. Existuje pět hlavních kombinací exsolučních párů: (1) augit s enstatitovými lamelami, (2) augit s holubitovými lamelami, (3) augit s holubitovými i enstatitovými lamelami, (4) holubit s augitovými lamelami a (5) enstatit s augitovými lamelami.
Pyroxeny se od amfibolů liší složením ve dvou hlavních ohledech. Pyroxeny neobsahují ve své struktuře esenciální vodu ve formě hydroxylů, zatímco amfiboly jsou považovány za hydratované silikáty. Druhým klíčovým chemickým rozdílem mezi nimi je přítomnost místa A v amfibolech, které obsahuje velké alkalické prvky, obvykle sodík a někdy i draslík; pyroxeny nemají ekvivalentní místo, které by mohlo pojmout draslík.
Struktura
Skupina pyroxenů zahrnuje minerály, které se tvoří v orthorombické i monoklinické krystalové soustavě. Orthorombické pyroxeny se označují jako ortopyroxeny a monoklinické pyroxeny se nazývají klinopyroxeny. Základním rysem všech pyroxenových struktur je propojení tetraedrů křemíku a kyslíku (SiO4) sdílením dvou ze čtyř rohů do souvislých řetězců. Řetězce, které se táhnou neomezeně rovnoběžně s krystalografickou osou c, mají složení (Si2O6) (obr. 2). Vzdálenost opakování přibližně 5,3 Å podél délky řetězce vymezuje osu c jednotkové buňky. Řetězce Si2O6 jsou vázány na vrstvu oktaedricky koordinovaných kationtových pásů, které se rovněž táhnou rovnoběžně s osou c.
.png)
Obr. 2: schéma struktury pyroxenu s jedním řetězcem. Tam, kde se dva tetraedry dotýkají, mají společný kyslíkový ion. Z Wikipedie
Oktaedrické pásy se skládají z oktaedrů M1 a M2 vložených mezi dva opačně směřující tetraedrické řetězce. Místa M1 jsou obsazena menšími kationty, jako je hořčík, železo, hliník a mangan, které jsou koordinovány se šesti atomy kyslíku a tvoří pravidelný oktaedr. V monoklinických pyroxenech je místo M2 velký nepravidelný polyedr obsazený většími kationty vápníku a sodíku, které jsou v osminásobné koordinaci. V orthorombických pyroxenech s nízkým obsahem vápníku obsahuje M2 hořčík a železo a polyedr nabývá pravidelnějšího oktaedrického tvaru. Pásek kationtu M1 je vázán na atomy kyslíku dvou opačně směřujících tetraedrických řetězců (obr. 3). Ty dohromady tvoří tetraedricko-oktaedricko-tetraedrický (t-o-t) pás. Schematická projekce struktury pyroxenu kolmo na osu c a vztah štěpení pyroxenu k t-o-t proužkům nebo I-nosníkům je znázorněn na obr. 3.
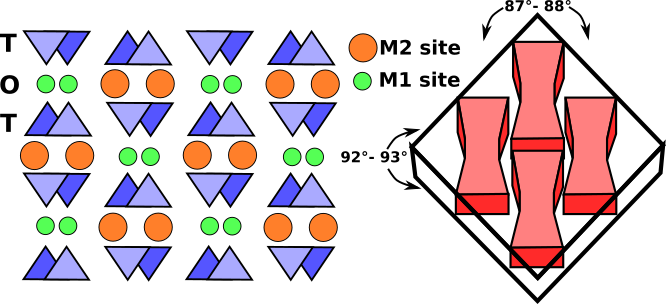
Obr. 3: Schematická projekce monoklinické struktury pyroxenu kolmo na osu c. Pruhy T-O-T, nazývané I-nosníky, mají velmi pevné vazby, které odolávají porušení a vytvářejí typické štěpení pyroxenů pod úhlem téměř 90° (čárkované čáry).
Na tenkých řezech se monoklinické pyroxeny vyznačují dvěma směry štěpení přibližně pod úhlem 87° a 93°, osmibokými bazálními řezy a světle hnědou nebo zelenou barvou. Orthorombické pyroxeny se od monoklinických pyroxenů liší tím, že mají paralelní extinkci.
Bibliografie
– Cox et al. (1979): The Interpretation of Igneous Rocks, George Allen and Unwin, London.
– Howie, R. A., Zussman, J., & Deer, W. (1992). An introduction to the rock-forming minerals (s. 696). Longman.
– Le Maitre, R. W., Streckeisen, A., Zanettin, B., Le Bas, M. J., Bonin, B., Bateman, P., & Lameyre, J. (2002). Igneózní horniny. A classification and glossary of terms, 2. Cambridge University Press.
– Middlemost, E. A. (1986). Magmas and magmatic rocks: an introduction to igneous petrology.
– Shelley, D. (1993). Igneous and metamorphic rocks under the microscope: classification, textures, microstructures and mineral preferred-orientations.
– Vernon, R. H. & Clarke, G. L. (2008): Principles of Metamorphic Petrology. Cambridge University Press.