Ionisierungsenergien der Elemente des s- und p-Blocks
Die Ionisierungsenergien der Elemente in der dritten Reihe des Periodensystems weisen das gleiche Muster auf wie die von \(Li\) und \(Be\) (Tabelle \(\PageIndex{2}\)): Die aufeinanderfolgenden Ionisierungsenergien nehmen stetig zu, wenn Elektronen aus den Valenzorbitalen (in diesem Fall 3s oder 3p) entfernt werden, gefolgt von einem besonders starken Anstieg der Ionisierungsenergie, wenn Elektronen aus gefüllten Kernniveaus entfernt werden, wie durch die fette diagonale Linie in Tabelle \(\PageIndex{2}\) angezeigt. So entspricht in der dritten Zeile des Periodensystems der größte Anstieg der Ionisierungsenergie dem Entfernen des vierten Elektrons aus \(Al\), des fünften Elektrons aus Si und so weiter, d. h. dem Entfernen eines Elektrons aus einem Ion, das die Valenzelektronenkonfiguration des vorhergehenden Edelgases hat. Dieses Muster erklärt, warum in der Chemie der Elemente normalerweise nur Valenzelektronen vorkommen. Es ist zu viel Energie erforderlich, um die inneren Elektronen entweder zu entfernen oder zu teilen.
| Element | \(I_1\) | \(I_2\) | \(I_3\) | \(I_4\) | \(I_5\) | \(I_6\) | \(I_7\) |
|---|---|---|---|---|---|---|---|
| *Inner-Schalen-Elektron | |||||||
| Na | 495.8 | 4562.4* | – | – | – | – | – |
| Mg | 737.7 | 1450.7 | 7732.7 | – | – | – | – |
| Al | 577.4.4 | 1816.7 | 2744.8 | 11.577.4.4 | – | – | – |
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16.090.6 | – | – |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4.3 |
| Cl | 1251.2 | 2297.7 | 3822 | 5158.6 | 6540 | 9362 | 11.018,2 |
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 |
Beispiel \(\PageIndex{1}\): Höchste vierte Ionisierungsenergie
Bestimmen Sie anhand ihrer Position im Periodensystem, welches dieser Elemente die höchste vierte Ionisierungsenergie hat: B, C oder N.
Gegeben: drei Elemente
Gefragt: Element mit der höchsten vierten Ionisierungsenergie
Strategie:
- Listen Sie die Elektronenkonfiguration der einzelnen Elemente auf.
- Bestimmen Sie, ob Elektronen aus einer gefüllten oder teilweise gefüllten Valenzschale entfernt werden. Sagen Sie voraus, welches Element die höchste vierte Ionisierungsenergie hat, und erkennen Sie, dass die höchste Energie der Entfernung von Elektronen aus einem gefüllten Elektronenkern entspricht.
Lösung:
A Diese Elemente liegen alle in der zweiten Reihe des Periodensystems und haben die folgenden Elektronenkonfigurationen:
- B: 2s22p1
- C: 2s22p2
- N: 2s22p3
B Die vierte Ionisierungsenergie eines Elements (\(I_4\)) ist definiert als die Energie, die erforderlich ist, um das vierte Elektron zu entfernen:
\
Da Kohlenstoff und Stickstoff vier bzw. fünf Valenzelektronen haben, entspricht ihre vierte Ionisierungsenergie der Entfernung eines Elektrons aus einer teilweise gefüllten Valenzschale. Die vierte Ionisierungsenergie von Bor hingegen entspricht dem Entfernen eines Elektrons aus der gefüllten 1s2-Unterschale. Dazu müsste viel mehr Energie erforderlich sein. Die tatsächlichen Werte lauten wie folgt: B, 25.026 kJ/mol; C, 6223 kJ/mol; und N, 7475 kJ/mol.
Übung \(\PageIndex{1}\): Niedrigste zweite Ionisierungsenergie
Bestimmen Sie anhand ihrer Position im Periodensystem, welches dieser Elemente die niedrigste zweite Ionisierungsenergie hat: Sr, Rb oder Ar.
Antwort
\(\ce{Sr}\)
Die erste Spalte der Daten in Tabelle \(\PageIndex{2}\) zeigt, dass die ersten Ionisierungsenergien in der dritten Reihe des Periodensystems tendenziell ansteigen. Dies liegt daran, dass sich die Valenzelektronen gegenseitig nicht sehr gut abschirmen, so dass die effektive Kernladung über die Reihe hinweg stetig zunimmt. Die Valenzelektronen werden daher stärker vom Kern angezogen, so dass die Atomgröße abnimmt und die Ionisierungsenergie steigt. Diese Effekte stellen zwei Seiten derselben Medaille dar: Stärkere elektrostatische Wechselwirkungen zwischen den Elektronen und dem Kern erhöhen die zum Entfernen der Elektronen erforderliche Energie.
Allerdings nimmt die erste Ionisierungsenergie bei Al (3s23p1) und bei S (3s23p4) ab. Die Elektronenkonfigurationen dieser „Ausnahmen“ liefern die Antwort, warum. Die Elektronen in der gefüllten 3s2-Unterschale von Aluminium können das 3p1-Elektron besser abschirmen als sich gegenseitig von der Kernladung abschirmen, so dass die s-Elektronen näher an den Kern herankommen als das p-Elektron und das p-Elektron leichter entfernt werden kann. Die Abnahme bei S ist darauf zurückzuführen, dass sich die beiden Elektronen im gleichen p-Orbital gegenseitig abstoßen. Dadurch ist das S-Atom etwas weniger stabil als sonst zu erwarten wäre, was für alle Elemente der Gruppe 16 gilt.
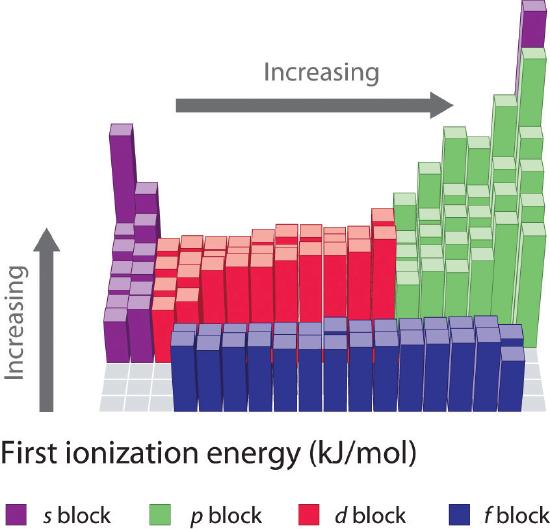
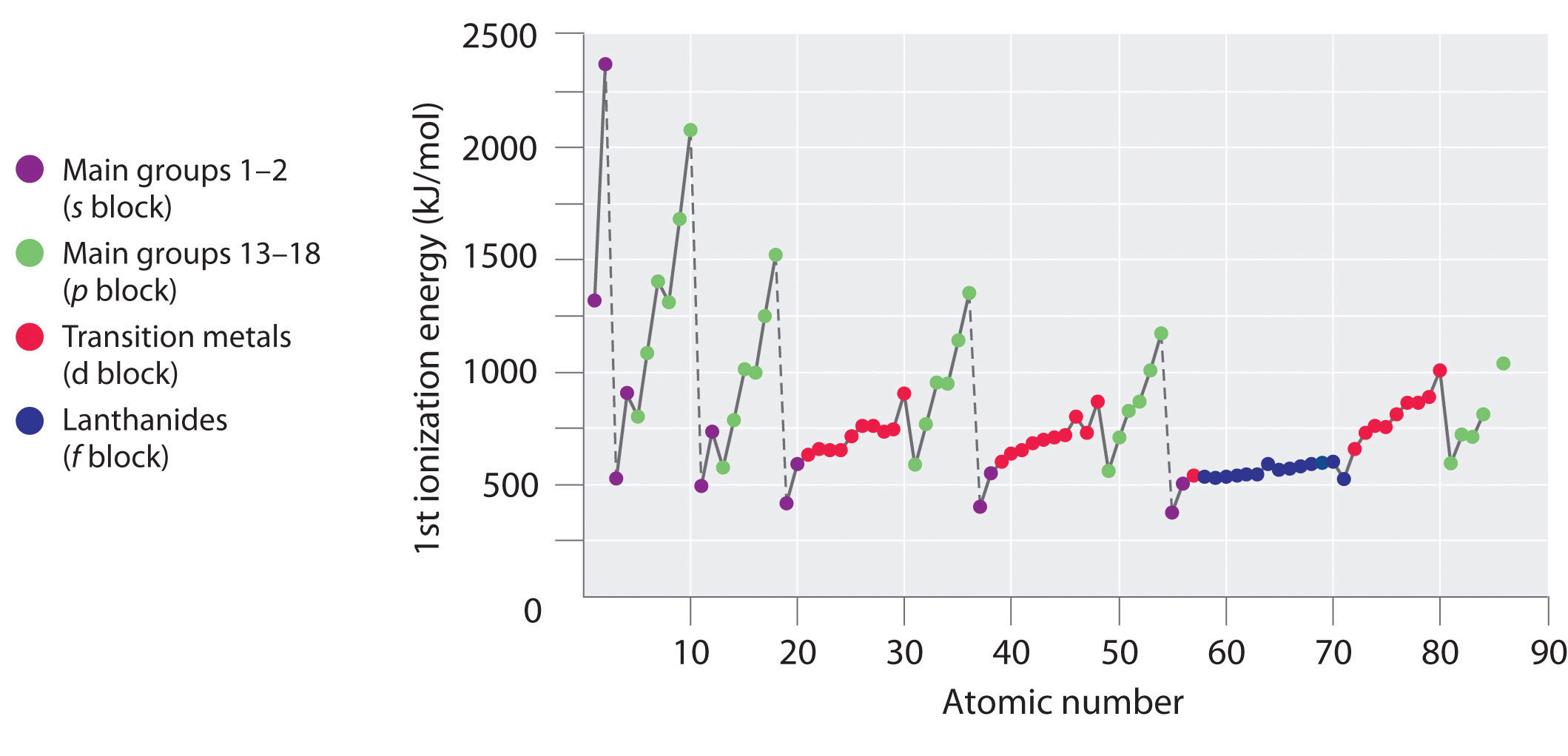
Die ersten Ionisierungsenergien der Elemente in den ersten sechs Zeilen des Periodensystems sind in Abbildung \(\PageIndex{1}\) dargestellt und werden in Abbildung \(\PageIndex{2}\) numerisch und grafisch präsentiert. Diese Abbildungen veranschaulichen drei wichtige Trends:
- Die Veränderungen in der zweiten (Li zu Ne), vierten (K zu Kr), fünften (Rb zu Xe) und sechsten (Cs zu Rn) Reihe der s- und p-Blöcke folgen einem Muster, das dem für die dritte Reihe des Periodensystems beschriebenen Muster ähnelt. Die Übergangsmetalle sind jedoch in der vierten, fünften und sechsten Reihe enthalten, die Lanthaniden in der sechsten Reihe. Die ersten Ionisierungsenergien der Übergangsmetalle und der Lanthaniden sind einander recht ähnlich. Die Ionisierungsenergien nehmen von links nach rechts in jeder Reihe zu, wobei Abweichungen bei ns2np1 (Gruppe 13), ns2np4 (Gruppe 16) und ns2(n – 1)d10 (Gruppe 12) auftreten.
- Die ersten Ionisierungsenergien nehmen im Allgemeinen in einer Spalte ab. Obwohl die Hauptquantenzahl n mit zunehmender Säule ansteigt, schirmen gefüllte innere Schalen die Valenzelektronen wirksam ab, so dass die effektive Kernladung nur relativ gering ansteigt. Folglich werden die Atome größer, wenn sie Elektronen aufnehmen. Valenzelektronen, die weiter vom Kern entfernt sind, sind weniger stark gebunden und können daher leichter entfernt werden, wodurch die Ionisierungsenergie sinkt. Ein größerer Radius entspricht in der Regel einer niedrigeren Ionisierungsenergie.
- Aufgrund der ersten beiden Tendenzen liegen die Elemente, die am leichtesten positive Ionen bilden (die die niedrigsten Ionisierungsenergien haben), in der linken unteren Ecke des Periodensystems, während die Elemente, die am schwersten zu ionisieren sind, in der rechten oberen Ecke des Periodensystems liegen. Folglich steigen die Ionisierungsenergien im Allgemeinen diagonal von links unten (Cs) nach rechts oben (He) an.

Im Allgemeinen steigt \(I_1\) diagonal von links unten im Periodensystem nach rechts oben an.
Gallium (Ga), das erste Element nach der ersten Reihe der Übergangsmetalle, hat die folgende Elektronenkonfiguration: 4s23d104p1. Seine erste Ionisierungsenergie ist deutlich niedriger als die des unmittelbar vorangehenden Elements Zink, weil die gefüllte 3d10-Unterschale des Galliums innerhalb der 4p-Unterschale liegt und das einzelne 4p-Elektron vom Kern abschirmt. Experimente haben etwas noch Interessanteres zutage gefördert: Die zweiten und dritten Elektronen, die bei der Ionisierung von Gallium entfernt werden, stammen aus dem 4s2-Orbital und nicht aus der 3d10-Unterschale. Die Chemie des Galliums wird von dem entstehenden Ga3+-Ion mit seiner 3d10-Elektronenkonfiguration dominiert. Diese und ähnliche Elektronenkonfigurationen sind besonders stabil und kommen häufig in den schwereren Elementen des p-Blocks vor. Sie werden manchmal auch als Pseudo-Edelgas-Konfigurationen bezeichnet. Tatsächlich sind für Elemente, die diese Konfigurationen aufweisen, keine chemischen Verbindungen bekannt, in denen Elektronen aus der mit (n – 1)d10 gefüllten Unterschale entfernt werden.