Subatomare Teilchen
Alle Elemente bestehen aus extrem kleinen Materieteilchen, den Atomen. Wir können ein Atom als das einfachste Teilchen eines Elements definieren, das die chemischen Eigenschaften dieses Elements besitzt. Zu den chemischen Eigenschaften gehören der physikalische Zustand des Elements (gasförmig, flüssig oder fest), die Art der Bindungen, die das Element eingehen kann, wie es mit anderen Elementen reagiert, usw. Daher haben alle Atome, aus denen das Element Kohlenstoff besteht, die gleichen chemischen Eigenschaften.
Physikern ist es gelungen, Atome in Dutzende verschiedener subatomarer Teilchen zu zerlegen, von denen jedoch nur drei stabil sind. Das sind die Protonen, Neutronen und Elektronen. Protonen sind positiv geladene Teilchen, haben eine Masse und befinden sich im Zentrum des Atoms, dem Kern. Neutronen sind ungeladen, haben eine Masse und befinden sich ebenfalls im Kern des Atoms. Neutronen binden sich mit Protonen und tragen so zur Stabilisierung des Kerns bei. Zu viele oder zu wenige Neutronen können zu einem instabilen Atomkern führen, der unter Umständen zu anderen Elementen zerfällt. Diese Atome werden als radioaktiv bezeichnet. Obwohl die Masse des Neutrons etwas größer ist als die des Protons, können wir beiden die relative Masse 1 (1 atomare Masseneinheit oder amu) zuordnen. Neutronen und Protonen machen fast die gesamte Masse eines Atoms aus. Die dritte Art von stabilen Teilchen ist das Elektron. Elektronen haben eine negative Ladung, sind aber extrem klein und haben nur 1/1850 der Masse eines Protons oder Neutrons. Sie sind so klein, dass sie für praktische Zwecke nicht zur Masse des Atoms beitragen. Die Elektronen bewegen sich mit enormer Geschwindigkeit um den Atomkern herum, und zwar fast mit Lichtgeschwindigkeit. Obwohl wir die Elektronen oft so beschreiben, als befänden sie sich in Bahnen, die den Kern umkreisen, so wie Planeten die Sonne umkreisen, lehrt uns die moderne Physik, dass dieses Modell falsch ist. Diese „Orbitale“ sind eigentlich Bereiche im Raum um den Kern, in denen sich die Elektronen die meiste Zeit aufhalten. Dieser Bereich wird oft als „Elektronenwolke“ bezeichnet. Es handelt sich zwar immer noch um einen bestimmten Bereich, aber er ist etwas amorpher als ein kugelförmiges Orbital. Der Einfachheit halber stellen wir sie uns jedoch oft als satellitenähnliche kreisförmige Orbitalen vor. Die folgende Abbildung zeigt unser aktuelles Modell eines Stickstoffatoms.
Der Stickstoffkern enthält 7 Protonen (orange) und 7 Neutronen (grün). Die schattierten Bereiche um den Kern stellen die Elektronenorbitale (Wolken) dar. Die Elektronen (blau) befinden sich irgendwo in diesen Orbitalen. (Hinweis: Das Bild ist nicht maßstabsgetreu gezeichnet. Wenn der Kern die Größe eines Basketballs hätte, wären die Elektronen etwa sechs Kilometer entfernt!)
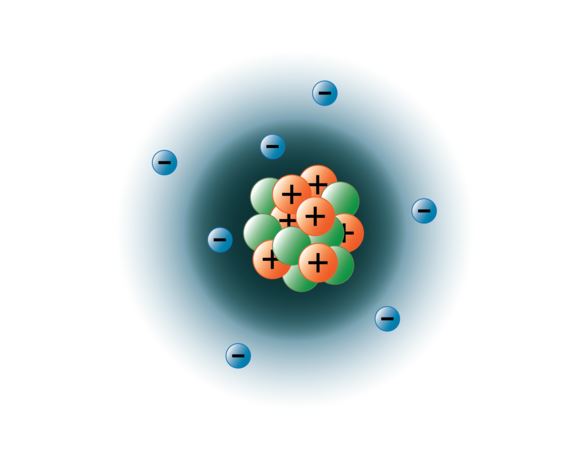
Bild erstellt von BYU-I-Studentin Hannah Crowder Herbst 2013
Atomzahl
Schauen Sie sich das Periodensystem noch einmal an und beachten Sie die Zahl oben in jedem Kästchen. Diese Zahl ist die Ordnungszahl für das jeweilige Element und ist für jedes Element einzigartig. Zum Beispiel ist die Ordnungszahl für Wasserstoff 1. Kein anderes Element hat eine Ordnungszahl von 1. Für Kohlenstoff ist die Ordnungszahl 6, und auch hier hat kein anderes Element eine Ordnungszahl von 6. Die Bedeutung der Ordnungszahl besteht darin, dass sie uns die Anzahl der Protonen im Kern jedes Elements angibt. So haben alle Wasserstoffatome 1 Proton und alle Kohlenstoffatome 6 Protonen. Da Atome eine neutrale Ladung haben, gibt die Ordnungszahl außerdem die Anzahl der Elektronen im Atom an. In der chemischen Schreibweise wird die Ordnungszahl für ein Element als tiefgestellte Zahl vor dem Symbol für das Element angegeben. Zum Beispiel würde Kohlenstoff als 6C ausgedrückt werden.
Massenzahl (Atommasse)
Die Massenzahl eines Atoms gibt, wie der Name schon sagt, die Gesamtmasse des Atoms an. Da die Masse eines Elektrons extrem klein (vernachlässigbar) ist, wird es bei der Berechnung der Massenzahl nicht berücksichtigt. Außerdem sei daran erinnert, dass die Masse jedes Protons und jedes Neutrons 1 atomare Masseneinheit beträgt. Daher ist die Massenzahl die Summe der Protonen und Neutronen im Atom. Da die Massenzahl die Anzahl der Protonen plus die Anzahl der Neutronen und die Ordnungszahl die Anzahl der Protonen ist, können Sie die Anzahl der Neutronen ermitteln, indem Sie einfach die Ordnungszahl von der Massenzahl subtrahieren. Nehmen wir als Beispiel ein Element mit einer Ordnungszahl von 8 und einer Massenzahl von 17. Daraus können Sie ableiten, dass dieses Element 8 Protonen, 8 Elektronen und 9 Neutronen hat (17-8=9). Nun möchte ich dir einen kleinen Denkanstoß geben. Wie bereits erwähnt, haben alle Atome eines bestimmten Elements die gleiche Anzahl von Protonen (Ordnungszahl), aber verschiedene Atome eines bestimmten Elements können eine unterschiedliche Anzahl von Neutronen haben. Man spricht dann von verschiedenen Isotopen des Elements. Zum Beispiel gibt es drei Isotope von Wasserstoff. Das häufigste Isotop, das 99,98 % aller Wasserstoffatome ausmacht, hat die Massenzahl 1, besteht also aus einem Proton, keinem Neutron und einem Elektron. Die anderen, weniger häufig vorkommenden Isotope des Wasserstoffs haben die Massenzahl 2 bzw. 3. Diese Isotope unterscheiden sich durch die Anzahl der Neutronen in ihren Kernen, aber alle drei haben ein Proton und ein Elektron. In Wirklichkeit gibt es von jedem Element natürlich vorkommende Isotope, von denen jedes seine eigene Massenzahl hat. In der chemischen Notation wird die Massenzahl für ein bestimmtes Isotop als hochgestellte Zahl vor dem Symbol für das Element angegeben. Die drei Isotope von Wasserstoff werden als 1H, 2H und 3H ausgedrückt. Da jedes Element aus mehreren Isotopen besteht, stellt sich die Frage: „Wie groß ist die tatsächliche Masse eines bestimmten Elements?“ Wenn Sie sich das obige Periodensystem ansehen, werden Sie unten in jedem Feld eine Zahl sehen. Dies ist die Atommasse für das jeweilige Element. Die Atommasse von Wasserstoff beträgt beispielsweise 1,00794 amu. Diese Zahl wurde durch Berechnung der durchschnittlichen Masse der 3 Isotope des Wasserstoffs ermittelt. Nehmen wir zum Beispiel an, wir hätten 10 Jungen in unserer Klasse. Wenn wir das Durchschnittsgewicht der Jungen wissen wollten, würden wir ihre Einzelgewichte addieren und dann die Summe durch 10 teilen. So erhalten wir ihr durchschnittliches Gewicht. So werden die Atomgewichte im Wesentlichen bestimmt. Da 1H das häufigste Isotop von Wasserstoff ist, macht es Sinn, dass das Atomgewicht für Wasserstoff sehr nahe an der Atommasse von 1H liegt.
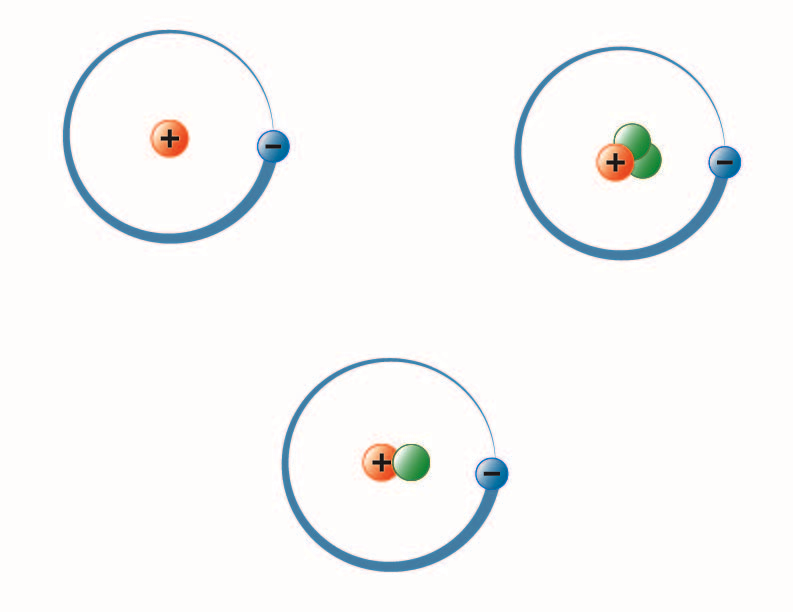
Bild erstellt von BYU-I Studentin Hannah Crowder Herbst 2013
Das Bild oben stellt die drei Isotope von Wasserstoff dar. Das häufigste (oben links) hat ein Proton und keine Neutronen im Kern. Deuterium (unten) hat ein Proton und ein Neutron und Tritium (oben rechts) hat ein Proton und zwei Neutronen.
**Sie können die Schaltflächen unten verwenden, um zur nächsten oder vorherigen Lektüre in diesem Modul zu gelangen**


Diese Seite drucken