Pyroxene sind die bedeutendste und am häufigsten vorkommende Gruppe der gesteinsbildenden Ferromagnesiumsilikate. Sie sind in fast allen magmatischen Gesteinen zu finden und kommen in Gesteinen unterschiedlichster Zusammensetzung vor, die unter den Bedingungen der Regional- und Kontaktmetamorphose entstanden sind. Der Name Pyroxen leitet sich vom griechischen pyro, „Feuer“, und xenos, „Fremder“, ab und wurde von Haüy für die grünlichen Kristalle in vielen Laven vergeben, die er als zufällige Einschlüsse ansah.
Die chemische Zusammensetzung der Minerale der Pyroxengruppe kann durch die allgemeine Formel ausgedrückt werden:
XYZ2O6
wobei X = Na+, Ca2+, Mn2+, Fe2+, Mg2+, Li+; Y = Mn2+, Fe2+, Mg2+, Fe3+, Al3+, Cr3+, Ti4+; und Z= Si4+, Al3+. Die Bandbreite der möglichen chemischen Substitutionen in Pyroxen wird durch die Größe der verfügbaren Plätze in der Struktur und die Ladung der substituierenden Kationen eingeschränkt. Die X-Kationenplätze sind im Allgemeinen größer als die Y-Kationenplätze. Zwischen den idealen Endglied-Zusammensetzungen findet eine umfangreiche atomare Substitution statt. Die meisten Pyroxene weisen nur eine begrenzte Substitution von Silicium durch Aluminium in der Z-Stelle (Tetraeder) auf. Wenn sich ein substituierendes Ion in der Ladung unterscheidet, wird die elektrische Neutralität durch gekoppelte Substitutionen aufrechterhalten. Zum Beispiel ersetzt das Paar aus Na+ und Al3+ 2Mg2+.
Die häufigsten Pyroxene können als Teil des chemischen Systems CaSiO3 (Wollastonit, ein Pyroxenoid), MgSiO3 (Enstatit) und FeSiO3 (Ferrosilith) dargestellt werden. (Abb.1). Da es keine echten Pyroxene gibt, deren Calciumgehalt höher ist als der der Diopsid-Hedenbergit-Verbindung, wird der Teil dieses Systems unterhalb dieser Verbindung als Pyroxenviereck bezeichnet.
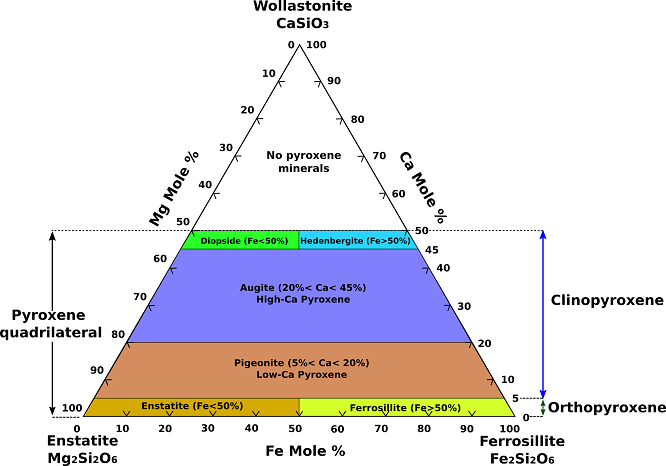
Abb.1Ternäres Zusammensetzungsdiagramm für Pyroxene.
Vollständige Substitution besteht zwischen Enstatit (Mg2Si2O6) und Ferrosilit (Fe2Si2O6), und vollständige feste Lösung von Eisen für Magnesium besteht zwischen Diopsid (CaMgSi2O6) und Hedenbergit (CaFeSi2O6). Augit, subcalcischer Augit und Pigeonit liegen im Inneren des Pyroxenvierecks. Von der Zusammensetzung her ist Augit mit Mitgliedern der Diopsid-Hedenbergit-Reihe verwandt, wobei Na+ in begrenztem Umfang durch Ca2+, Al3+ durch Mg2+ und Fe2+ sowie Al3+ durch Si4+ in der Z-Stelle (Tetraeder) ersetzt wird. Augite mit hohem Aluminium- oder Natriumgehalt lassen sich in der Vierecksebene nicht genau darstellen. Monokliner Pigeonit umfasst ein Feld von Magnesium-Eisen-Mischkristallen mit einem etwas höheren Kalziumgehalt als die orthorhombische Enstatit-Orthoferrosilit-Reihe.
Gekoppelte Substitutionen von Na+, Li+ oder Al3+ für Mg2+ in der Enstatit-Struktur ergeben Pyroxene, die außerhalb des viereckigen Zusammensetzungsfeldes liegen. Die gekoppelte Substitution von Na+ und Al3+ für 2Mg2+ in Enstatit ergibt das Pyroxen Jadeit. Die gekoppelte Substitution von Na+ und Fe3+ durch 2Mg2+ ergibt das Pyroxen Aegirin (Akmit). Die Substitution von 2Mg2+ durch Li+ und Al3+ führt zu Spodumen. Die Substitution von Mg2+ durch Al3+ und Si4+ durch Al3+ ergibt die ideale Tschermakitkomponente MgAlSiAlO6. Andere weniger häufige Pyroxene mit Zusammensetzungen außerhalb des Pyroxenvierecks sind Johannsenit und Kosmochlor (Ureyit). Bei Johannsenit wird Eisen durch Mangan im Hedenbergit ersetzt. Bei Kosmochlor tritt Chrom (Cr) anstelle von Eisen oder Aluminium in einem natriumhaltigen Pyroxen auf.
Bei hohen Temperaturen haben Pyroxene ausgedehntere Mischkristallfelder als bei niedrigeren Temperaturen. Folglich passt das Pyroxen bei sinkenden Temperaturen seine Zusammensetzung im festen Zustand an, indem es eine separate Phase in Form von Lamellen innerhalb des Pyroxenkorns herauslöst. Die Lamellen werden entlang bestimmter kristallographischer Richtungen herausgelöst, wodurch orientierte Verwachsungen mit Parallel- und Fischgrätenstruktur entstehen. Es gibt fünf Hauptkombinationen von Auflösungspaaren: (1) Augit mit Enstatit-Lamellen, (2) Augit mit Pigeonit-Lamellen, (3) Augit mit Pigeonit- und Enstatit-Lamellen, (4) Pigeonit mit Augit-Lamellen und (5) Enstatit mit Augit-Lamellen.
Die Pyroxene unterscheiden sich in ihrer Zusammensetzung in zwei wesentlichen Punkten von den Amphibolen. Pyroxene enthalten in ihrer Struktur kein wesentliches Wasser in Form von Hydroxylgruppen, während Amphibole als wasserhaltige Silikate gelten. Der zweite wichtige chemische Unterschied zwischen den beiden ist das Vorhandensein der A-Stelle in Amphibolen, die die großen Alkalielemente, typischerweise Natrium und manchmal Kalium, enthält; die Pyroxene haben keine entsprechende Stelle, die Kalium aufnehmen kann.
Struktur
Die Pyroxengruppe umfasst Minerale, die sich sowohl im orthorhombischen als auch im monoklinen Kristallsystem bilden. Orthorhombische Pyroxene werden als Orthopyroxene bezeichnet, monokline Pyroxene als Klinopyroxene. Das wesentliche Merkmal aller Pyroxenstrukturen ist die Verknüpfung der Silizium-Sauerstoff-Tetraeder (SiO4), die sich zwei der vier Ecken teilen und so kontinuierliche Ketten bilden. Die Ketten, die sich unbegrenzt parallel zur c-kristallographischen Achse erstrecken, haben die Zusammensetzung (Si2O6) (Abb.2). Ein Wiederholungsabstand von etwa 5,3 Å entlang der Kettenlänge definiert die c-Achse der Einheitszelle. Die Si2O6-Ketten sind an eine Schicht von oktaedrisch koordinierten Kationenbändern gebunden, die sich ebenfalls parallel zur c-Achse erstrecken.
.png)
Abb.2: Schematische Darstellung der einkettigen Pyroxenstruktur. Wo sich zwei Tetraeder berühren, teilen sie sich ein Sauerstoffion. Aus Wikipedia
Die Oktaederstreifen bestehen aus M1- und M2-Oktaedern, die zwischen zwei entgegengesetzt ausgerichteten Tetraederketten liegen. Die M1-Stellen werden von kleineren Kationen wie Magnesium, Eisen, Aluminium und Mangan besetzt, die an sechs Sauerstoffatome koordiniert sind und ein regelmäßiges Oktaeder bilden. In monoklinen Pyroxenen ist die M2-Stelle ein großes unregelmäßiges Polyeder, das von den größeren Kalzium- und Natriumkationen besetzt ist, die in achtfacher Koordination vorliegen. In den orthorhombischen Pyroxenen mit niedrigem Kalziumgehalt enthält M2 Magnesium und Eisen, und das Polyeder nimmt eine regelmäßigere oktaedrische Form an. Der Kationenstreifen M1 ist an die Sauerstoffatome zweier entgegengesetzt gerichteter tetraedrischer Ketten gebunden (Abb.3). Zusammen bilden sie ein tetraedrisch-oktaedrisch-tetraedrisches (t-o-t) Band. Eine schematische Projektion der Pyroxenstruktur senkrecht zur c-Achse und die Beziehung der Pyroxenspaltung zu den t-o-t-Streifen oder I-Balken ist in Abb.3 dargestellt.
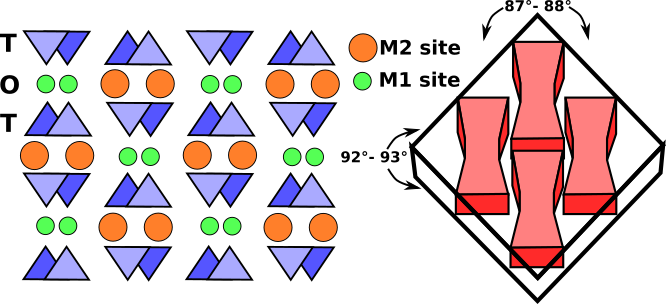
Abb.3: Schematische Projektion der monoklinen Pyroxenstruktur senkrecht zur c-Achse. T-O-T-Streifen, so genannte I-Balken, haben sehr starke Bindungen, die einem Bruch widerstehen und die für Pyroxene typische Spaltung von nahezu 90° bewirken (gestrichelte Linien).
Im Dünnschliff zeichnen sich monokline Pyroxene durch zwei Spaltrichtungen bei etwa 87° und 93°, achtseitige Basalquerschnitte und hellbraune oder grüne Farbe aus. Orthorhombische Pyroxene unterscheiden sich von monoklinen Pyroxenen durch eine parallele Auslöschung.
Bibliographie
– Cox et al. (1979): The Interpretation of Igneous Rocks, George Allen and Unwin, London.
– Howie, R. A., Zussman, J., & Deer, W. (1992). An introduction to the rock-forming minerals (S. 696). Longman.
– Le Maitre, R. W., Streckeisen, A., Zanettin, B., Le Bas, M. J., Bonin, B., Bateman, P., & Lameyre, J. (2002). Igneous rocks. A classification and glossary of terms, 2. Cambridge University Press.
– Middlemost, E. A. (1986). Magmas and magmatic rocks: an introduction to igneous petrology.
– Shelley, D. (1993). Igneous and metamorphic rocks under the microscope: classification, textures, microstructures and mineral preferred-orientations.
– Vernon, R. H. & Clarke, G. L. (2008): Principles of Metamorphic Petrology. Cambridge University Press.