T-regulatorische Zellen (Tregs), die früher als T-Suppressorzellen bezeichnet wurden, sind eine Untergruppe von T-Zellen, die eine direkte Rolle sowohl bei der Autoimmunität als auch bei der Reaktion auf Krankheitserreger spielen.
Tregs vermindern Entzündungen durch die Sekretion immunsuppressiver Zytokine (IL-10, TGF-b) und auch durch die direkte Unterdrückung entzündlicher Effektor-T-Zellen (wie Th1- und Th17-Zellen).
Tregs kontrollieren und verhindern wahrscheinlich Autoimmunerkrankungen, indem sie zur Aufrechterhaltung der Toleranz gegenüber Selbstantigenen beitragen. Der therapeutische Nutzen des Treg-Transfers ist in Tiermodellen gut belegt, und es gibt Bestrebungen, Treg-Therapien beim Menschen für Transplantationen und Typ-1-Diabetes-Patienten zu beginnen.
Angesichts der Bedeutung dieser einzigartigen T-Zell-Untergruppe bei so vielen Immunreaktionen fühlen sich viele Forscher nachlässig, wenn sie ihre Zellpopulationen von Interesse immunphänotypisieren, ohne eine Treg-Messung in den Mix einzubeziehen. Aber die Quantifizierung von Tregs kann kompliziert sein.
Was sind zum Beispiel die besten Marker, die man verwenden kann? Wie kann man sicher sein, dass man echte Suppressor-T-Zellen misst?
Gating-Strategien für die Definition von Tregs durch Durchflusszytometrie
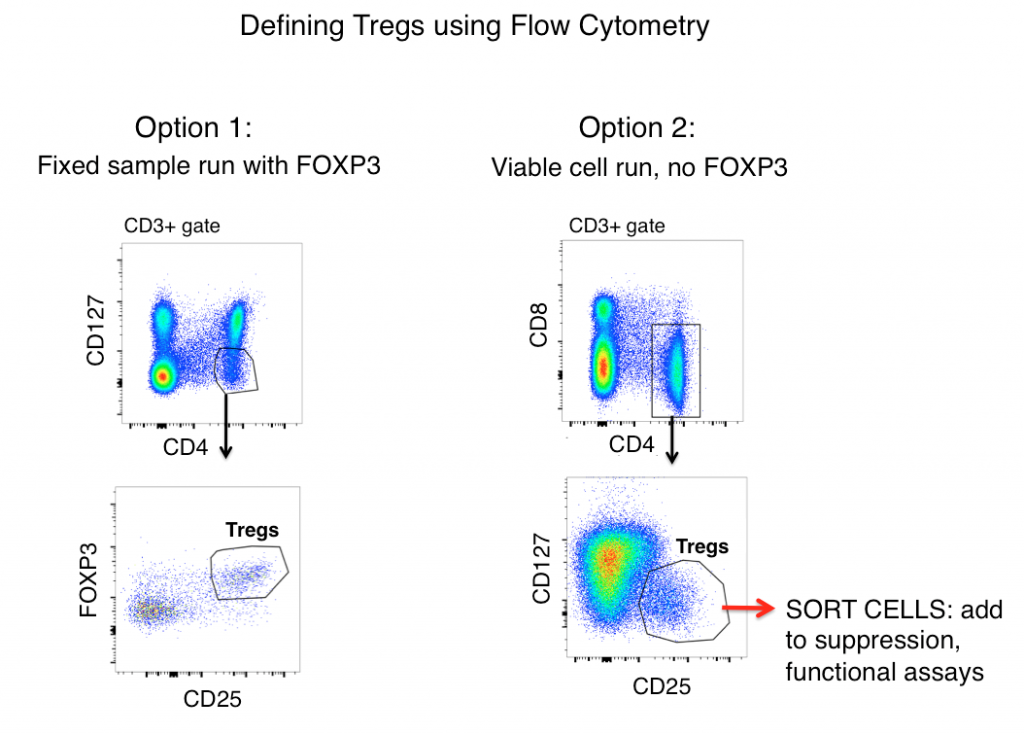
Die Standard-Treg-Gating-Strategie für Maus- und Humanproben (nach dem ersten Gating von Doubletten und dem Gating auf lebenden Zellen) umfasst die Antigene CD3, CD4, CD25, FOXP3 und CD127.
Bei ausschließlicher Betrachtung der Antigenexpression werden Tregs häufig als CD3+, CD4+, CD25hi, FOXP3+ und CD127lo definiert (in der Abbildung unten als Option 1 dargestellt). Anhand dieser Marker lässt sich in Proben wie Mäusesplenozyten und humanen PBMC oft eine eindeutige Population erkennen.
Allerdings regulieren aktivierte T-Zellen häufig CD25 hoch, und die Expression von FOXP3 wurde bei „Effektor“- (nicht-suppressiven) T-Zelllinien festgestellt. Wenn man sich also bei der Definition von Tregs allein auf die durchflusszytometrische Phänotypisierung verlässt, könnten entzündliche T-Zellen ein Wolf im Schafspelz (Treg) sein und zu einer falschen Interpretation der Daten führen.
Eine Zelle mag wie eine Ente aussehen, aber quakt sie auch? Die Messung der Effektor-Funktionen Ihrer möglichen Treg-Population wird wesentlich dazu beitragen, die Genauigkeit Ihrer Flow-Gating-Strategie zu klären. Um festzustellen, ob die Zellen, die Sie als Tregs definieren, diesen funktionell ähneln, beinhaltet Option 2 (siehe unten) das Weglassen von FOXP3 aus Ihrem Panel, die Sortierung von CD3+, CD4+, CD25hi, CD127lo Zellen und die anschließende Bestimmung der Funktionen Ihrer „Treg“-Population mittels Zytokinanalyse und/oder Suppressions-Co-Kultur-Assays mit Nicht-Treg-T-Zellen (CD3+ CD4+ CD25-, CD127hi). Typischerweise kann FOXP3 nicht in Panels einbezogen werden, bei denen lebensfähige Zellen nach der Sortierung benötigt werden, da eine intrazelluläre Färbung erforderlich ist.
Definieren der zunehmenden Vielfalt von Treg-Untergruppen
Es gibt viele Arten von Tregs, einschließlich tTregs, pTregs und iTregs.
Zum Beispiel werden tTregs (auch nTregs genannt) im Thymus gebildet und haben ein TcR-Repertoire, das auf Selbstpeptide ausgerichtet ist. Eine andere Variante, die so genannten pTregs, werden in der Peripherie gebildet, und iTregs werden in der Kultur durch TGF-b induziert.
Es gibt Hersteller, die mit diesen verschiedenen Treg-Untergruppen assoziiert sind, und sie sollten für die Aufnahme in ein Treg-Antikörper-Panel in Betracht gezogen werden, wenn ihre Unterteilung von Interesse ist. Beim Menschen gilt zum Beispiel CD39 als zuverlässiger tTreg-Marker. Außerdem hat sich gezeigt, dass Helios sowohl bei Mäusen als auch bei Menschen tTregs zuverlässig von den p- und iTreg-Untergruppen unterscheiden kann.
Eine einzelne Zelle als Treg zu definieren – ist das möglich?
Eine wesentliche Einschränkung auf dem Gebiet der Tregs ist das Fehlen eines Assays zur Unterdrückung einzelner Zellen.
Die Definition einer einzelnen T-Zelle als Mitglied einer bestimmten Gedächtnislinie, wie z. B. Th1, Th2 oder Th17, kann über eine Analyse mit Einzelzellauflösung, wie z. B. intrazelluläre Zytokinfärbung, erfolgen, da diese Zellen in erster Linie, wenn nicht ausschließlich, durch die von ihnen produzierten Zytokine definiert werden.
Um jedoch nachzuweisen, dass es sich bei einer einzelnen Zelle um eine Treg-Zelle handelt, müssen wir idealerweise in der Lage sein zu quantifizieren, dass diese eine ausgewählte Zelle die Funktion von Effektor-T-Zellen (oder anderen Zelluntergruppen) in der Ko-Kultur unterdrücken kann. Derzeit ist die einzige Möglichkeit, die unterdrückende Funktion von Tregs zu testen, eine Massenkultur, aus der man schließen kann, dass einige (aber nicht alle, möglicherweise nicht einmal die meisten) der als Tregs bezeichneten Zellen unterdrückend sind.
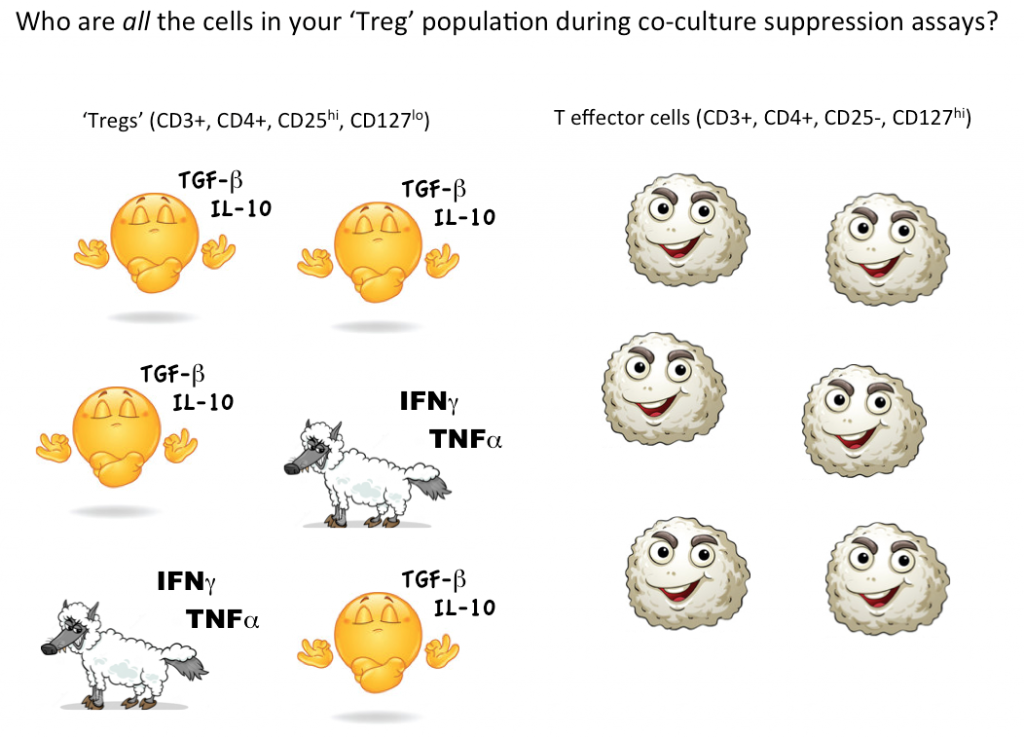
Wenn wir noch einmal an die potenziellen „Effektor-T-Zellen“-Wölfe im Schafspelz denken, wissen wir einfach nicht, wie viele nicht unterdrückende, sogar entzündliche Zellen sich in unserer Treg-Gating-Strategie verstecken. Die Verwendung der Durchflusszytometrie, um zunächst lebensfähige Zellen mit Markern, die mit Tregs übereinstimmen, zu erkennen und zu sortieren und dann funktionell zu testen, ob sich die durch Ihre Gating-Strategie definierten Zellen als Gruppe tatsächlich wie Tregs verhalten, ist derzeit der beste Weg, um Tregs in Ihrer Probe zu quantifizieren.
Indem Sie die richtigen Gating-Strategien für die Definition von Tregs durch die Durchflusszytometrie anwenden und die wachsende Zahl von Treg-Untergruppen berücksichtigen, können Sie die Treg-Populationen, die Sie interessieren, herausfiltern. Der Schlüssel liegt darin, diese Populationen nach ihrer Identifizierung funktionell zu testen, denn derzeit ist es schwierig, wenn nicht gar unmöglich, eine einzelne Zelle als Treg zu definieren. Es werden jedoch täglich Fortschritte gemacht, und irgendwann wird es möglich sein, einzelne Treg-Zellen korrekt zu kennzeichnen.
Um mehr über die Analyse von T-Zellen und anderen Zelltypen mit Hilfe der Durchflusszytometrie zu erfahren und um Zugang zu allen unseren fortgeschrittenen Materialien zu erhalten, einschließlich 20 Schulungsvideos, Präsentationen, Arbeitsbüchern und privater Gruppenmitgliedschaft, setzen Sie sich auf die Warteliste der Flow Cytometry Mastery Class.
