Generischer Name: Naftifine Hydrochlorid
Dosierung Form: Creme
Medically reviewed by Drugs.com. Last updated on Jan 1, 2021.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professionell
- Schwangerschaft
- Mehr
Indikationen und Anwendung von Naftifin Creme
Naftifinhydrochlorid Creme ist indiziert für die Behandlung von Tinea pedis interdigital, Tinea cruris und Tinea corporis, verursacht durch den Organismus Trichophyton rubrum.
Naftifin Creme Dosierung und Anwendung
Nur zur äußerlichen Anwendung. Naftifinhydrochlorid-Creme ist nicht zur ophthalmischen, oralen oder intravaginalen Anwendung bestimmt. Tragen Sie eine dünne Schicht von Naftifinhydrochlorid-Creme einmal täglich auf die betroffenen Stellen plus einen ½ Zoll breiten Rand der gesunden umgebenden Haut für 2 Wochen auf.
Dosierungsformen und Stärken
Jedes Gramm enthält 20 mg Naftifinhydrochlorid (2 %) in einer weißen bis gebrochen weißen Grundlage.
Kontraindikationen
Keine
Warnungen und Vorsichtsmaßnahmen
Lokale unerwünschte Reaktionen
Setzen Sie die Behandlung ab, wenn sich bei der Anwendung von Naftifinhydrochlorid-Creme Reizungen oder Empfindlichkeit entwickeln. Weisen Sie die Patienten an, sich mit ihrem Arzt in Verbindung zu setzen, wenn sich diese Zustände nach der Anwendung von Naftifinhydrochlorid-Creme entwickeln.
Nebenwirkungen
Erfahrungen aus klinischen Studien
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, können die in den klinischen Studien eines Arzneimittels beobachteten Nebenwirkungsraten nicht direkt mit den Raten in den klinischen Studien eines anderen Arzneimittels verglichen werden und spiegeln möglicherweise nicht die in der klinischen Praxis beobachteten Raten wider.
Während der klinischen Studien wurden 903 Probanden mit Naftifin 1% und 2% Cremeformulierungen behandelt. Insgesamt wurden 564 Probanden mit interdigitaler Tinea pedis, Tinea cruris oder Tinea corporis mit Naftifinhydrochlorid-Creme behandelt.
In zwei randomisierten, Vehikel-kontrollierten Studien (400 Probanden wurden mit Naftifinhydrochlorid-Creme behandelt). Die Probanden waren 12 bis 88 Jahre alt, überwiegend männlich (79 %), 48 % Kaukasier, 36 % Schwarze oder Afroamerikaner, 40 % Hispano- oder Latinoamerikaner und litten entweder überwiegend an Tinea pedis interdigitalis oder Tinea cruris. Die meisten Probanden erhielten 2 Wochen lang einmal täglich topische Dosen, um die betroffenen Hautbereiche plus einen ½ Zoll Rand der umgebenden gesunden Haut abzudecken. In den beiden Vehikel-kontrollierten Studien traten bei 17,5 % der mit Naftifinhydrochlorid-Creme behandelten Probanden unerwünschte Wirkungen auf, verglichen mit 19,3 % der Probanden, die das Vehikel erhielten. Die häufigste unerwünschte Reaktion (größer oder gleich 1 %) war Juckreiz. Die meisten unerwünschten Wirkungen waren leicht ausgeprägt. Die Häufigkeit der Nebenwirkungen in der mit Naftifinhydrochlorid-Creme behandelten Population unterschied sich nicht signifikant von der mit dem Vehikel behandelten Population.
In einer dritten randomisierten, Vehikel-kontrollierten Studie wurden 116 pädiatrische Patienten mit Tinea corporis mit Naftifinhydrochlorid-Creme behandelt. Die Population war zwischen 2 und 18 Jahren alt (Durchschnittsalter 9 Jahre), überwiegend männlich (61 %), 47 % weiß, 51 % schwarz oder afroamerikanisch, 92 % hispanisch oder lateinamerikanisch und mit Tinea corporis infiziert. Naftifinhydrochlorid-Creme wurde einmal täglich über einen Zeitraum von 2 Wochen auf alle befallenen Körperstellen mit Tinea corporis sowie auf einen ½ Zoll breiten Rand gesunder Haut um die befallenen Läsionen aufgetragen. Die Häufigkeit von Nebenwirkungen in der mit Naftifinhydrochlorid-Creme behandelten Population unterschied sich nicht signifikant von der mit dem Vehikel behandelten Population.
In zwei offenen pädiatrischen Pharmakokinetik- und Sicherheitsstudien erhielten 49 pädiatrische Probanden im Alter von 2 bis unter 18 Jahren mit interdigitaler Tinea pedis, Tinea cruris und Tinea corporis Naftifinhydrochlorid-Creme. Die Inzidenz der Nebenwirkungen in der pädiatrischen Population war ähnlich wie in der erwachsenen Population.
Postmarketing-Erfahrungen
Die folgenden Nebenwirkungen wurden während der Anwendung von Naftifinhydrochlorid nach der Zulassung festgestellt: Rötung/Reizung, Entzündung, Mazeration, Schwellung, Brennen, Blasen, seröser Ausfluss, Krustenbildung, Kopfschmerzen, Schwindel, Leukopenie, Agranulozytose.
Da diese Reaktionen freiwillig aus einer Population von ungewisser Größe gemeldet werden, ist es nicht immer möglich, ihre Häufigkeit zuverlässig abzuschätzen oder einen kausalen Zusammenhang mit der Arzneimittelexposition herzustellen.
VERWENDUNG IN BESONDEREN POPULATIONEN
Schwangerschaft
Risiko-Zusammenfassung
Es liegen keine Daten über die Anwendung von Naftifinhydrochlorid-Creme bei schwangeren Frauen vor, die Aufschluss über das arzneimittelassoziierte Risiko für schwere Geburtsfehler und Fehlgeburten geben. In tierexperimentellen Reproduktionsstudien wurden bei oralen Dosen, die während der Organogenese bei trächtigen Ratten bis zum 18-fachen der maximal empfohlenen Humandosis (MRHD) verabreicht wurden, oder bei subkutanen Dosen, die während der Organogenese bei trächtigen Ratten bis zum 2-fachen der MRHD und bei trächtigen Kaninchen bis zum 4-fachen der MRHD verabreicht wurden, keine nachteiligen Auswirkungen auf die embryofetale Entwicklung beobachtet.
Das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten ist für die angegebene Population nicht bekannt. Alle Schwangerschaften haben ein Hintergrundrisiko für Geburtsfehler, Fehlgeburten oder andere unerwünschte Ergebnisse. In der Allgemeinbevölkerung der USA liegt das geschätzte Hintergrundrisiko für schwere Geburtsfehler und Fehlgeburten bei klinisch anerkannten Schwangerschaften bei 2% bis 4% bzw. 15% bis 20%.
Daten
Tierdaten
Systemische Studien zur embryofetalen Entwicklung wurden an Ratten und Kaninchen durchgeführt. Für den Vergleich von Tier- und Humandosen auf der Grundlage des Vergleichs der Körperoberfläche (mg/m2) wird das MRHD auf 8 g 2% Creme pro Tag (2,67 mg/kg/Tag für ein 60 kg schweres Individuum) festgelegt.
Orale Dosen von 30, 100 und 300 mg/kg/Tag Naftifinhydrochlorid wurden trächtigen weiblichen Ratten während des Zeitraums der Organogenese verabreicht. Bei Dosen bis zu 300 mg/kg/Tag (18-fache MRHD) wurden keine behandlungsbedingten Auswirkungen auf die embryofetale Entwicklung festgestellt. Subkutane Dosen von 10 und 30 mg/kg/Tag Naftifinhydrochlorid wurden trächtigen weiblichen Ratten während des Zeitraums der Organogenese verabreicht. Bei 30 mg/kg/Tag (2-fache MRHD) wurden keine behandlungsbedingten Auswirkungen auf die embryofetale Entwicklung festgestellt. Subkutane Dosen von 3, 10 und 30 mg/kg/Tag Naftifinhydrochlorid wurden trächtigen weiblichen Kaninchen während des Zeitraums der Organogenese verabreicht. Bei 30 mg/kg/Tag (4-fache MRHD) wurden keine behandlungsbedingten Auswirkungen auf die embryofetale Entwicklung festgestellt.
Eine Studie zur peri- und postnatalen Entwicklung wurde an Ratten durchgeführt. Orale Dosen von 30, 100 und 300 mg/kg/Tag Naftifinhydrochlorid wurden weiblichen Ratten vom Trächtigkeitstag 14 bis zum 21. Bei 300 mg/kg/Tag (18-fache MRHD) wurde eine verringerte Körpergewichtszunahme der Weibchen während der Trächtigkeit und der Nachkommen während der Laktation festgestellt. Bei 100 mg/kg/Tag (das 6-fache der MRHD) wurde keine Entwicklungstoxizität festgestellt.
Stillzeit
Risikozusammenfassung
Es liegen keine Informationen über das Vorhandensein von Naftifinhydrochlorid-Creme in der menschlichen Milch, die Auswirkungen des Arzneimittels auf den gestillten Säugling oder die Auswirkungen des Arzneimittels auf die Milchproduktion vor. Das Fehlen klinischer Daten während der Stillzeit schließt eine eindeutige Bestimmung des Risikos von Naftifinhydrochlorid-Creme für einen Säugling während der Stillzeit aus; daher sollten die Entwicklung und die gesundheitlichen Vorteile des Stillens zusammen mit dem klinischen Bedarf der Mutter an Naftifinhydrochlorid-Creme und möglichen nachteiligen Auswirkungen von Naftifinhydrochlorid-Creme oder der mütterlichen Grunderkrankung auf den gestillten Säugling berücksichtigt werden.
Anwendung in der Pädiatrie
Die Sicherheit und Wirksamkeit von Naftifinhydrochlorid-Creme wurde bei pädiatrischen Patienten ab 12 Jahren mit Tinea pedis interdigitalis und Tinea cruris und ab 2 Jahren mit Tinea corporis nachgewiesen.
Die Verwendung von Naftifinhydrochlorid-Creme in diesen Altersgruppen wird durch Nachweise aus adäquaten und gut kontrollierten Studien bei Erwachsenen und Kindern gestützt, mit zusätzlichen Sicherheits- und PK-Daten aus zwei Open-Label-Studien, die an 49 pädiatrischen Probanden durchgeführt wurden, die mit Naftifinhydrochlorid-Creme behandelt wurden.
Die Sicherheit und Wirksamkeit von Naftifinhydrochlorid-Creme bei der Behandlung von Tinea cruris und interdigitaler Tinea pedis bei pädiatrischen Patienten unter 12 Jahren wurde nicht nachgewiesen. Die Sicherheit und Wirksamkeit von Naftifinhydrochlorid-Creme bei der Behandlung von Tinea corporis bei pädiatrischen Patienten unter 2 Jahren sind nicht erwiesen.
Geriatrische Anwendung
Klinische Studien mit Naftifinhydrochlorid-Creme schlossen nicht genügend Probanden im Alter von 65 Jahren und darüber ein, um festzustellen, ob sie anders reagieren als jüngere Probanden.
Naftifin-Creme Beschreibung
Naftifinhydrochlorid-Creme, USP ist eine weiße bis gebrochen-weiße Creme zur äußerlichen Anwendung. Jedes Gramm enthält 20 mg Naftifinhydrochlorid, USP, (2%), eine synthetische Allylamin-Antimykotikum-Verbindung.
Chemisch gesehen ist Naftifin-HCl (E)-N-Cinnamyl-N-methyl-1-napthalenemethylamin-Hydrochlorid.
Die Summenformel ist C21H21N-HCl mit einem Molekulargewicht von 323,86.
Die Strukturformel von Naftifinhydrochlorid, USP, lautet:
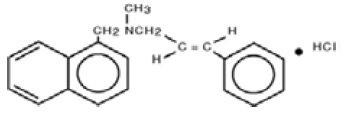
Naftifinhydrochloridcreme, USP, enthält die folgenden inaktiven Bestandteile: Benzylalkohol, Cetylalkohol, Cetylesterwachs, Isopropylmyristat, Polysorbat 60, gereinigtes Wasser, Natriumhydroxid, Sorbitanmonostearat und Stearylalkohol. Salzsäure kann hinzugefügt werden, um den pH-Wert einzustellen.
Naftifin-Creme – Klinische Pharmakologie
Wirkungsmechanismus
Naftifinhydrochlorid-Creme ist ein topisches Antimykotikum.
Pharmakodynamik
Die Pharmakodynamik von Naftifinhydrochlorid-Creme ist nicht bekannt.
Pharmakokinetik
In vitro- und in vivo-Bioverfügbarkeitsstudien haben gezeigt, dass Naftifin das Stratum corneum in ausreichender Konzentration durchdringt, um das Wachstum von Dermatophyten zu hemmen.
Die Pharmakokinetik von Naftifinhydrochlorid-Creme wurde nach einmal täglicher topischer Anwendung über 2 Wochen bei 21 erwachsenen männlichen und weiblichen Probanden mit Tinea pedis und Tinea cruris untersucht. Die mediane Gesamtmenge der aufgetragenen Creme betrug 6,4 g (Bereich 5,3 g bis 7,5 g) pro Tag. Die Ergebnisse zeigten, dass die systemische Exposition (d. h. die maximale Konzentration (Cmax) und die Fläche unter der Kurve von 0 bis 24 Stunden (AUC0-24)) gegenüber Naftifin bei allen 21 Probanden während des zweiwöchigen Behandlungszeitraums anstieg. Der geometrische Mittelwert (Variationskoeffizient oder CV%) der AUC0-24 betrug 117 (41,2) ng*hr/ml an Tag 1 und 204 (28,5) ng*hr/ml an Tag 14. Der geometrische Mittelwert (CV %) der Cmax betrug 7 ng/ml (55,6) an Tag 1 und 11 ng/ml (29,3) an Tag 14. Die mediane Zeit bis zur Cmax (Tmax) betrug 8 Stunden (Bereich 4 bis 24 Stunden) an Tag 1 und 6 Stunden (Bereich 0 bis 16 Stunden) an Tag 14. Die Akkumulation nach 14 Tagen topischer Anwendung betrug weniger als das Zweifache. Die Trogkonzentrationen stiegen im Allgemeinen während des 14-tägigen Studienzeitraums an. Naftifin wurde bei 13/21 (62 %) Probanden am Tag 28 weiterhin im Plasma nachgewiesen, die mittleren Plasmakonzentrationen (Standardabweichung oder SD) betrugen 1,6 ± 0,5 ng/ml (Bereich unterhalb der Bestimmungsgrenze (BLQ) bis 3 ng/ml). In derselben pharmakokinetischen Studie, die bei Patienten mit Tinea pedis und Tinea cruris durchgeführt wurde, betrug der mediane Anteil der Dosis, der während des Behandlungszeitraums im Urin ausgeschieden wurde, 0,0016 % an Tag 1 gegenüber 0,0020 % an Tag 14.
In einer zweiten Studie, an der 22 Probanden teilnahmen, wurde die Pharmakokinetik von Naftifinhydrochlorid-Creme bei 20 pädiatrischen Probanden im Alter von 13 bis unter 18 Jahren mit sowohl Tinea pedis als auch Tinea cruris untersucht. Die Probanden wurden mit einer mittleren Dosis von 8,1 g (Bereich 6,6 g bis 10,1 g) behandelt, die 2 Wochen lang einmal täglich auf die betroffenen Stellen aufgetragen wurde. Die Ergebnisse zeigten, dass die systemische Exposition während des Behandlungszeitraums zunahm. Der geometrische Mittelwert (CV%) der AUC0-24 betrug 138 (50,2) ng*hr/ml an Tag 1 und 192 (74,9) ng*hr/ml an Tag 14. Der geometrische Mittelwert (CV %) der Cmax betrug 9,21 ng/ml (48,4) an Tag 1 und 12,7 ng/ml (67,2) an Tag 14. Der mittlere Anteil der während des Behandlungszeitraums im Urin ausgeschiedenen Dosis betrug 0,0030 % an Tag 1 und 0,0033 % an Tag 14.
In einer dritten Studie wurde die Pharmakokinetik von Naftifinhydrochlorid-Creme bei 27 pädiatrischen Probanden im Alter von 2 bis unter 12 Jahren mit mindestens mittelschwerer Tinea corporis untersucht. Die Probanden wurden in jüngere (2 bis weniger als 6 Jahre, 17 Probanden) und ältere (6 bis weniger als 12 Jahre, 10 Probanden) Gruppen eingeteilt. Die mittleren Dosen von 1,3 g (Spanne von 1 g bis 3,1 g) und 2,3 g (Spanne von 2,2 g bis 4,2 g) wurden in der jüngeren bzw. älteren Gruppe einmal täglich über einen Zeitraum von 2 Wochen auf den betroffenen Bereich plus einen ½ Zoll Rand aufgetragen. Die pharmakokinetische Bewertung von Plasma und Urin wurde nur in der älteren Gruppe an Tag 1 und in beiden Gruppen an Tag 14 durchgeführt. Alle Probanden wiesen nach der topischen Anwendung von Naftifinhydrochlorid-Creme messbare Naftifin-Spiegel im Plasma auf. Nach einer Einzeldosis an Tag 1 bei Probanden im Alter von 6 bis unter 12 Jahren betrugen die geometrischen Mittelwerte (CV%) von Cmax und AUC0-24 3,60 (76,6) ng/ml bzw. 49,8 (64,4) ng*h/ml. An Tag 14 betrugen in dieser Gruppe die Cmax und die AUC0-24 3,31 (51,2) ng/mL bzw. 52,4 (49,2) ng*h/mL. Bei den Probanden im Alter von 2 bis unter 6 Jahren betrugen die Cmax und die AUC0-24 an Tag 14 3,98 (186) ng/mL bzw. 54,8 (150) ng*h/mL. In der älteren Gruppe von Probanden im Alter von 6 bis 12 Jahren waren die systemischen Expositionen (sowohl Cmax als auch AUC0-24) an Tag 1 und 14 vergleichbar. Der mediane Anteil der Dosis, der über 24 Stunden nach der Anwendung des Arzneimittels an Tag 1 und Tag 14 in den Urin ausgeschieden wurde, betrug 0,0029 % bzw. 0,0014 %.
Mikrobiologie
Obwohl der genaue Wirkmechanismus gegen Pilze nicht bekannt ist, scheint Naftifinhydrochlorid die Sterinbiosynthese durch Hemmung des Enzyms Squalen2,3-Epoxidase zu beeinträchtigen.Diese Hemmung der Enzymaktivität führt zu verminderten Mengen an Sterolen, insbesondere Ergosterol, und zu einer entsprechenden Anreicherung von Squalen in den Zellen.
Mechanismus der Resistenz
Bis heute wurde kein Mechanismus der Resistenz gegen Naftifin identifiziert.
Naftifin hat sich gegen die meisten Isolate der folgenden Pilze sowohl in vitro als auch bei klinischen Infektionen als wirksam erwiesen, wie im Abschnitt INDIKATIONEN UND ANWENDUNG beschrieben:
Trichophyton rubrum
Nichtklinische Toxikologie
Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
In einer 2-Jahres-Studie zur dermalen Karzinogenität wurde Naftifinhydrochlorid-Creme Sprague-Dawley-Ratten in topischen Dosen von 1%, 2% und 3% (10, 20 und 30 mg/kg/Tag Naftifinhydrochlorid) verabreicht. In dieser Studie wurden keine arzneimittelbedingten Tumore bis zur höchsten in dieser Studie untersuchten Dosis von 30 mg/kg/Tag (das 12-fache der MRHD auf der Grundlage des AUC-Vergleichs) festgestellt.
Naftifinhydrochlorid ergab keine Hinweise auf ein mutagenes oder klastogenes Potenzial, basierend auf den Ergebnissen von zwei In-vitro-Genotoxizitätstests (Ames-Assay und Chromosomenaberrationstest an Ovarialzellen des chinesischen Hamsters) und einem In-vivo-Genotoxizitätstest (Mikronukleustest am Knochenmark der Maus).
Die orale Verabreichung von Naftifinhydrochlorid an Ratten während der Paarung, Trächtigkeit, Geburt und Laktation zeigte bei Dosen bis zu 100 mg/kg/Tag (6-fache MRHD) keine Auswirkungen auf Wachstum, Fruchtbarkeit oder Reproduktion.
Klinische Studien
Tinea Cruris
Naftifinhydrochlorid-Creme wurde in einer randomisierten, doppelblinden, Vehikel-kontrollierten, multizentrischen Studie an 146 Probanden mit symptomatischer und Dermatophytenkultur-positiver Tinea Cruris auf Sicherheit und Wirksamkeit untersucht. Die Probanden wurden nach dem Zufallsprinzip für die Behandlung mit Naftifinhydrochlorid-Creme oder Vehikel ausgewählt. Die Probanden trugen Naftifinhydrochlorid-Creme oder Vehikel einmal täglich über einen Zeitraum von 2 Wochen auf die betroffene Stelle sowie auf einen ½-Zoll-Rand der gesunden Haut um die betroffene Stelle auf. Anzeichen und Symptome der Tinea cruris (Vorhandensein oder Fehlen von Erythem, Juckreiz und Schuppung) wurden bewertet, und eine KOH-Untersuchung und eine Dermatophytenkultur wurden zum primären Wirksamkeitsendpunkt in Woche 4 durchgeführt.
Das Durchschnittsalter der Studienpopulation betrug 47 Jahre, 87 % waren männlich und 43 % waren weiß. Bei Studienbeginn wurden bei den Probanden Anzeichen und Symptome einer Tinea cruris, eine positive KOH-Untersuchung und das Vorhandensein von Dermatophyten anhand von Kulturergebnissen aus einem zentralen Mykologielabor bestätigt. Die Analyse der Intent-to-treat-Population bestand aus einem Vergleich des Anteils der Probanden mit einer vollständigen Heilung bei der Visite in Woche 4 (siehe Tabelle 1). Vollständige Heilung war definiert als sowohl klinische Heilung (Abwesenheit von Erythem, Juckreiz und Schuppung) als auch mykologische Heilung (negative KOH- und Dermatophytenkulturen).
Der Prozentsatz der Probanden mit klinischer Heilung und der Prozentsatz der Probanden mit mykologischer Heilung in Woche 4 sind in Tabelle 1 unten einzeln aufgeführt.
|
Endpunkt |
Naftifine Hydrochloride Cream, 2% |
Vehikel |
|
N=75 |
N=71 |
|
|
Komplette Curea |
19 (25%) |
2 (3%) |
|
Effektive Behandlungb |
45 (60%) |
7 (10%) |
|
Mykologische Heilung |
54 (72%) |
11 (16%) |
|
a. Vollständige Heilung ist ein zusammengesetzter Endpunkt, der sowohl die mykologische Heilung als auch die klinische Heilung umfasst. Klinische Heilung ist definiert als das Fehlen von Erythem, Juckreiz und Schuppung (Grad 0). |
||
|
b. Eine wirksame Behandlung ist ein negatives KOH-Präparat und eine negative Dermatophytenkultur, Erythem, Schuppung und Juckreiz mit einem Grad von 0 oder 1 (nicht oder fast nicht vorhanden). |
||
|
c. Mykologische Heilung ist definiert als negative KOH- und Dermatophytenkultur. |
||
Interdigitale Tinea pedis
Naftifinhydrochlorid-Creme wurde in einer randomisierten, doppelblinden, Vehikel-kontrollierten, multizentrischen Studie bei 217 Probanden mit symptomatischer und Dermatophytenkultur-positiver interdigitaler Tinea pedis auf ihre Wirksamkeit untersucht. Die Probanden erhielten nach dem Zufallsprinzip entweder Naftifinhydrochlorid-Creme oder Vehikel. Die Probanden trugen Naftifinhydrochlorid-Creme oder Vehikel einmal täglich über einen Zeitraum von 2 Wochen auf die betroffene Stelle des Fußes sowie auf einen ½-Zoll-Rand der gesunden Haut um die betroffene Stelle auf. Die Anzeichen und Symptome der interdigitalen Tinea pedis (Vorhandensein oder Fehlen von Erythem, Juckreiz und Schuppung) wurden beurteilt und eine KOH-Untersuchung sowie eine Dermatophytenkultur wurden am primären Wirksamkeitsendpunkt in Woche 6 durchgeführt.
Das Durchschnittsalter der Studienpopulation betrug 42 Jahre, 71 % waren männlich und 57 % waren weiß. Bei Studienbeginn wurden bei den Probanden Anzeichen und Symptome einer interdigitalen Tinea pedis, eine positive KOH-Untersuchung und eine bestätigte Dermatophytenkultur festgestellt. Der primäre Wirksamkeitsendpunkt war der Anteil der Probanden mit einer vollständigen Heilung bei der Visite in Woche 6 (siehe Tabelle 2). Vollständige Heilung wurde definiert als sowohl klinische Heilung (Abwesenheit von Erythem, Juckreiz und Schuppung) als auch mykologische Heilung (negative KOH und Dermatophytenkultur).
Die Wirksamkeitsergebnisse in Woche 6, vier Wochen nach Ende der Behandlung, sind in Tabelle 2 dargestellt. Naftifinhydrochlorid-Creme zeigte eine vollständige Heilung bei Probanden mit interdigitaler Tinea pedis, aber eine vollständige Heilung bei Probanden, die nur eine Tinea pedis vom Mokassin-Typ hatten, wurde nicht nachgewiesen.
|
Endpunkt |
Naftifinhydrochlorid-Creme, 2% |
Vehikel |
|
N=147 |
N=70 |
|
|
Komplette Curea |
26 (18%) |
5 (7%) |
|
Effektive Behandlungb |
83 (57%) |
14 (20%) |
|
Mykologische Heilung |
99 (67%) |
15 (21%) |
|
a. Vollständige Heilung ist ein zusammengesetzter Endpunkt sowohl der mykologischen Heilung als auch der klinischen Heilung. |
||
|
b. Eine wirksame Behandlung ist ein negatives KOH-Präparat und eine negative Dermatophytenkultur, Erythem, Schuppung und Juckreiz mit einem Grad von 0 oder 1 (nicht oder fast nicht vorhanden). |
||
|
c. Mykologische Heilung ist definiert als negative KOH- und Dermatophytenkultur. |
||
Tinea corporis
Naftifinhydrochlorid-Creme wurde in einer randomisierten, doppelblinden, Vehikel-kontrollierten, multizentrischen Studie bei 184 Probanden mit symptomatischer und Dermatophytenkultur-positiver Tinea corporis auf Sicherheit und Wirksamkeit untersucht. Die Probanden erhielten nach dem Zufallsprinzip entweder Naftifinhydrochlorid-Creme oder ein Vehikel. Die Probanden trugen das Studienmedikament zwei Wochen lang auf alle befallenen Körperstellen mit Tinea corporis sowie auf einen ½ Zoll breiten Rand gesunder Haut um die betroffenen Läsionen auf. Die Anzeichen und Symptome der Tinea corporis (Vorhandensein oder Fehlen von Erythem, Verhärtung und Juckreiz) wurden beurteilt und eine KOH-Untersuchung sowie eine Dermatophytenkultur wurden zur Beurteilung des primären Wirksamkeitsendpunkts am Tag 21 durchgeführt.
Die Studienpopulation war pädiatrisch (Alter größer oder gleich 2 bis kleiner als 18 Jahre) mit einem Durchschnittsalter von 9 Jahren (Naftifinhydrochlorid-Creme) bzw. 8 Jahren (Vehikel); 61 % der Probanden waren männlich und 45 % waren weiß. Bei Studienbeginn wurden bei den Probanden Anzeichen und Symptome einer Tinea corporis, eine positive KOH-Untersuchung und eine bestätigte Dermatophytenkultur festgestellt. Der primäre Wirksamkeitsendpunkt war der Anteil der Probanden mit einer vollständigen Heilung bei der Untersuchung am Tag 21. Vollständige Heilung wurde sowohl als klinische Heilung (Abwesenheit von Erythem, Induration und Juckreiz an allen Läsionen, die zu Beginn der Behandlung vorhanden waren) als auch als mykologische Heilung (negative KOH und Dermatophytenkultur) definiert.
Die Wirksamkeitsergebnisse am Tag 21, eine Woche nach Ende der Behandlung, sind in Tabelle 3 unten dargestellt.
|
Naftifinhydrochlorid-Creme, 2% |
Vehikel |
|
|
Endpunkt |
N=91 |
N=93 |
|
Komplette Kurea |
42 (46%) |
26 (28%) |
|
Effektive Behandlungb |
53 (58%) |
32 (34%) |
|
Mykologische Heilung |
57 (63%) |
36 (39%) |
|
a. Vollständige Heilung ist ein zusammengesetzter Endpunkt sowohl der mykologischen Heilung als auch der klinischen Heilung. |
||
|
b. Eine wirksame Behandlung ist ein negatives KOH-Präparat und eine negative Dermatophytenkultur, Erythem, Induration und Juckreiz mit einem Grad von 0 oder 1 (nicht vorhanden oder leicht). |
||
|
c. Mykologische Heilung ist definiert als negative KOH- und Dermatophytenkultur. |
||
LIEFERUMFANG/LAGERUNG UND HANDHABUNG
Naftifinhydrochlorid-Creme, USP 2%, ist eine weiße bis cremefarbene Creme, die in der folgenden Größe geliefert wird:
45-Gramm-Tuben – NDC 70700-161-18
60-Gramm-Tuben – NDC 70700-161-17
Naftifinhydrochlorid-Creme bei 25°C (77°F) lagern; Abweichungen von 15° bis 30°C (59° bis 86°F) sind zulässig.
Informationen zur Patientenberatung
- Informieren Sie die Patienten, dass Naftifinhydrochlorid-Creme nur zur äußerlichen Anwendung bestimmt ist. Naftifinhydrochlorid-Creme ist nicht für die orale, intravaginale oder ophthalmische Anwendung bestimmt.
- Wenn sich bei der Anwendung von Naftifinhydrochlorid-Creme eine Reizung oder Empfindlichkeit entwickelt, sollte die Behandlung abgebrochen und eine geeignete Therapie eingeleitet werden. Die Patienten sollten angewiesen werden, sich an ihren Arzt zu wenden, wenn sich diese Zustände nach der Anwendung von Naftifinhydrochlorid-Creme entwickeln.
Vertrieben von:
Xiromed, LLC,
Florham Park, NJ 07932
Rev. 09/2020
PI-161-00
Packungsaufdruck – 45g Tube

NDC 70700-161-18
Naftifin Creme, 2%
Xiromed, LLC
Nur zur topischen Anwendung
Nicht zur ophthalmischen Anwendung, Orale oder intravaginale Anwendung
45 g
Nur Rx
Packungsaufdruck – 60g Tube

NDC 70700-161-17
Naftifin Creme, 2%
Xiromed, LLC
Nur zur äußerlichen Anwendung
Nicht zur ophthalmischen Anwendung, Orale oder intravaginale Anwendung
60 g
Nur Rx
| NAFTIFINE HYDROCHLORIDE Naftifine Hydrochloride Cream |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Labeler – Xiromed, LLC (080228637)
Registrant – Xiromed Pharma España, S.L. (468835741)
Mehr über Naftifin topisch
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungshinweise
- Preisangaben &Gutscheine
- En Español
- 7 Bewertungen
- Drogenklasse: Topische Antimykotika
Ressourcen für Verbraucher
- Patienteninformationen
- Naftifin Topisch (Erweiterte Lektüre)
Ressourcen für Fachleute
- Verschreibungsinformationen
- Naftifin (Professionelle Patientenberatung)
- Naftifin Gel (FDA)
Andere Marken Naftin
Verwandte Behandlungsleitfäden
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Medizinischer Haftungsausschluss