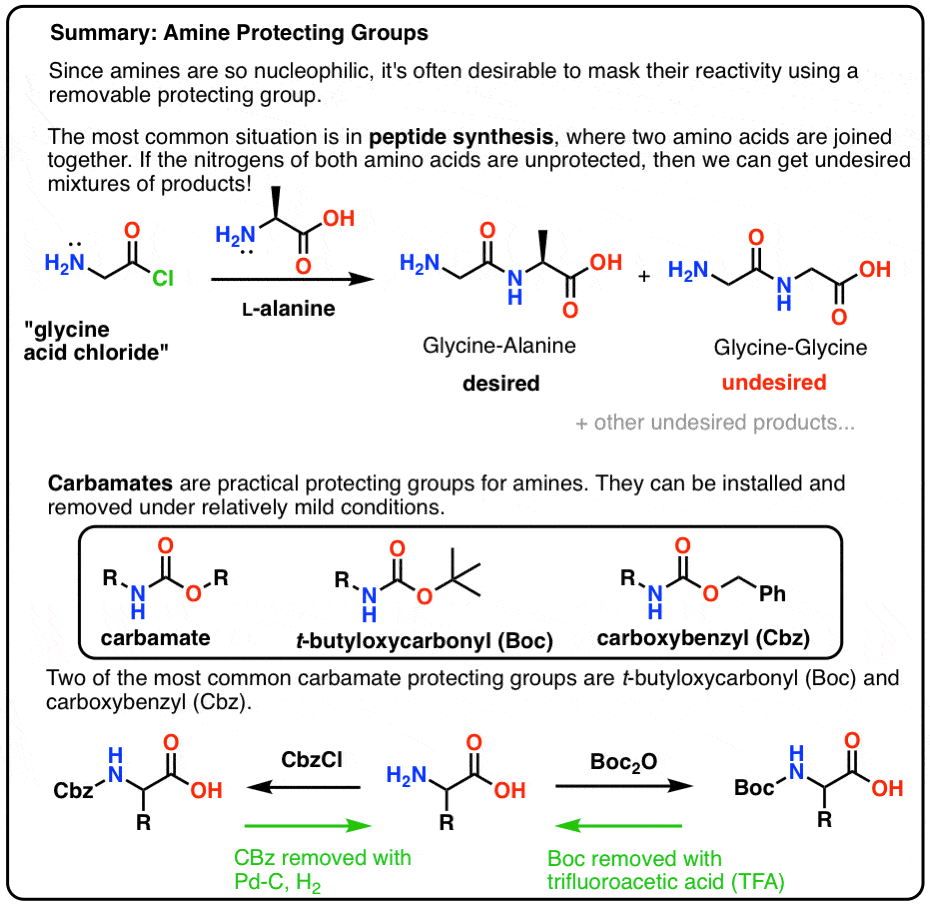
In diesem Beitrag stellen wir Carbamate als nützliche Schutzgruppen für Amine vor, insbesondere im Zusammenhang mit der Herstellung von Peptiden.
Hier ist eine kurze Zusammenfassung dessen, worauf wir in diesem Beitrag eingehen werden, mit weiteren Details unten.
Inhaltsverzeichnis
- Eine Einführung in die einfache Peptidsynthese
- Lassen Sie uns eine Charge Gly-Ala mischen
- Ein sehr schlechter erster Plan
- „Hark! Was ist das für ein Mist?“
- Eine Schutzkappe für NH2
- Kumpel! Nimm einen Carbamat, Kumpel!
- Boc und CBz sind die Bienenstöcke
- Einbau und Entfernung der „Boc“-Schutzgruppe
- Einbau und Entfernung der CBz (oder „Z“) Carbamat-Schutzgruppe
- Eine einfache Peptid-Synthese mit Carbamat-Schutzgruppen
- Es geht immer weiter…
- Hinweise
- (Fortgeschrittene) Referenzen und weiterführende Literatur
Eine Einführung in die einfache Peptidsynthese
In einem kürzlich erschienenen Beitrag haben wir 3 gängige Methoden zur Herstellung von Amiden vorgestellt:
- Addition von Aminen an Acylhalogenide / Anhydride
- Teilhydrolyse von Nitrilen
- Kopplung von Carbonsäuren mit Aminen unter Verwendung eines Dehydratisierungsmittels wie DCC (N,N‘-Dicyclohexylcarbodiimid).
Was in diesem Beitrag fehlte, war die Erwähnung der Synthese des Urgroßvaters der nützlichsten Amidverbindungen, die der Menschheit bekannt sind, und damit meine ich Peptide.
Eine Peptidbindung ist der Name, den wir der Amidbindung geben, die zwei Aminosäuren miteinander verbindet.
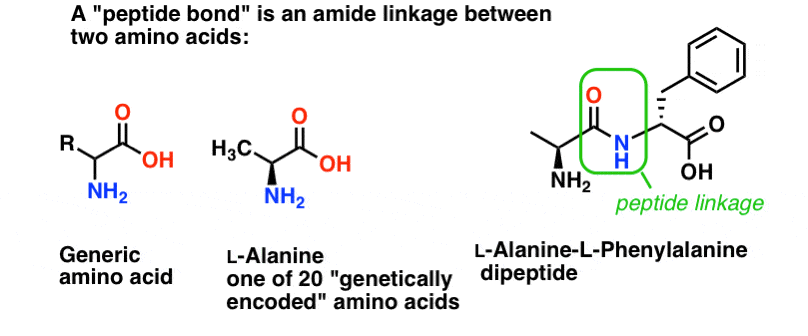
Und Aminosäuren sind wichtig, weil… Moment. Du weißt schon, warum Aminosäuren wichtig sind, oder? Wenn du das jetzt noch nicht weißt, komm zurück, nachdem du das hier gelesen hast.
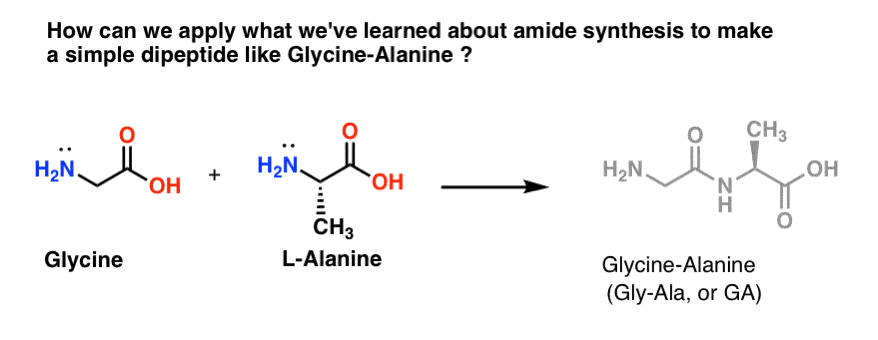
Lassen Sie uns eine Ladung Gly-Ala zusammenmischen
Lassen Sie uns versuchen, einige unserer neu erworbenen Amidsynthesefähigkeiten anzuwenden, um ein wirklich einfaches Dipeptid, Glycin-Alanin, herzustellen. Wenn wir jetzt ein einfaches Dipeptid bauen können, können wir das Gelernte nutzen, um in einem späteren Beitrag zu zeigen, wie noch komplexere Peptide hergestellt werden. Wussten Sie, dass der Nobelpreisträger Bruce Merrifield Insulin synthetisiert hat, indem er jeweils eine Aminosäure zusammengefügt hat? Ja, wirklich.
Von den drei Methoden, die wir für die Herstellung von Amiden aufgeführt haben, sind nur zwei für die Bildung von Peptidbindungen potenziell nützlich: 1) die Säurechlorid-Methode oder 2) die Synthese über ein Kopplungsmittel wie DCC.
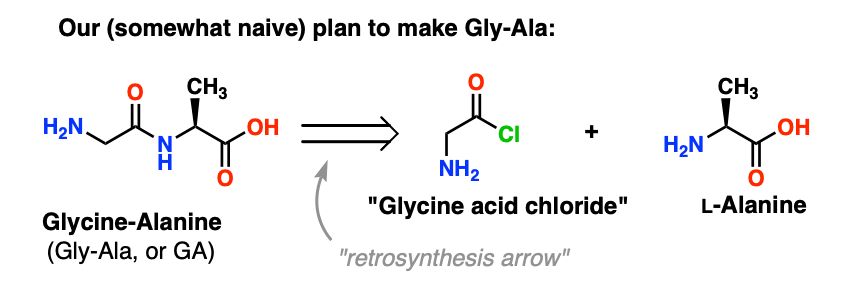
3. ein sehr schlechter erster Plan
Bei unserem ersten Versuch der Peptidsynthese werden wir mit einem sehr naiven Angriffsplan vorpreschen und hoffen, dass am Ende alles gut geht. Haltet euch fest, Leute, denn es wird chaotisch.
Wir beginnen mit dem Vorschlag der Säurechlorid-Methode für die Synthese von Gly-Ala.
Ausgehend vom Gly-Ala-Dipeptid würde unser Plan die Synthese der Peptidbindung durch die Reaktion von Alanin mit dem Säurechlorid von Glycin vorsehen:
Es gibt ein kleines Problem mit diesem Plan.
Angenommen, wir haben das Säurechlorid von Glycin* hergestellt, und wir haben „Glycinsäurechlorid“ und Alanin zusammen im gleichen Kolben, zusammen mit etwas überschüssiger Base, um die Dinge zu beschleunigen.
Wir zeichnen die Reaktion in der Vorwärtsrichtung:
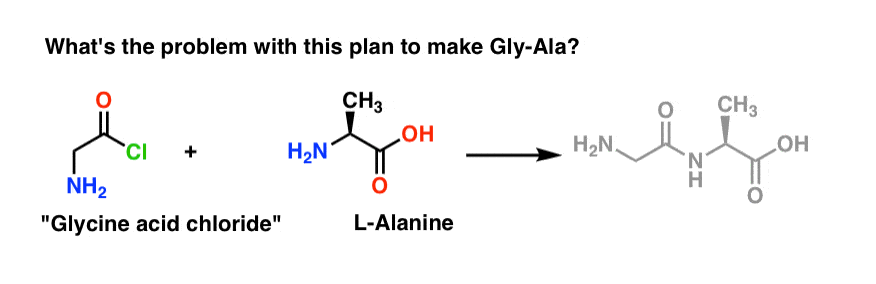
Was könnte schiefgehen?
„Hark! What Crap Is This? „
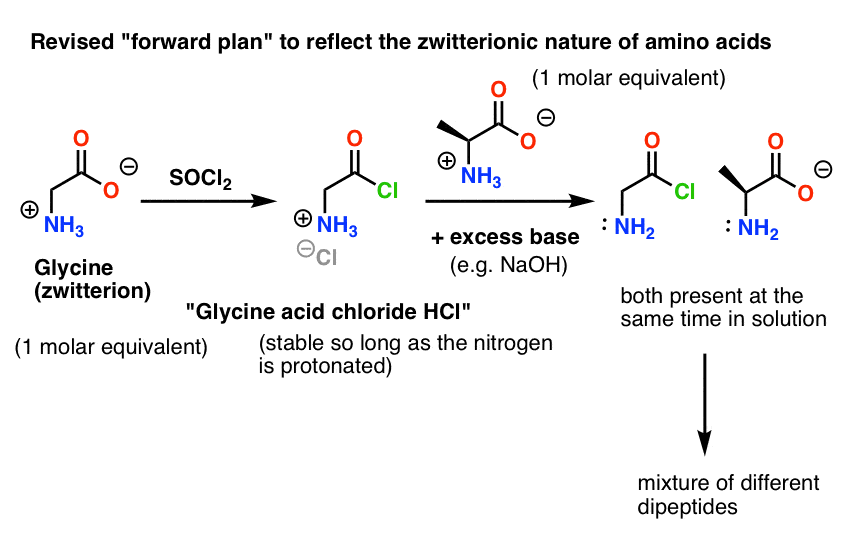
Unser Plan ist es, eine Lösung des Säurechlorids von Glycin (1 molares Äquivalent) herzustellen und es dann geduldig im Kolben warten zu lassen, bis wir ein molares Äquivalent Alanin hinzufügen, woraufhin es mit der nucleophilen NH2-Gruppe des Alanins reagieren würde.
Das Problem bei unserem Plan ist, dass wir es nicht mit einem einzigen Molekül „Glycinsäurechlorid“ zu tun haben, sondern mit etwa einem Mol (6,02 x 1023 Moleküle) davon. Und das Säurechlorid des Glycins hat bereits eine nukleophile NH2-Gruppe!
„Glycinsäurechlorid“, wie gezeichnet, ist kein stabiles Molekül, weil es mit sich selbst reagieren kann.
Das bedeutet, dass eine Lösung von Glycinsäurechlorid, die sich selbst überlassen wird, ein Polymer von Glycin mit der Struktur Gly-Gly-Gly-Gly bilden würde…
Auch eine Lösung von Glycinsäurechlorid in Gegenwart von Alanin würde nicht nur das gewünschte Gly-Ala bilden, sondern auch Gly-Gly (mit einem angehängten Acylhalogenid), das mit einem anderen Nukleophil, sei es Gly oder Ala, noch mehr Unheil anrichten kann:
(und nein, es gibt keinen großen Unterschied zwischen dem NH2 von „Glycinsäurechlorid“ und dem NH2 von Alanin. Sie sind etwa gleich reaktiv.)
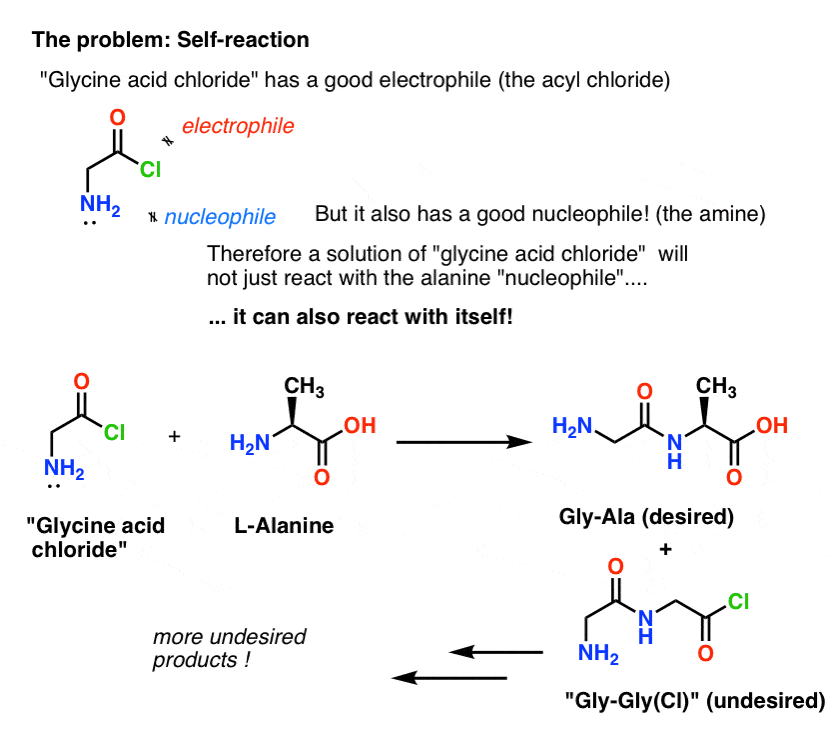
Die Lektion hier ist, dass eine Lösung eines Moleküls, das sowohl ein Nukleophil als auch ein Elektrophil enthält, eine Selbstreaktion eingehen kann. Es gibt einen Namen für diesen Prozess, der vertraut klingen mag: Polymerisation.
Wie kann man also verhindern, dass dies geschieht?
Ein Schutzhut für NH2
Die beste Möglichkeit ist, den Stickstoff irgendwie mit einer Schutzgruppe (PG) zu „bedecken“, die die NH2-Gruppe nicht nukleophil macht. Sie sollte außerdem die folgenden Eigenschaften haben:
- leicht und selektiv zu installieren
- inert gegenüber den gewünschten Reaktionsbedingungen (z.B. SOCl2 zur Herstellung des Säurechlorids aus der Carbonsäure)
- leicht und selektiv zu entfernen, ohne das Endprodukt zu beeinträchtigen
Wir haben schon früher Schutzgruppenstrategien gesehen, insbesondere mit Alkoholen und der Verwendung von Grignard-Reagenzien.
So könnte eine Schutzgruppenstrategie für unsere Synthese von „Gly-Gly“ aussehen. Wir installieren eine Schutzgruppe („PG“) an Glycin und stellen dann das Säurechlorid her. Die PG sollte so gewählt werden, dass der Stickstoff nicht nukleophil ist (d.h. er reagiert nicht mit dem Säurechlorid).
Wir können dann unsere Peptidbindung mit ungeschütztem Alanin bilden und dann die PG unter milden Bedingungen entfernen.
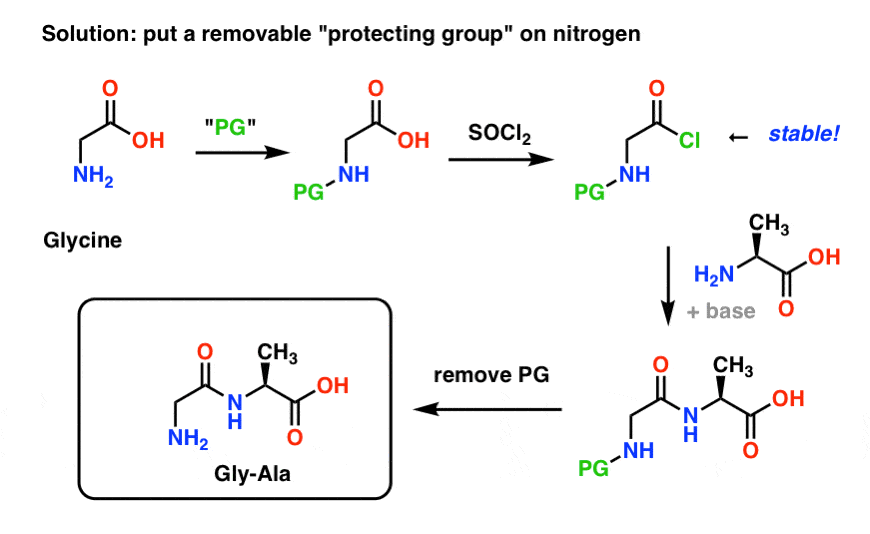
Eine Schutzgruppenstrategie für Stickstoff, die wir bereits erforscht haben, ist die Gabriel-Synthese, bei der Phthalimid verwendet wird (Sie können sich ein Phthalimid als geschützten Stickstoff vorstellen). Diese Methode wurde bereits für die Synthese von Gly-Gly („Glycylglycin“) verwendet! Eines der Probleme ist jedoch, dass relativ harte Bedingungen (viel Hitze) erforderlich sind, um die Phthalimidgruppe einzubauen und zu entfernen, und dies ist keine sehr gesunde Umgebung für das Überleben empfindlicher, chiraler Aminosäuren, die leicht racemisieren können.
Eine andere Möglichkeit ist, den Stickstoff als Amid zu schützen, aber auch Spaltungsamide können harte Bedingungen erfordern. Da wir hier ohnehin versuchen, eine Amidbindung (Peptid) zu schmieden, könnten wir außerdem Selektivitätsprobleme bei ihrer Entfernung haben – das Dorf zerstören, um es zu retten.
Mate! Nimm ein Carbamat, Kumpel!
Die beliebteste Schutzgruppe für Amin-Stickstoff ist die Carbamatfunktion. Ein Carbamat sieht aus wie das uneheliche Kind eines Esters und eines Amids, wobei N und O ein Carbonyl flankieren.
Der Stickstoff eines Carbamats ist relativ nicht-nukleophil, und außerdem sind Carbamate:
- leicht an Stickstoff zu installieren
- inert gegenüber einer Vielzahl von Reaktionsbedingungen
- leicht zu entfernen, ohne bestehende Amidgruppen zu beeinträchtigen
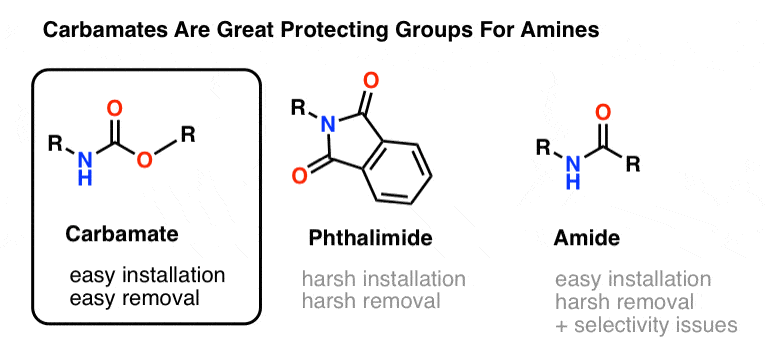
Das macht sie perfekt für unsere Zwecke.
Boc und CBz sind die Bienenstöcke
Zwei beliebte Carbamatschutzgruppen sind Boc (t-Butyloxycarbonyl) und CBz (Carboxybenzyl).
Für unsere Zwecke können diese beiden Schutzgruppen als mehr oder weniger gleichwertig betrachtet werden, da beide effektiv für die Peptidsynthese verwendet werden können.
Der Hauptunterschied liegt in der Art und Weise, wie sie entfernt werden (d.h. der „Entschützungsschritt“). Die Wahl zwischen dem einen oder dem anderen wird entscheidend, wenn man ein komplexes Molekül mit mehreren Schutzgruppen hat; das fällt unter die Kategorie „fortgeschrittene synthetische Strategie“, die eher ein Thema für Org 3 ist.
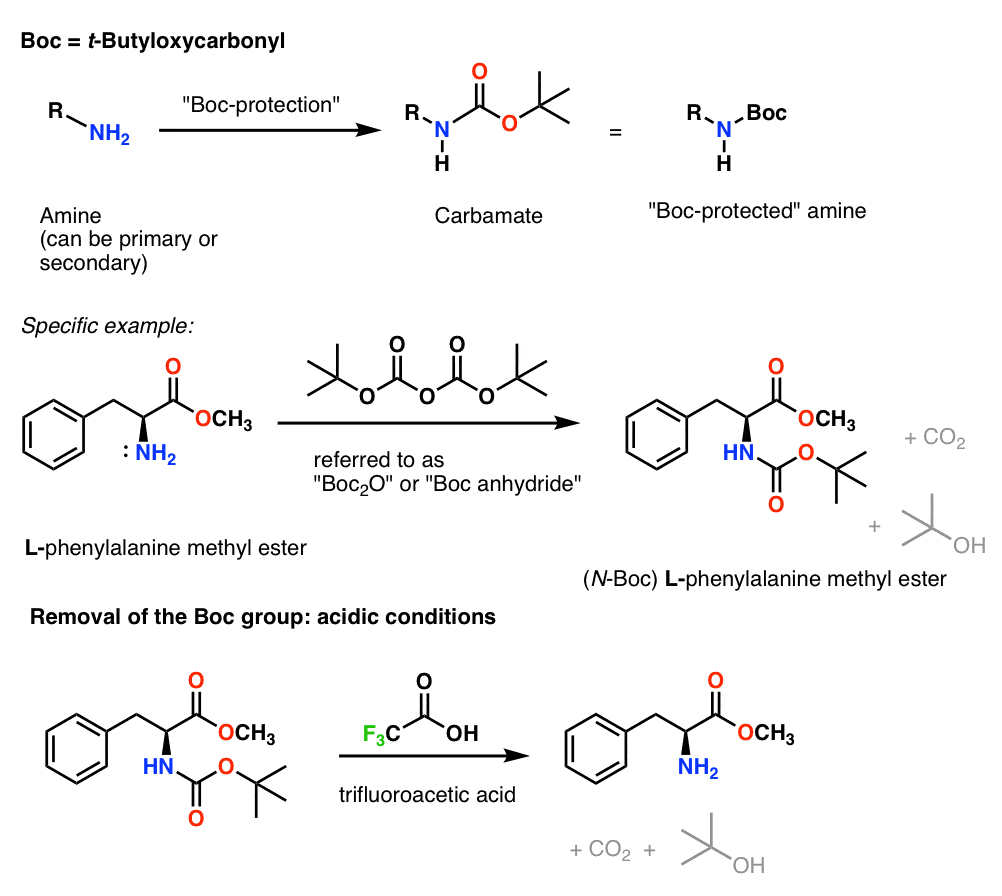
Einbau und Entfernung der „Boc“-Schutzgruppe
Die Boc-Gruppe wird normalerweise mit „Boc2O“ (manchmal auch als „Boc-Anhydrid“ bezeichnet) eingebaut und mit Säure entfernt. Die übliche Wahl ist „saubere“ (d.h. unverdünnte) Trifluoressigsäure (TFA), die die Boc-Gruppen sehr sauber abspaltet und dabei CO2 und t-Butylalkohol freisetzt.
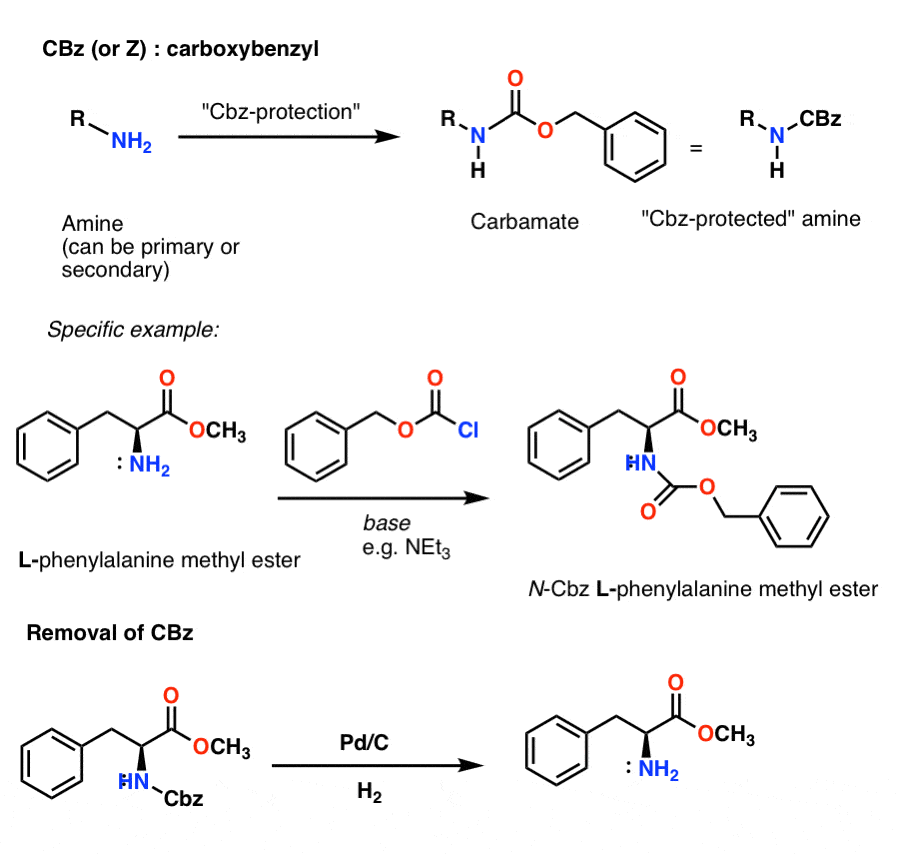
Einbau und Entfernung der CBz- (oder „Z“-)Carbamat-Schutzgruppe
Die Cbz-Gruppe (manchmal auch als „Z“ abgekürzt) kann mit CbzCl und einer milden Base eingebaut werden und wird gewöhnlich durch katalytische Hydrierung (Pd-C/H2) entfernt. Dieser Vorgang ist äußerst schonend und hat den Vorteil, dass er bei neutralem pH-Wert stattfindet und säure- oder basenempfindliche funktionelle Gruppen in Ruhe lässt.
Eine einfache Peptidsynthese unter Verwendung von Carbamat-Schutzgruppen
Zurück zur Peptidsynthese: Wenden wir diese Schutzgruppenstrategie an, um Gly-Ala herzustellen.
Wir beginnen mit einer Aminosäure wie L-Alanin. Wenn wir Alanin mit Boc2O behandeln, erhalten wir N-Boc-geschütztes L-Alanin. Der nächste Schritt ist die Bildung eines Säurechlorids mit SOCl2. Nach der Bildung des Säurechlorids fügen wir unser Amin (z. B. L-Valin) in Gegenwart einer überschüssigen Base hinzu und bilden unsere wichtige Amidbindung. Der letzte Schritt, um das Dipeptid zu erhalten, ist die Entschützung des Boc-geschützten Amins mit Trifluoressigsäure (TFA), und voila! wir haben unser Dipeptid.
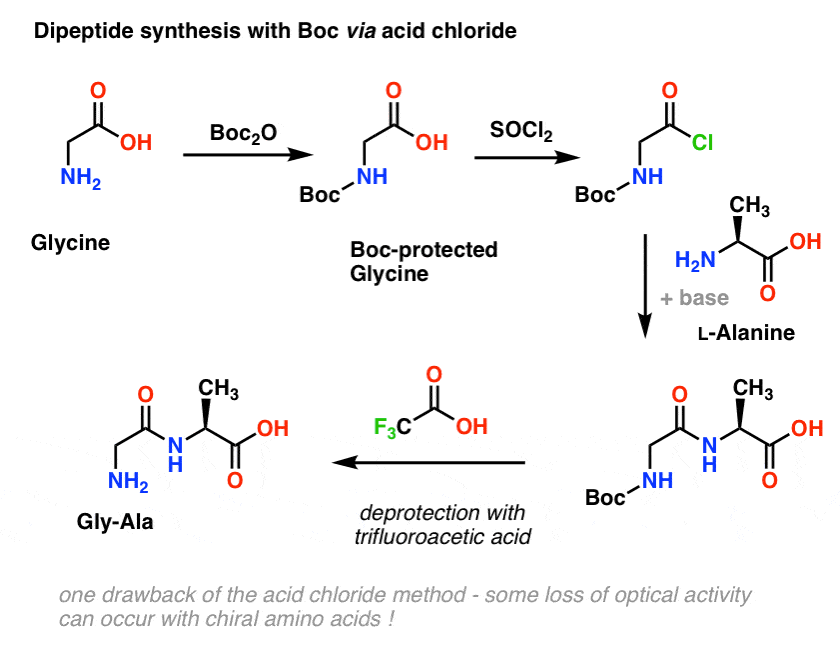
Auch wenn diese Methode auf dem Papier gut aussieht, besteht ein Problem bei der Verwendung von Säurechloriden in der Praxis darin, dass chirale Aminosäuren durch diese Methode oft ihre optische Reinheit verlieren, ein Prozess, der manchmal als „Racemisierung“ bezeichnet wird, Dieser Prozess wird manchmal als „Racemisierung“ bezeichnet, korrekter ist jedoch die Bezeichnung „Epimerisierung“ (technisch korrekter, da ein Wasserstoff an einem chiralen Zentrum invertiert wird)
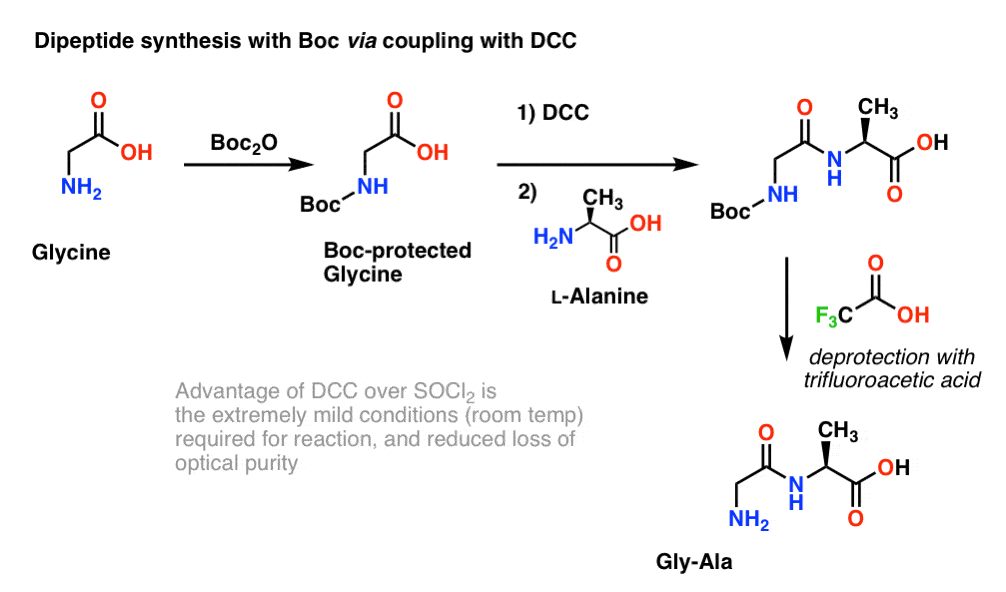
Da die Chiralität von Aminosäuren für ihre biologische Funktion wesentlich ist, wird im Allgemeinen ein etwas milderes Protokoll verwendet, bei dem DCC oder ein ähnliches Kopplungsreagenz eingesetzt wird.
Hier behandeln wir Boc-geschütztes Glycin mit DCC, um die Carbonsäure zu aktivieren. Dann fügen wir unser Aminosäuren-Nukleophil (L-Alanin) hinzu, das das Dipeptid bildet. Wenn wir das Gly-Ala-Dipeptid zu diesem Zeitpunkt isolieren wollen, können wir die Boc-Gruppe mit TFA entfernen.
(Anmerkung zu diesem Schema)
Es geht immer weiter…
Wenn wir ein Tri-Peptid herstellen wollen, können wir einfach weitere Zyklen der Zugabe von DCC (zur Aktivierung der Carbonsäure) und der anschließenden Zugabe neuer Aminosäuren durchführen und so das Peptid Stück für Stück aufbauen!
Es gibt eine besonders effektive Methode zum Aufbau längerer Peptide, die von Bruce Merrifield entwickelt wurde (und unter anderem bei der Synthese von Insulin angewandt wurde), die sogenannte Festphasen-Peptidsynthese, die wir beim nächsten Mal behandeln werden.
Anmerkungen
Anmerkung 1. Ähnlich dem alten Witz über den Ökonomen, der einen Plan vorschlägt, wie man von einer einsamen Insel wegkommt:
„Nehmen wir an, wir haben ein Boot“.
Glycin (wie alle Aminosäuren) ist selbst ein Zwitterion. Die Behandlung von Glycin mit SOCl2 sollte das Säurechlorid mit einem protonierten Amin ergeben. Dieses sollte in Lösung relativ stabil sein, solange keine Base zugesetzt wird.
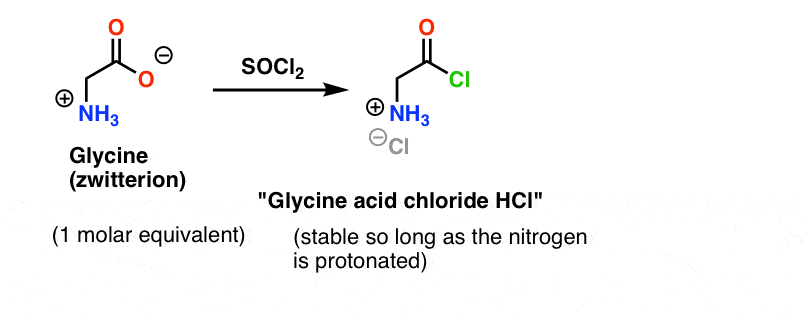
Hier liegt das Problem. Da unser Aminosäurenukleophil (Alanin) ebenfalls zwitterionisch ist, kann keine Reaktion stattfinden, solange nicht ein Überschuss an Base hinzugefügt wird, um ein einsames Paar am Alanin-Stickstoff freizusetzen. Nach Zugabe der Base befinden sich „Glycinsäurechlorid“ und Alanin zusammen in Lösung. Es gibt keinen nennenswerten Unterschied in der Nukleophilie zwischen den Stickstoffen dieser beiden Spezies, und jede von ihnen konkurriert darum, mit dem Säurechlorid-Nukleophil zu reagieren, was zu einem Gemisch aus Gly-Ala und Gly-GlyCl führt, und das Gly-GlyCl kann dann weiter mit den verschiedenen in Lösung befindlichen Nukleophilen reagieren, um Tri-, Tetra- und höhere Peptide zu ergeben.
Anmerkung 2. John Sheehan, den wir bereits als Erfinder von DCC auf dem Weg zur ersten Synthese von Penicillin kennengelernt haben, stellte ebenfalls phthalylgeschütztes Gly-Gly durch eine Gabriel-Synthese her:
Referenz hier (JACS, 1949, 71, 1856)
Anmerkung 3. Ein weiteres Problem bei der Verwendung von Amidschutzgruppen ist die Azlactonbildung, die zur Epimerisierung von chiralen Aminosäuren führen kann. Siehe auch diese Problemstellung.
Anmerkung 4. „Orthogonale Schutzgruppen“. Bei der Syntheseplanung ist es oft von entscheidender Bedeutung, Schutzgruppen zu haben, die unter deutlich unterschiedlichen Bedingungen entfernbar sind. Diese Eigenschaft wird oft als „Orthogonalität“
Beim folgenden Dipeptid haben wir zum Beispiel zwei verschiedene Schutzgruppen am Stickstoff – eine Boc und eine CBz. Durch die Auswahl „orthogonaler“ Schutzgruppen ist jeder Stickstoff adressierbar – wir können wählen, welche Schutzgruppe entfernt werden soll, und unsere Synthese kann von dort aus weitergehen. Auf diese Weise wird vermieden, dass wir in eine Situation geraten, in der wir zwei ungeschützte Amine haben und uns darauf verlassen müssen, dass eines reaktiver ist als das andere.
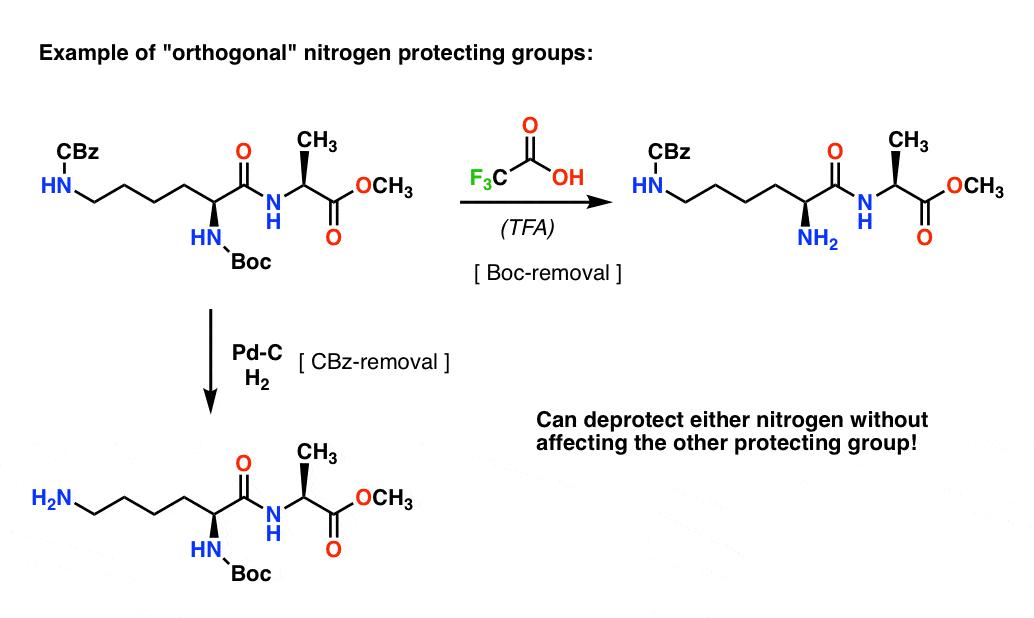
Eine Anmerkung: Der Einfachheit halber wird hier Alanin mit einer freien Carbonsäure dargestellt, aber ein etwas besserer Ansatz wäre es, den Methylester von Alanin zu verwenden, um jegliche Selbstkupplung zwischen dem freien Amin von Alanin und der freien Carbonsäure zu vermeiden.
Mate…
(Fortgeschrittene) Referenzen und weiterführende Literatur
Carbamate sind nützlich als Schutzgruppen für Amine, und die am häufigsten verwendeten sind -Boc, -Cbz und -Fmoc.
- Über ein allgemeines Verfahren der Peptid-Synthese
Max Bergmann und Leonidas Zervas
Ber. 1932, 65 (7), 1192-1201
DOI: 10.1002/cber.19320650722
Die -Cbz (Carboxybenzyl)-Schutzgruppe wurde erstmals 1932 von Max Bergmann und Leonidas Zervas für die Synthese von Peptiden verwendet und wird manchmal zu Ehren von Zervas mit „-Z“ abgekürzt. - ENTFERNUNG VON t-BUTYL- UND t-BUTOXYCARBONYL-SCHUTZGRUPPEN MIT TRIFLUORAZETSÄURE
Mechanismen, Bildung von Nebenprodukten und Bewertung von Scavengern
Behrend F. Lundt, Nils L. Johansen, Aage Vølund und Jan Markussen
J. Pept. Prot. Res. 1978, 12 (5), 258-268
DOI: 10.1111/j.1399-3011.1978.tb02896.x
In der Praxis werden dem Säurecocktail (TFA) beim Entschützen in der Regel nukleophile Scavenger (z.B. Thiole) zugesetzt, da beim Entschützen von Boc elektrophile t-Butylspezies (z.B. t-Butyltrifluoracetat) entstehen, die mit empfindlichen Resten (z.B. Trp oder Cys) reagieren können. - Eine Methode zur Synthese langer Peptidketten am Beispiel der Synthese von Oxytocin
Miklos Bodanszky und Vincent du Vigneaud
Journal of the American Chemical Society 1959, 81 (21), 5688-5691
DOI: 1021/ja01530a040
In der ersten Hälfte des 20. Jahrhunderts wurde die Peptidsynthese mit Hilfe von Standard-Lösungsphasenverfahren der organischen Chemie durchgeführt. Dies ist heute als LPPS (Flüssigphasen-Peptidsynthese) bekannt. 1955 erhielt du Vigneaud den Nobelpreis für Chemie für seine Arbeit, mit der er zeigte, dass die Peptidsynthese mit der richtigen Wahl von Schutzgruppen und synthetischen Strategien möglich ist. - DIE TEMPORÄRE BILDUNG DES AZLACTON-RINGS BEI DER RACEMISIERUNG VON ACYL-DERIVATEN VON AMINOSÄUREN MIT ACETISCHEM ANHYDRID
Vincent du Vigneaud und Curtis E. Meyer
Biol. Chem. 1932, 99:143-151
http://www.jbc.org/content/99/1/143.citation
Ein weiteres Problem bei der Verwendung von Amid-Schutzgruppen ist die Azlactonbildung, die zur Epimerisierung chiraler Aminosäuren führen kann. - Ein neuer synthetischer Weg zu Peptiden
John C. Sheehan und Victor S. Frank
Journal of the American Chemical Society 1949, 71 (5), 1856-1861
DOI: 10.1021/ja01173a095
John Sheehan, der Erfinder von DCC auf dem Weg zur ersten Synthese von Penicillin, stellte auch Phthalyl-geschütztes Gly-Gly durch eine Gabriel-Synthese her. - Eine neue Methode zur Bildung von Peptidbindungen
John C. Sheehan und George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
Originalarbeit über die Synthese von Peptidbindungen/Amidbindungen mit DCC. - 9-Fluorenylmethoxycarbonyl-Funktion, eine neue basenempfindliche Amino-Schutzgruppe
Louis A. Carpino und Grace Y. Han
Journal of the American Chemical Society 1970, 92 (19), 5748-5749
DOI: 10.1021/ja00722a043 - 9-Fluorenylmethoxycarbonyl-Aminoschutzgruppe
Louis A. Carpino und Grace Y. Han
The Journal of Organic Chemistry 1972 37 (22), 3404-3409
DOI: 10.1021/jo00795a005
Die Entdeckung und Entwicklung der -Fmoc-Schutzgruppe für Amine fügt eine weitere orthogonale Ebene zu den Aminschutz-/Deprotektionsstrategien hinzu. Die -Fmoc-Gruppe ist basenlabil und wird bei der Peptidsynthese üblicherweise mit 20 % Piperidin in DMF entfernt. Cbz wird durch Hydrierung entfernt, -Boc mit Säure und -Fmoc mit einer Base.