US Pharm. 2009;34(11):26-39.
Bei der Auswahl des geeigneten Antidepressivums für Patienten, bei denen eine schwere depressive Störung (MDD) diagnostiziert wurde, herrscht große Unsicherheit, nicht nur, weil Studien keine Unterschiede in der Wirksamkeit zwischen den einzelnen Wirkstoffen festgestellt haben, sondern auch, weil nur 11 % bis 30 % der Patienten mit der ersten Behandlung eine Remission erreichen, selbst nach einem Jahr.1,2 Dies hat dazu geführt, dass Kliniker bei der Behandlung von Depressionen nach dem Trial-and-Error-Prinzip vorgehen.3 Darüber hinaus wurde die letzte große Revision des Diagnostic and Statistical Manual of Mental Disorders (DSM-IV-TR) im Jahr 2000 erstellt.4 Im Jahr 2005 wurde eine Leitlinie veröffentlicht, um wichtige Sicherheitsbedenken zu überprüfen, die bei einigen Wirkstoffen wie Nefazodon aufgetreten waren, sowie um zwei neue Antidepressiva zu überprüfen, die in diesem Jahr zugelassen wurden, nämlich Escitalopram und Duloxetin.5 Die Überarbeitung und Aktualisierung des DSM-IV-TR (DSM-V-Manuskript) ist erst im Mai 2012 fällig. Daher besteht Bedarf an einer aktuellen Übersicht, die Klinikern bei der Entscheidung über die geeigneten Wirkstoffe zur Behandlung einzelner Patienten hilft.
Die STAR*D-Studie (Sequenced Treatment Alternatives to Relieve Depression) aus dem Jahr 2007 versuchte, praktikable Behandlungsstrategien zu entwickeln und zu bewerten, um die klinischen Ergebnisse für Patienten mit behandlungsresistenten Depressionen zu verbessern, bei denen eine aktuelle schwere depressive Episode festgestellt wurde.6 Konkret sollte mit STAR*D ermittelt werden, welche von mehreren Behandlungen der wirksamste „nächste Schritt“ für Patienten ist, die mit einer Erst- oder Folgebehandlung keine Remission erreichen oder die die Behandlung nicht vertragen. Die Gesamtergebnisse dieser Studie zeigten, dass die pharmakologischen Unterschiede zwischen den Psychopharmaka nicht zu wesentlichen klinischen Unterschieden führten, obwohl die Verträglichkeit unterschiedlich war.6
Der Zweck dieses Artikels besteht darin, die in der Literatur verfügbaren Behandlungsnachweise zu überprüfen, um ein schnelles Nachschlagewerk zur Verfügung zu stellen, das Klinikern hilft, sich für den geeigneten Wirkstoff zu entscheiden, wobei unerwünschte Wirkungen, Arzneimittelwechselwirkungen und die Arzneimittelsicherheit sowie die Patientenmerkmale berücksichtigt werden.
Was ist eine Depression?
Die Depression kann eine chronische oder wiederkehrende psychische Störung sein, die sich durch verschiedene Symptome äußert, wie z. B. gedrückte Stimmung, Verlust von Interesse oder Freude, Schuldgefühle, Schlaf- oder Appetitstörungen, geringe Energie und Denkschwierigkeiten.7 Depressionen können zu einer erheblichen Beeinträchtigung der Fähigkeit einer Person führen, ihren alltäglichen Pflichten nachzukommen. Depressionen können auch zu Selbstmord führen, eine Tragödie, der jedes Jahr weltweit etwa 850.000 Menschen zum Opfer fallen.7
Prävalenz und Risikogruppen
Schätzungsweise 121 Millionen Menschen sind weltweit von Depressionen betroffen.7 Im Jahr 2000 waren Depressionen der viertgrößte Anteil an der globalen Krankheitslast unter allen Krankheiten, und bis 2020 wird erwartet, dass sie nach den Herzkrankheiten zum zweitgrößten Anteil an der globalen Krankheitslast aufsteigen werden.7
Zu den Bevölkerungsgruppen mit einem höheren Risiko, an einer Depression zu erkranken, gehören Frauen, Menschen im Alter zwischen 24 und 45 Jahren und Menschen, die Verwandte ersten Grades mit Depressionen haben. Frauen haben bis zu ihrem 50. Lebensjahr ein erhöhtes Risiko, an einer Depression zu erkranken, und ihr Lebenszeitrisiko ist doppelt so hoch wie das der Männer. Menschen im Alter zwischen 24 und 45 Jahren sind am häufigsten von Depressionen betroffen. Bei Verwandten ersten Grades von depressiven Patienten ist die Wahrscheinlichkeit, an einer Depression zu erkranken, 1,5- bis 3-mal höher als bei anderen Personen.4,8
Pathophysiologie und Pharmakotherapie
Biologische und psychosoziale Ursachen wurden als Hypothesen aufgestellt, um die Pathophysiologie der Depression zu beschreiben. Pharmakologische Wirkstoffe zielen auf die biologischen Ursachen ab, die mit einer Dysregulierung der Neurotransmitter verbunden sind. Diese Dysregulation wird häufig als ein Mangel an Neurotransmittern im Gehirn beschrieben. Der Noradrenalin-, Serotonin- und Dopaminspiegel kann bei Patienten mit Depressionen vermindert sein, so dass eine verminderte Menge an Neurotransmittern mit der Störung in Verbindung gebracht wird.8 Das Grundprinzip der Pharmakotherapie besteht darin, diese Defizite durch die Blockierung der Wiederaufnahme oder die Verhinderung des enzymatischen Metabolismus von Neurotransmittern durch Antidepressiva zu verstärken. Insgesamt zielen diese Mechanismen darauf ab, den Gehalt an Neurotransmittern zu erhöhen, entweder indem das Neuron gezwungen wird, häufiger zu feuern und mehr Neurotransmitter zu produzieren, oder indem der Abbau des Neurotransmitters selbst verhindert wird.
Pharmakologische Wirkstoffe
Es gibt derzeit mehrere Klassen von Wirkstoffen zur Behandlung von Depressionen. Dazu gehören unter anderem selektive Serotonin-Wiederaufnahmehemmer (SSRIs), trizyklische Antidepressiva (TCAs), Monoaminoxidasehemmer (MAOIs) und Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRIs).
Antidepressiva wurden in kurzfristigen placebokontrollierten Studien zu MDD mit einem erhöhten Risiko für Suizidgedanken und Suizidalität bei Kindern, Jugendlichen und jungen Erwachsenen in Verbindung gebracht. Wer den Einsatz eines Antidepressivums bei einem Kind, Jugendlichen oder jungen Erwachsenen in Erwägung zieht, muss dieses Risiko gegen die klinische Notwendigkeit abwägen. In Kurzzeitstudien wurde bei Erwachsenen über 24 Jahren keine Erhöhung des Suizidrisikos durch Antidepressiva im Vergleich zu Placebo festgestellt, und bei Erwachsenen über 65 Jahren war das Risiko durch Antidepressiva im Vergleich zu Placebo verringert. Depressionen und andere psychiatrische Störungen sind ihrerseits mit einem erhöhten Suizidrisiko verbunden. Patienten jeden Alters, die mit einer antidepressiven Therapie beginnen, sollten angemessen überwacht und genau auf eine klinische Verschlechterung, Suizidalität oder ungewöhnliche Verhaltensänderungen beobachtet werden.9
Selektive Serotonin-Wiederaufnahmehemmer4,10: SSRI gelten als Mittel der ersten Wahl bei der Behandlung von Patienten mit Depressionen. Zu diesen Medikamenten gehören Citalopram, Escitalopram, Fluoxetin, Fluvoxamin, Paroxetin und Sertralin (TABELLE 1). Zu den wichtigsten unerwünschten Wirkungen dieser Klasse gehören Übelkeit, Erbrechen und Durchfall, die dosisabhängig sind und in der Regel nach den ersten Wochen der Behandlung abklingen. Bei einigen Patienten können SSRI zu Unruhe und Schlafstörungen führen, die ebenfalls mit der Zeit abklingen. Sexuelle Funktionsstörungen sind eine Nebenwirkung, die bei allen Antidepressiva auftritt, aber bei SSRI anscheinend am häufigsten vorkommt.
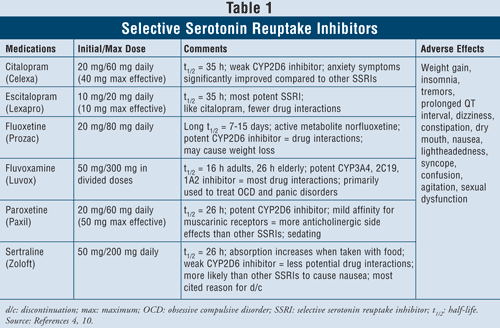
Das Serotonin-Syndrom (d. h. Bauchschmerzen, Durchfall, Schwitzen, Veränderung des mentalen Status, Nierenversagen, kardiovaskulärer Schock und möglicherweise Tod) ist eine seltene unerwünschte Wirkung von SSRIs. Das Serotonin-Syndrom kann bei einer Erhöhung der SSRI-Dosis oder bei der gleichzeitigen Einnahme von SSRIs mit pflanzlichen Mitteln wie Johanniskraut oder mit illegalen Drogen auftreten. Schließlich kann auch die Kombination von SSRI mit MAOIs zu tödlichen Arzneimittelwechselwirkungen mit Entwicklung eines Serotoninsyndroms führen. Wenn Kliniker die Notwendigkeit sehen, von einer Wirkstoffklasse auf die andere umzusteigen, wird empfohlen, mindestens fünf Halbwertszeiten zwischen dem Absetzen des SSRI und dem Beginn der MAOI-Behandlung verstreichen zu lassen.4 Von allen Wirkstoffen der Klasse hat Fluvoxa mine die höchste Rate an Arzneimittelwechselwirkungen, da es mehrere Leberenzyme wie CYP450 1A2, 2C19, 2C9, 2D6 und 3A4 hemmt. Fluoxetin folgt mit der Hemmung von CYP 2C9, 2D6 und 3A4 der Rate der Arzneimittelwechselwirkungen von Fluvoxamin. Citalopram und Escitalopram schließlich haben die geringsten Arzneimittelwechselwirkungen, da sie die Enzyme 2D6 in geringerem Maße hemmen.
Bei Betrachtung der Patientencharakteristika und der Sicherheit sind SSRIs bei den meisten Patientengruppen sicher anzuwenden, auch bei Patienten mit vorbestehenden Herzerkrankungen, Asthma, Demenz und Bluthochdruck. Ältere Menschen, die besonders anfällig für orthostatische Hypotonie und Gewichtsverlust sind, können am meisten von der Verwendung von SSRIs profitieren, da diese Wirkstoffe zu einer Gewichtszunahme führen und keine anticholinerge Wirkung haben.
Tricyclische Antidepressiva4,10: TCAs blockieren die Wiederaufnahme von Noradrenalin und Serotonin, haben aber auch eine Affinität zu Alpha1-, H1- und Muskarinrezeptoren und verursachen somit anticholinerge unerwünschte Wirkungen. Innerhalb dieser Klasse gibt es zwei Unterklassen von Wirkstoffen, die tertiären und sekundären Amin-TCAs (TABELLE 2). Die sekundären Amin-TCAs (Desipramin, Maprotilin, Nortriptylin) haben eine geringere Affinität zu den alpha1-, H1- und Muskarinrezeptoren und verursachen daher weniger anticholinerge Nebenwirkungen als die tertiären Amin-TCAs (z. B. Amitriptylin, Amoxapin, Clomipramin, Doxepin, Imipramin).
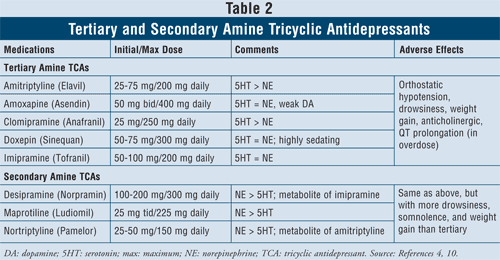
Die wichtigsten unerwünschten Wirkungen dieser Wirkstoffklasse sind orthostatische Hypotonie, QT-Verlängerung, Schläfrigkeit, Mundtrockenheit, verschwommenes Sehen, Verstopfung und Gewichtszunahme. Im Allgemeinen haben tertiäre Amin-TCAs eine stärkere Serotonin-Aktivität als sekundäre Amin-TCAs, die eine stärkere Norepinephrin-Aktivität haben und daher weniger Schläfrigkeit, Somnolenz und Gewichtszunahme verursachen.
Es ist bekannt, dass TCAs sowohl die CYP-Enzyme 2C19 als auch 2D6 hemmen.11 Sie werden auch in geringerem Maße durch die CYP-Enzyme 1A2 und 3A4 metabolisiert.12 Aus diesem Grund ist bei der Kombination von TCAs mit SSRIs Vorsicht geboten, auch wenn Wechselwirkungen mit diesen Wirkstoffen nicht das Hauptproblem darstellen, da der Plasmaspiegel von TCAs um das bis zu Vierfache ansteigen kann, was möglicherweise zu toxischen Wirkungen führt.13,14
Bei der Betrachtung der Patientencharakteristika und der Sicherheit sind TCAs bei einigen spezifischen Herzerkrankungen kontraindiziert, wie z. B. bei Patienten mit Herzrhythmusstörungen in der Vorgeschichte, Sinusknotenfehlfunktion oder Reizleitungsstörungen. Bei älteren Menschen ist Vorsicht geboten, da sie empfindlicher auf eine cholinerge Blockade sowie auf orthostatische Hypotonie reagieren. Außerdem sind Personen, die an Demenz leiden, besonders anfällig für die toxischen Wirkungen der Muskarinblockade auf das Gedächtnis und die Aufmerksamkeitsspanne und sind im Allgemeinen am besten mit Antidepressiva mit möglichst geringen anticholinergen Wirkungen versorgt. Schließlich ist bei Patienten mit Selbstmordgedanken wegen des hohen Letalitätsrisikos bei Überdosierung Vorsicht geboten, wenn sie mit TCAs beginnen. Die tödliche Dosis beträgt nur das Achtfache der therapeutischen Dosis, so dass TCAs, wenn sie in Überdosis eingenommen werden, den Sinusknoten im Herzen blockieren können.
Monoaminoxidase-Hemmer4,10: Zu den verfügbaren MAOIs gehören Isocarboxazid, Phenelzin, Selegilin und Tranylcypromin (TABELLE 3). Mit Ausnahme von Selegilin, das ein selektiver MAO-B-Hemmer ist, hemmen alle anderen Wirkstoffe sowohl die MAO-A- als auch die MAO-B-Enzyme, die für den Serotonin-, Noradrenalin- und Dopamin-Stoffwechsel im Gehirn verantwortlich sind. Aufgrund der schweren unerwünschten Wirkungen und der erforderlichen Diätbeschränkungen sind MAOIs im Allgemeinen Patienten vorbehalten, bei denen andere Antidepressiva versagt haben.
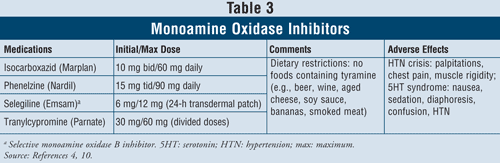
Eine hypertensive Krise kann auftreten, wenn Patienten, die MAOIs einnehmen, tyraminhaltige Lebensmittel wie Bier, Wein, gereiften Käse und geräuchertes Fleisch zu sich nehmen. Diese Reaktion äußert sich in akut einsetzenden starken Kopfschmerzen, Übelkeit, Nackensteifigkeit, Herzklopfen, Brustschmerzen und Verwirrung. MAOIs können auch ein Serotonin-Syndrom verursachen. Wie bereits erwähnt, tritt dieses Syndrom am häufigsten auf, wenn MAOIs gleichzeitig mit anderen serotonergen Wirkstoffen wie SSRIs eingenommen werden oder wenn Venlafaxin, ein SNRI, kurz nach einem MAOI verabreicht wird. Wenn Patienten von einem SSRI mit kurzer Halbwertszeit auf einen MAOI umgestellt werden, ist es wichtig, dass zwischen dem Absetzen des SSRI und dem Beginn der Einnahme des MAOI eine zweiwöchige Auswaschphase eingehalten wird. Wenn Fluoxetin der SSRI ist, der eine lange Halbwertszeit hat, sollte die Auswaschphase 5 Wochen betragen.4 Andere unerwünschte Wirkungen können bei MAOIs auftreten, wie orthostatische Hypotonie, Gewichtszunahme, sexuelle Dysfunktion und Schlaflosigkeit.
Aufgrund der hohen Rate an Arzneimittelwechselwirkungen mit diesen Wirkstoffen ist bei der Verschreibung an Patienten mit Asthma, die sympathomimetische Bronchodilatatoren verwenden, Vorsicht geboten. Bei Patienten mit Bluthochdruck können MAOIs eine orthostatische Hypotonie hervorrufen, insbesondere bei gleichzeitiger Behandlung mit Diuretika.
Serotonin-Noradrenalin-Wiederaufnahmehemmer4,10: Die SNRIs wie Desvenlafaxin, Duloxetin und Venlafaxin können ebenfalls als Mittel der ersten Wahl verwendet werden (TABELLE 4). Diese Medikamente sind sicherer als TCAs, und ihre unerwünschten Wirkungen sind denen von SSRIs ähnlich, einschließlich Übelkeit, Erbrechen und sexueller Funktionsstörungen sowie erhöhtem Blutdruck.
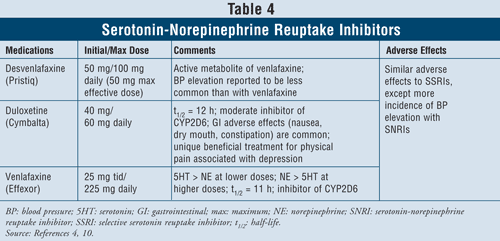
Venlafaxin führt nachweislich in 3 % bis 13 % der Fälle zu einem Anstieg des Blutdrucks, während Desvenlafaxin nur in 1 % bis 2 % der Fälle zu einem Anstieg des Blutdrucks führt.10 Daher wird empfohlen, Venlafaxin bei Patienten mit unkontrolliertem Bluthochdruck nicht einzusetzen, da der Wirkstoff die Erkrankung verschlimmern kann. Duloxetin hat eine stärkere Noradrenalinaktivität als die beiden vorgenannten Wirkstoffe und ist daher bei körperlichen Symptomen wie Muskelschmerzen, Kopfschmerzen, Magenproblemen und generalisierten Schmerzen, die häufig bei schwer depressiven Patienten auftreten, hilfreich. Aufgrund seiner Wirksamkeit bei Schmerzsymptomen wurde Duloxetin auch für andere Indikationen wie Fibromyalgie und diabetische periphere neuropathische Schmerzen zugelassen.15 Schließlich haben alle drei Wirkstoffe bei niedrigeren Dosen eine höhere Serotonin- als Noradrenalin-Aktivität und bei höheren Dosen eine höhere Noradrenalin- als Serotonin-Aktivität, so dass sie dosisabhängige unerwünschte Wirkungen haben.
Andere Antidepressiva4,10: Es gibt mehrere andere Antidepressiva, die sich in ihrem Wirkmechanismus von den zuvor beschriebenen Medikamentenklassen unterscheiden.
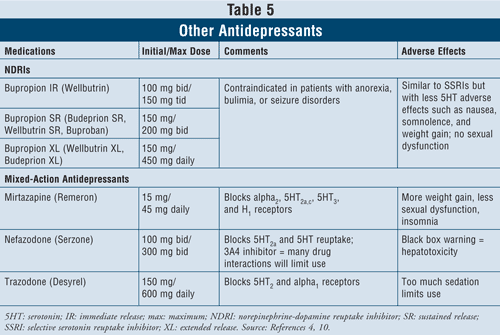
Die Noradrenalin-Dopamin-Wiederaufnahmehemmer (NDRIs) wie Bupropion mit sofortiger Wirkstofffreisetzung (IR) der Marke Wellbutrin (auch in langwirksamen Darreichungsformen wie Wellbutrin XL, Wellbutrin SR, Budeprion SR, Budeprion XL und Buproban erhältlich) können als Mittel der ersten Wahl zur Behandlung von Depressionen eingesetzt werden (TABELLE 5). Ihre unerwünschten Wirkungen ähneln denen der SSRI, mit minimalen Serotonin-Effekten wie Übelkeit und Gewichtszunahme und geringen oder keinen sexuellen Funktionsstörungen. Bupropion wirkt sich bei einigen Patienten nachweislich positiv auf die Symptome der Parkinson-Krankheit aus, kann aber auch einige psychotische Symptome hervorrufen, möglicherweise aufgrund seiner agonistischen Wirkung auf das dopaminerge System.16
Schließlich gibt es noch drei weitere Antidepressiva mit gemischter Wirkung: Mirtazapin, Nefazodon und Trazodon (TABELLE 5). Alle drei Wirkstoffe blockieren unterschiedliche Serotoninrezeptoren und haben daher unterschiedliche Wirkungen. Mirtazapin verursacht eine stärkere Gewichtszunahme, da es den Appetit steigert. Nefazodon ist wegen seiner Hepatotoxizität und der Hemmung des CYP3A4-Enzyms, die zu Wechselwirkungen mit anderen Arzneimitteln führt, nur begrenzt einsetzbar. Trazodon blockiert in hohem Maße die Serotoninrezeptoren und bindet kaum an die Muskarinrezeptoren. Unerwünschte Wirkungen wie Sedierung, Kopfschmerzen, Gedächtnisstörungen, Mundtrockenheit und Verstopfung können auftreten. Vorsicht ist auch bei der Anwendung von Trazodon bei Männern wegen des Risikos eines Priapismus geboten.
Schlussfolgerung
Im Allgemeinen haben sich antidepressive Medikamente als gleichermaßen wirksam erwiesen; Daher sollte die Wahl des Medikaments auf der Grundlage von unerwünschten Wirkungen, Wechselwirkungen mit anderen Medikamenten, der Sicherheit und den Präferenzen des Patienten erfolgen. Es gibt mehrere Algorithmen, an denen sich der Arzt bei der Behandlung des Patienten orientieren kann, insbesondere der kürzlich aktualisierte Algorithmus des Texas Department of State Health Services für die Behandlung von MDD (Stand Juli 2008).17 Wenn Patienten teilweise ansprechen, kann der Arzt die Dosis erhöhen, auf einen anderen Wirkstoff umsteigen oder eine Kombination von Antidepressiva verabreichen. Im Gegenteil, wenn Patienten nicht ansprechen oder das Medikament nicht vertragen, ist der Wechsel zu einem anderen Wirkstoff ebenfalls angebracht, wobei zu berücksichtigen ist, dass die therapeutische Wirkung in der Regel zwischen 4 und 6 Wochen eintritt, auch wenn unerwünschte Wirkungen bereits nach einer Woche der Behandlung auftreten können.4,17 Darüber hinaus treten die unerwünschten Wirkungen zwar zu Beginn der Behandlung auf, verschwinden aber in der Regel nach 2 bis 3 Wochen.4,17 Dennoch kann das Antidepressivum, das am ehesten eine Verbesserung und Sicherheit des Patienten gewährleistet, zumindest teilweise durch Ausprobieren ermittelt werden. Angesichts der Schwierigkeit, vorherzusagen, welches Medikament für einen einzelnen Patienten sowohl wirksam als auch verträglich sein wird, ist die Kenntnis eines breiten Spektrums von Antidepressiva umsichtig und nützlich.
1. Song F, Freemantle N, Sheldon TA, et al. Selective serotonin reuptake inhibitors: meta-analysis of efficacy and acceptability. BMJ. 1993;306:683-687.
2. Geddes JR, Freemantle N, Mason J, et al. SSRIs versus other antidepressants for depressive disorder. Cochrane Database Syst Rev. 2000;(2):CD001851.
3. Rush AJ, Wisniewski SR, Warden D, et al. Selecting among second-step antidepressant medication monotherapies: predictive value of clinical, demographic, or first-step treatment features. Arch Gen Psychiatry. 2008;65:870-881.
4. American Psychiatric Association. Diagnostisches und statistisches Handbuch psychischer Störungen, vierte Auflage, Textrevision (DSM-IV-TR). Washington, DC: American Psychiatric Association; 2000.
5. Arbeitsgruppe für Major Depressive Disorder. Guideline Watch: Praxisleitlinien für die Behandlung von Patienten mit schwerer depressiver Störung. 2nd ed. Washington, DC: American Psychiatric Association; 2005.
6. Cain RA. Navigation in der Sequenced Treatment Alternatives to Relieve Depression (STAR*D)-Studie: Praktische Ergebnisse und Implikationen für die Depressionsbehandlung in der Primärversorgung. Prim Care Clin Office Pract. 2007;34:505-519.
7. Depression. World Health Organization. www.who.int/mental_health/management/depression/definition/en. Zugriff am 5. Oktober 2009.
8. Dipiro JT, Talbert RL, Yee GC, et al. Pharmacotherapy: A Pathophysiologic Approach. 6th ed. New York, NY: McGraw-Hill; 2005.
9. Revisions to product labeling. Suizidalität und antidepressive Medikamente. FDA. www.fda.gov/downloads/Drugs/DrugSafety/InformationbyDrugClass/UCM173233.pdf. Abgerufen am 5. Oktober 2009.
10. Drug information. Micromedex Healthcare Series. Greenwood Village, CO: Thomson Micromedex. www.micromedex.com. Abgerufen am 5. Oktober 2009.
11. Shin J-G, Park J-Y, Kim M-J, et al. Inhibitory effects of tricyclic antidepressants on human cytochrome P450 enzymes in vitro: mechanism of drug interaction between TCAs and phenytoin. Drug Metab Dispos. 2002;30:1102-1107.
12. Brown CH. Überblick über Arzneimittelwechselwirkungen mit SSRIs. US Pharm. 2008;33(1):HS3-HS19.
13. Spina E, Scordo MG, D’Arrigo C. Metabolic drug interactions with new psychotropic agents. Fundam Clin Pharmacol. 2003;17:517-538.
14. Bergstrom RF, Peyton AL, Lemberger L. Quantification and mechanism of the fluoxetine and tricyclic antidepressant interaction. Clin Pharmacol Ther. 1992;51:239-248.
15. Cymbalta (Duloxetinhydrochlorid) package insert. Indianapolis, IN: Eli Lilly and Company; Februar 2009. http://pi.lilly.com/us/cymbalta-pi.pdf. Abgerufen am 5. Oktober 2009.
16. Goetz CG, Tanner CM, Klawans HL. Bupropion in Parkinson’s disease. Neurology. 1984;34:1092-1094.
17. Suehs B, Argo TR, Bendele SD, et al. Texas Medication Algorithm Project Procedural Manual. Major Depressive Disorder Algorithms. Texas Department of State Health Services; Juli 2008. www.dshs.state.tx.us/mhprograms/pdf/TIMA_MDD_Manual_080608.pdf. Abgerufen am 5. Oktober 2009.
Für Kommentare zu diesem Artikel wenden Sie sich bitte an [email protected].