Solu, josta haara nousee, on konidioforin jalkaosan solu, joka erottuu muista vegetatiivisista soluista siitä, että sen alkuperäisen seinämän sisäpuolella on ruskeapigmenttinen sekundaariseinän paksuuntuma. Varsi kasvaa apikaalisesti, kunnes se saavuttaa noin 100 µm:n pituuden, jolloin sen kärki turpoaa muodostaen konidioforin vesikkelin, jonka halkaisija on noin 10 µm. Tämän jälkeen vesikkelistä nuppenee yksi kerros lukuisia primaarisia sterigmoja, joita kutsutaan metulaeiksi, ja sekundaariset sterigmat, phialidit, nuppuvat metulaen paljastuneista kärjistä. Phialidit ovat kantasoluja, jotka myöhemmin käyvät läpi toistuvia epäsymmetrisiä jakautumisia muodostaen pitkiä, halkaisijaltaan noin 3 µm:n pituisia enteroblastisten konidien ketjuja (kuva 7).
Klassinen geneettinen analyysi, joka tehtiin eristämällä ja analysoimalla mutantteja, määritteli Aspergilluksen konidien muodostumisen geneettiset peruspiirteet. Arvioitiin, että 300-1000 geenilokusta liittyy konidiaatioon, kun verrattiin konidiaatioon vaikuttavien lokusten mutaatiofrekvenssejä muiden toimintojen mutaatiofrekvensseihin (Martinelli & Clutterbuck, 1971). MRNA-lajien analyysi osoitti, että noin 6 000 ilmeni kasvullisessa myseelissä ja lisäksi 1 200 löytyi viljelmistä, jotka sisälsivät konidioforeja ja konidioita; 200 näistä ylimääräisistä mRNA:ista löytyi itse konidioista. Vain noin 2 prosentilla A. nidulansin mutanteista, joista puuttui konidioita, oli vikoja konidioforien kasvuun ja kehitykseen liittyvissä vaiheissa, ja 85 prosentilla konidiaatiomutanteista oli vikoja myös vegetatiivisessa hyfojen kasvussa ja kompetenssin saavuttamisessa.
Erityisesti kahdella geenillä on keskeinen rooli konidioforin morfogeneesissä: nämä ovat ”bristle”-geeni (brlA), jolla on vikoja vesikkelin ja metulan muodostumisessa, ja ”abacus”-geeni (abaA), jossa konidia on korvattu helmimäisillä hyfojen pituuksilla, joten sillä on oletettavasti vika konidien nuppuuntumisessa fialidista ja lopullisessa septoinnissa. Kolmas geeni, wetA, on viallinen itiöiden kypsymisen varhaisessa vaiheessa. WetA-mutanttien konidioista puuttuu pigmentti ja hydrofobisuus; ne autolyysoituvat muutaman tunnin kuluttua eivätkä ilmentä useita itiöspesifisiä mRNA:ita. wetA -geenin transkripti puuttuu brlA- ja abaA-mutanteista (eli brlA ja abaA ovat epistaattisia wetA:n suhteen), ja kaksoismutanttien tutkimukset osoittavat, että nämä kolme geeniä toimivat järjestyksessä: brlA → abaA → wetA.
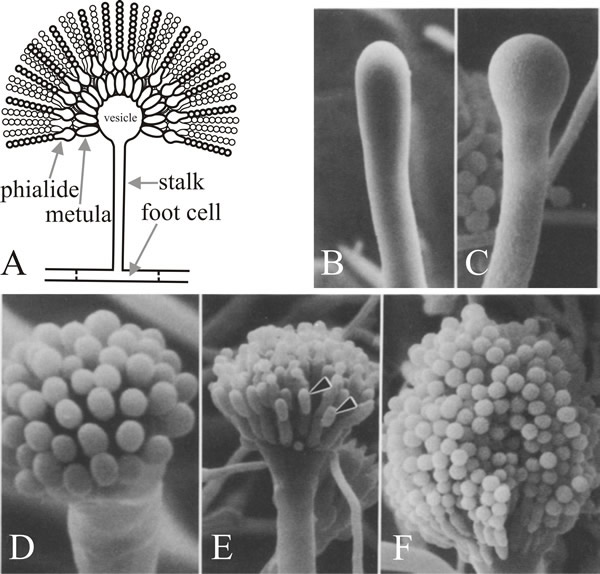
A. nidulansin konidioforin kehityksen mutaatioanalyysin silmiinpistävä piirre on se, että ainoastaan näiden kolmen geenin mutaatiot aiheuttavat vikoja konidioforin ja itiöiden morfogeneesissä, kun taas jopa 1 000 muuta geenipesäkettä aiheuttavat mutaatioina konidiaation puuttumisen. Tämä viittaa siihen, että brlA, abaA ja wetA ovat säätelijöitä, jotka integroivat muiden sellaisten geenien ilmentymistä, joita tarvitaan konidiation kannalta, mutta jotka eivät itse ole erikoistuneet siihen. Monet Aspergillus conidiation -mutantit olivat viallisia myös sukupuolisessa lisääntymisessä, joten toinen päätelmä on, että morfogeneettisten geenien käyttö eri kehitysprosesseissa on jossain määrin säästeliästä. Oletettavasti eri kehitysmoodit käyttävät rakenteellisia geenejä, jotka eivät ole yksinomaan kehitysgeenejä, vaan toimivat lukuisissa eri reiteissä, ja niiden kehityspesifisyyden antavat niille säätelijät, joihin ne reagoivat. Tätä kuvaa ajatus siitä, että eukaryoottien kehityksen avain on kyky käyttää suhteellisen harvoja säätelygeenejä monien muiden geenien toiminnan integroimiseen.
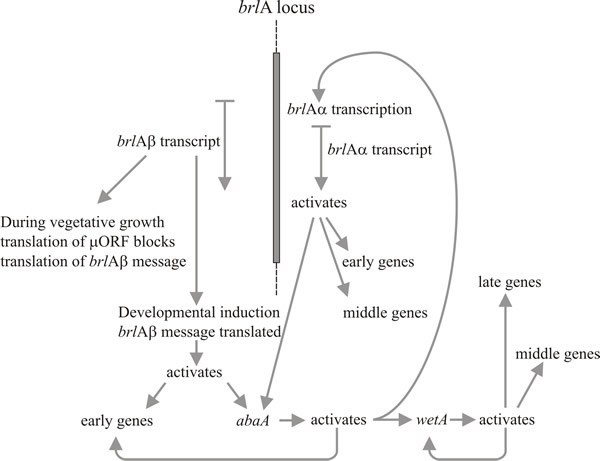
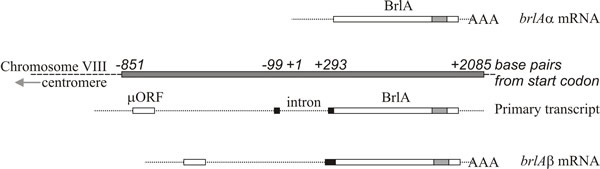
Molekyylianalyysi tukee tulkintaa, jonka mukaan brlA, abaA ja wetA ovat säätelygeenejä; brlA-sekvenssi koodaa sinkkisormiproteiinia, joka on sekvenssispesifinen DNA:ta sitova transkriptioaktivaattori, joka aktivoi kehitystä sääteleviä kohdegeenejä (kuva 8). Tämä ei kuitenkaan ole koko tarina, sillä brlA-tuotteella on erilainen affiniteetti eri kohdegeeneihin. Itse asiassa brlA-lokus koostuu päällekkäisistä transkriptioyksiköistä (kuva 9), joista alavirran puoleinen yksikkö on nimetty brlAα:ksi ja ylävirran puoleinen yksikkö brlAβ:ksi; niiden tuotteet ratkaisevat keskenään kaksi klassista kehitysongelmaa, nimittäin sen, miten reagoida johonkin signaaliin, ja sen, miten ylläpitää tuota vastetta sen jälkeen, kun signaali on hävinnyt.
Kahdella brlA-transkriptioyksiköllä on sama lukukehys suurimman osan pituudestaan, mutta brlAβ:llä on ylimääräiset 23 aminohappojäännöstä kyseisen lukukehyksen aminoterminaalisessa päässä, ja sen transkriptiolla on myös erillinen 41 aminohappojäännöksen pituinen lukukehys (jota kutsutaan µORF:ksi) lähellä 5′-loppua. µORF-tuote tukahduttaa translaation alempana olevasta (BrlA) lukukehyksestä, ja vaikka brlAβ-transkripti voidaan havaita kasvullisissa hyfoissa, BrlA-peptidiä ei tuoteta. µORF:n aiheuttama repressio poistuu vasta, kun sienirihmasto on pätevä, mikä todennäköisesti ilmaistaan typpirajoituksena (yleinen ympäristösignaali sporulaation käynnistymiselle Ascomycota-heimossa), joka vähentää aminoasyyli-tRNA-varastoja ja häiritsee µORF:n translaation säätelyä. Kun µORF:n vaikutus on pysähtynyt, BrlA-peptidi voidaan kääntää olemassa olevasta transkriptistä.
Tämän prosessin löytäjä kuvasi konidiaatioreitin aktivoitumista ”translaation laukaisuksi” (Timberlake, 1993), mikä viittaa siihen, että translaation laukaisu on keino tehdä erilaistumisesta herkkää hyfan ravitsemustilalle. Kompetentti hyfa on siis valmis aloittamaan konidioforikehityksen, mutta konidiaatioreitin peruuttamaton aktivoituminen estetään translaatiorepressiolla, joka ylläpitää vegetatiivista kasvua, kunnes sporulaatio-olosuhteet ovat ihanteelliset.
BrlA:n aktivoitumista pidetään siis konidioforin kehityksen ensimmäisenä askeleena, ja sen tuote puolestaan aktivoi joukon konidiaatiospesifisiä geenejä, joiden joukossa on seuraava säätelijä, abaA. AbaA-tuote on myös DNA:ta sitova transkriptiosäätäjäproteiini, joka tehostaa brlA:n indusoimien rakennegeenien ilmentymistä. BrlA- ja abaA-geenit ovat vastavuoroisia aktivaattoreita, koska abaA aktivoi myös brlA:ta. Tietenkin brlA:n ilmentymisen on tapahduttava ennen kuin abaA voi ilmentyä, mutta brlA:n abaA:n aktivoituminen vahvistaa brlA:n ilmentymistä ja tekee polun etenemisestä käytännössä ulkoisista tapahtumista riippumatonta. AbaA-tuote aktivoi myös muita rakennegeenejä ja viimeisen säätelygeenin, wetA:n, joka aktivoi itiöspesifisiä rakennegeenejä. Koska brlA ja abaA eivät ilmentyisi erilaistuvissa konidioissa, wetA osallistuu todennäköisesti niiden ilmentymisen aktivoimiseen itiöissä (ja ehkä myös phialidissa; kun nykyinen itiöydin saavuttaa kypsymisvaiheen, jossa tarvitaan wetA:n säätelemiä geenejä, phialidien ytimet on ”käännyttävä takaisin” konidion aloitustilaan seuraavan itiön muodostumisen aloittamiseksi). WetA:n ilmentyminen aktivoituu aluksi fialidissa brlA:n ja abaA:n peräkkäisellä vaikutuksella, minkä jälkeen se autoreguloituu (wetA-tuote aktivoi wetA:n transkription). Tämän jälkeen wetA:n positiivinen autoregulaatio ylläpitää sen ilmentymistä sen jälkeen, kun konidioidi on erotettu (fyysisesti ja sytologisesti) fialidista.
Timberlake (1993) kutsui tätä mekanismia takaisinkytkentäiseksi fiksaatioksi (feedback fixation): keskeisten säätelysekvenssien vastavuoroinen aktivoituminen, takaisinkytkentäinen aktivoituminen ja autoregulaatio vahvistavat koko reitin ilmentymistä tehden siitä riippumattoman ulkoisista ympäristövihjeistä, jotka ovat käynnistäneet sen, ja mahdollistavat sen, että itiö voi jatkaa kypsymistään myös sen jälkeen, kun se on irrotettu fialidista. Konidioforin kehitys, kuten monet muutkin morfogeneettiset prosessit, jakautuu luonnollisesti peräkkäisiin vaiheisiin. Tämä säätelyverkko osoittaa, miten translaation käynnistäminen voi liittää morfogeneettisen polun toisaalta kompetenssin kehittymiseen ja toisaalta käynnistymiseen vastauksena ympäristövihjeisiin. Initiaation jälkeen takaisinkytkentä johtaa kehityspäätöksellisyyteen klassisessa embryologisessa mielessä, jossa morfogeneesi jatkuu myös silloin, kun se on irrotettu initiaatioympäristöstä.
Valitsimme tässä jaksossa tarkoituksellisesti perustaksi kuvauksemme noin 50 vuotta sitten tehtyyn tutkimustyöhön, joka alkoi suurella joukolla mutaatioita, joilla oli muuttuneita konidiaatiofenotyyppejä, ja jatkui ”klassisilla” tutkimuksilla geenien segregaatioista ja geenien komplementaatiosta (Martinelli & Clutterbuck, 1971). Sen lisäksi, että se osoittaa, miten ymmärryksemme sporulaatiosta on saavutettu, se osoittaa, kuinka arvokasta on käyttää näitä ”vanhanaikaisia” tekniikoita tällaisten ilmiöiden tutkimiseen.
Emmekä voi kuitenkaan jättää huomiotta sitä laajaa tutkimusta, joka on saatu päätökseen Aspergilluksen kasvun ja kehityksen taustalla olevista molekyylimekanismeista. Nämä tutkimukset ovat vahvistaneet, että sporulaation avaintapahtuma on brlA:n koodaaman sinkkisormitranskriptiotekijän aktivoituminen ja että abaA- ja wetA-geenit ovat välttämättömiä konidiation säätelijöitä. AbaA:n koodaama transkriptiotekijä aktivoituu brlA:n toimesta metulaen erilaistumisen jälkeen ja konidioforin kehityksen keskivaiheilla, ja abaA:n aktivoima wetA -geeni toimii konidiaation myöhäisvaiheessa ohjaamalla ratkaisevien soluseinäkomponenttien synteesiä ja muuttamalla kypsyvän konidion aineenvaihduntaa. Aspergillus nidulansissa nämä kolme geeniä muodostavat keskeisen säätelyreitin, joka yhdessä muiden geenien kanssa ohjaa konidiaatiokohtaista geeniekspressiota ja geenien aktivoitumisjärjestystä, joka liittyy kehityskompetenssin hankkimiseen, konidioforin kehitykseen ja itiöiden kypsymiseen (Lee ym., 2016).
Monet näkökohdat näistä kehityspoluista ovat säilyneet konservoituneina myös muissa aspergilloissa. Aspergillus-suvun jäsenet kuuluvat yleisimmin tavattaviin sieniin, ja kaikki lisääntyvät suvuttomasti muodostamalla pitkiä konidien ketjuja. Useita lajeja, kuten Aspergillus oryzae ja Aspergillus niger, käytetään teollisuudessa entsyymien tuotannossa ja elintarvikkeiden jalostuksessa, kun taas Aspergillus flavus on vastuussa elintarvikkeiden pilaantumisesta tuottamalla voimakkaimpia tunnettuja luonnossa esiintyviä syöpää aiheuttavia aineita, aflatoksiineja. Toinen huolta aiheuttava laji on opportunistinen ihmispatogeeni Aspergillus fumigatus, joka tuottaa valtavan määrän pieniä hydrofobisia konidioita ensisijaisena leviämiskeinonaan ja josta on tullut laajalle levinnyt ilmateitse leviävä sienipatogeeni kehittyneissä maissa. Immuunipuutteisilla potilailla A. fumigatus aiheuttaa invasiivisen aspergilloosin, jonka kuolleisuus on suuri. BrlA-AbaA-WetA-kehityssignaalireitti on konservoitunut näiden Aspergillus-lajien konidiaatiossa (Yu, 2010; Tao & Yu, 2011; Krijgsheld ym., 2013). Lisäksi proteomi-, transkriptomi- ja metabolomitutkimukset ovat antaneet yksityiskohtaisen kuvan dynaamisista muutoksista, joita tapahtuu monissa tuhansissa geeneissä, transkripteissa, entsyymeissä ja aineenvaihduntareaktioissa Aspergillus-konidioiden muodostumisen, kypsymisen, lepotilan ja itämisen aikana (van Leeuwen ym., 2013; Novodvorska ym., 2016; Teertstra ym., 2017).
Päivitetty heinäkuussa, 2019