S- ja p-lohkon alkuaineiden ionisaatioenergiat
Jaksollisen järjestelmän kolmannella rivillä olevien alkuaineiden ionisaatioenergiat noudattavat samaa kaavaa kuin \(Li\) ja \(Be\) alkuaineiden ionisaatioenergiat (taulukko \(\(\PageIndex{2}\)): Ionisaatioenergiat kasvavat tasaisesti, kun elektroneja poistetaan valenssiorbitaaleilta (tässä tapauksessa 3s tai 3p), minkä jälkeen ionisaatioenergia kasvaa erityisen paljon, kun elektroneja poistetaan täytetyiltä ydintasoilta, kuten taulukon \(\(\PageIndex{2}\) lihavoitu diagonaaliviiva osoittaa. Näin ollen jaksollisen järjestelmän kolmannella rivillä suurin ionisaatioenergian lisäys vastaa neljännen elektronin poistamista \(Al\):sta, viidennen elektronin poistamista Si:stä ja niin edelleen – eli elektronin poistamista ionista, jonka valenssielektronikonfiguraatio on edellisen jalokaasun valenssielektronikonfiguraatio. Tämä kuvio selittää, miksi alkuaineiden kemiaan liittyy yleensä vain valenssielektroneita. Liian paljon energiaa tarvitaan joko sisäelektronien poistamiseen tai jakamiseen.
| Elementti | \(I_1\) | \(I_2\) | \(I_3\) | \(I_3\) | \(I_4\) | \(I_5\) | \(I_6\) | \(I_7\) | |
|---|---|---|---|---|---|---|---|---|---|
| *Inner-kuoren elektroni | |||||||||
| Na | 495.8 | 11,577.4.4 | – | – | – | – | |||
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16,090.1 | 4963.6 | 6274.0 | 21,267.4.3 | – |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4.3 | ||
| Cl | 1251.2 | 2297.7 | 3822 | 5158.6 | 6540 | 9362 | 11 018.2 | ||
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 | ||
Esimerkki \(\PageIndex{1}\): Korkein neljäs ionisaatioenergia
Ennusta, millä näistä alkuaineista on korkein neljäs ionisaatioenergia niiden sijainnin perusteella jaksollisessa järjestelmässä: B, C tai N.
Annettu: kolme alkuainetta
Kysytty: alkuaine, jolla on korkein neljäs ionisaatioenergia
Strategia:
- Luettele kunkin alkuaineen elektronikonfiguraatio.
- Määrittele, poistetaanko elektroneja täytetystä vai osittain täytetystä valenssikuoresta. Ennusta, millä alkuaineella on korkein neljäs ionisaatioenergia, tunnistaen, että korkein energia vastaa elektronien poistumista täytetystä elektronikuoresta.
Ratkaisu:
A Nämä alkuaineet sijaitsevat kaikki jaksollisen järjestelmän toisella rivillä ja niillä on seuraavat elektronikonfiguraatiot:
- B: 2s22p1
- C: 2s22p2
- N: 2s22p3
B Alkuaineen neljäs ionisaatioenergia (\(I_4\)) määritellään neljännen elektronin poistamiseen vaadittavaksi energiaksi:
\
Koska hiilellä on neljä ja typellä viisi valenssielektronia, niiden neljäs ionisaatioenergia vastaa elektronin poistamista osittain täytetystä valenssikuoresta. Boorin neljäs ionisaatioenergia vastaa kuitenkin elektronin poistamista täytetystä 1s2-alakuoresta. Tämän pitäisi vaatia paljon enemmän energiaa. Todelliset arvot ovat seuraavat: B, 25 026 kJ/mol, C, 6223 kJ/mol ja N, 7475 kJ/mol.
Harjoitus \(\PageIndex{1}\): Pienin toinen ionisaatioenergia
Ennusta niiden sijainnin perusteella jaksollisessa järjestelmässä, millä näistä alkuaineista on pienin toinen ionisaatioenergia: Sr, Rb vai Ar.
Vastaus
\(\ce{Sr}\)
Taulukon \(\PageIndex{2}\) ensimmäisestä sarakkeesta käy ilmi, että ensimmäisillä ionisaatioenergioilla on taipumus kasvaa jaksollisen järjestelmän kolmannella rivillä. Tämä johtuu siitä, että valenssielektronit eivät varjosta toisiaan kovin hyvin, jolloin efektiivinen ydinvaraus kasvaa tasaisesti koko rivillä. Valenssielektronit vetäytyvät näin ollen voimakkaammin ytimeen, joten atomikoko pienenee ja ionisaatioenergiat kasvavat. Nämä vaikutukset edustavat saman kolikon kahta puolta: vahvemmat sähköstaattiset vuorovaikutukset elektronien ja ytimen välillä lisäävät entisestään elektronien poistamiseen tarvittavaa energiaa.
Ensimmäinen ionisaatioenergia vähenee kuitenkin Al:lla (3s23p1) ja S:llä (3s23p4). Näiden ”poikkeusten” elektronikonfiguraatiot antavat vastauksen siihen, miksi. Alumiinin täytetyn 3s2-alakuoren elektronit suojaavat paremmin 3p1-elektronia kuin toisiaan ydinvaraukselta, joten s-elektronit tunkeutuvat lähemmäksi ydintä kuin p-elektroni ja p-elektroni poistuu helpommin. Väheneminen S:n kohdalla johtuu siitä, että samassa p-orbitaalissa olevat kaksi elektronia hylkivät toisiaan. Tämä tekee S-atomista hieman vähemmän stabiilin kuin muutoin olisi odotettavissa, mikä pätee kaikkiin ryhmän 16 alkuaineisiin.
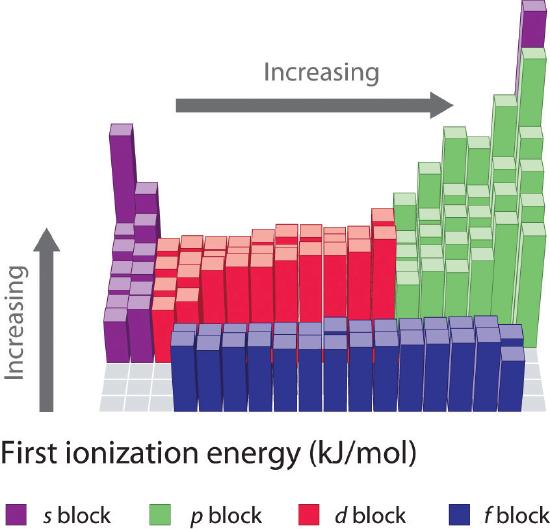
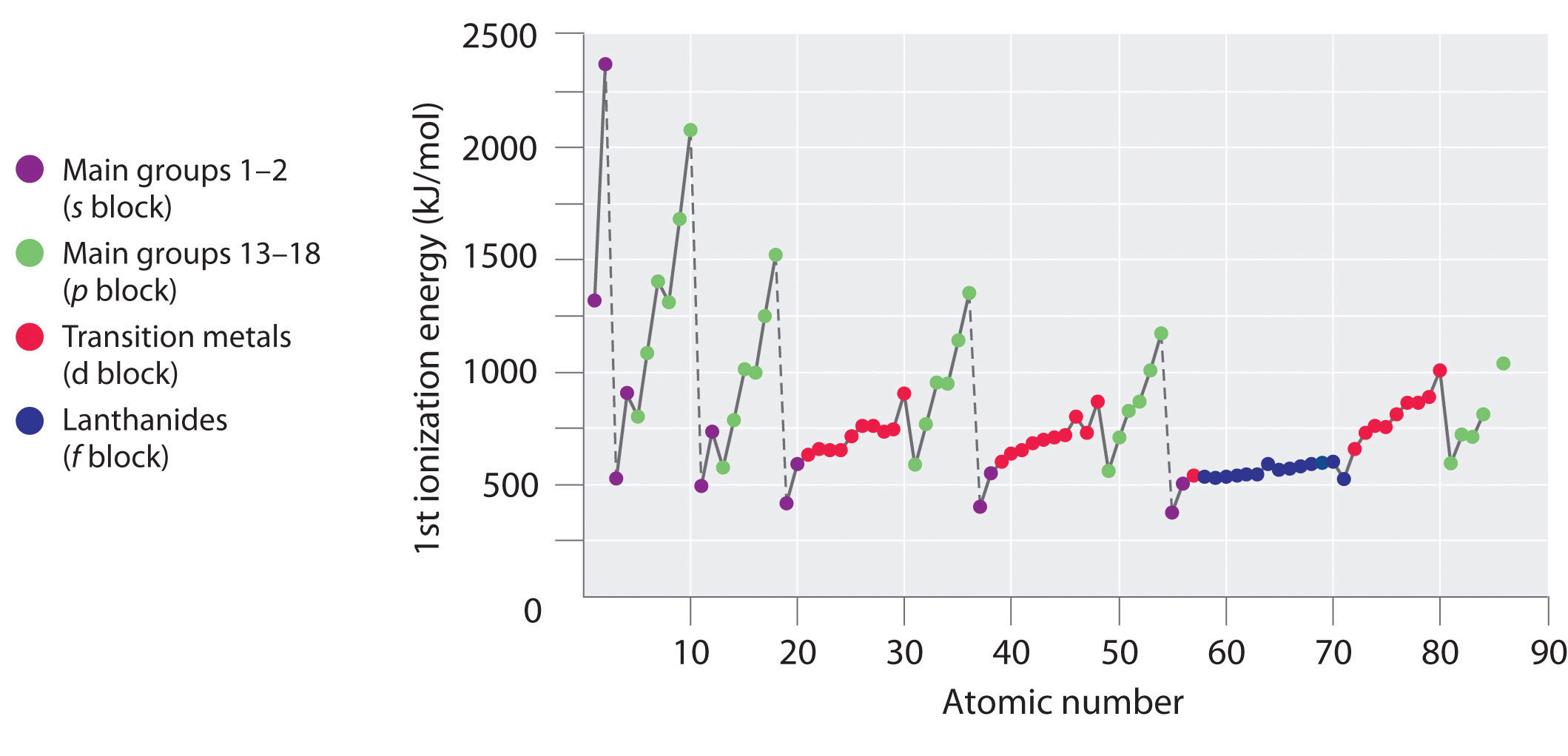
Jaksollisen järjestelmän kuuden ensimmäisen rivin alkuaineiden ensimmäiset ionisaatioenergiat on piirretty kuvassa \(\PageIndex{1}\) ja esitetty numeerisesti ja graafisesti kuvassa \(\PageIndex{2}\). Nämä kuvat havainnollistavat kolme tärkeää suuntausta:
- S- ja p-lohkojen toisella (Li:stä Ne:ksi), neljännellä (K:sta Kr:ksi), viidennellä (Rb:stä Xe:ksi) ja kuudennella (Cs:stä Rn:ksi) rivillä havaittavat muutokset noudattavat samankaltaista kaavaa kuin kuvattu kaava jaksollisen järjestelmän kolmannen rivin osalta. Siirtymämetallit sisältyvät kuitenkin neljännelle, viidennelle ja kuudennelle riville ja lantanidit kuudennelle riville. Siirtymämetallien ja lantanidien ensimmäiset ionisaatioenergiat ovat jokseenkin samankaltaisia. Ionisaatioenergiat kasvavat vasemmalta oikealle kullakin rivillä, poikkeamia esiintyy ns2np1:ssä (ryhmä 13), ns2np4:ssä (ryhmä 16) ja ns2(n – 1)d10:ssä (ryhmä 12).
- Ensimmäiset ionisaatioenergiat pienenevät yleensä saraketta alaspäin. Vaikka pääkvanttiluku n kasvaa pylvästä alaspäin, täytetyt sisäkuoret varjostavat tehokkaasti valenssielektroneita, joten efektiivinen ydinvaraus kasvaa suhteellisen vähän. Näin ollen atomeista tulee suurempia, kun ne saavat elektroneja. Valenssielektronit, jotka ovat kauempana ytimestä, ovat vähemmän tiukasti sidottuja, jolloin niitä on helpompi irrottaa, jolloin ionisaatioenergiat pienenevät. Suurempi säde vastaa tyypillisesti pienempää ionisaatioenergiaa.
- Kahdesta ensimmäisestä suuntauksesta johtuen alkuaineet, jotka muodostavat helpoimmin positiivisia ioneja (joilla on pienimmät ionisaatioenergiat), sijaitsevat jaksollisen järjestelmän vasemmassa alakulmassa, kun taas alkuaineet, joita on vaikeinta ionisoida, sijaitsevat jaksollisen järjestelmän oikeassa yläkulmassa. Näin ollen ionisaatioenergiat kasvavat yleensä diagonaalisesti vasemmalta alhaalta (Cs) oikeaan yläkulmaan (He).

Yleisesti \(I_1\) kasvaa diagonaalisesti jaksollisen järjestelmän vasemmasta alareunasta oikeaan yläreunaan.
Galliumilla (Ga), joka on ensimmäinen alkuaine siirtymämetallien ensimmäisen rivin jälkeen, on seuraava elektronikonfiguraatio: 4s23d104p1. Sen ensimmäinen ionisaatioenergia on huomattavasti pienempi kuin välittömästi edeltävän alkuaineen, sinkin, koska galliumin täytetty 3d10-alakuori sijaitsee 4p-alakuoren sisällä, mikä suojaa yksittäistä 4p-elektronia ytimestä. Kokeet ovat paljastaneet jotain vieläkin kiinnostavampaa: galliumin ionisoituessa poistuvat toinen ja kolmas elektroni ovat peräisin 4s2-orbitaalista, eivät 3d10-alikuoresta. Galliumin kemiaa hallitsee syntyvä Ga3+-ioni, jolla on 3d10-elektronikonfiguraatio. Tämä ja vastaavat elektronikonfiguraatiot ovat erityisen stabiileja, ja niitä esiintyy usein raskaammissa p-lohkon alkuaineissa. Niitä kutsutaan joskus pseudojalokaasukonfiguraatioiksi. Itse asiassa alkuaineista, joilla on nämä konfiguraatiot, ei tunneta kemiallisia yhdisteitä, joissa elektronit on poistettu (n – 1)d10-täytteisestä alikuoresta.