Subatomiset hiukkaset
Kaikki alkuaineet koostuvat äärimmäisen pienistä ainehiukkasista, joita kutsutaan atomeiksi. Voimme määritellä atomin alkuaineen yksinkertaisimmaksi hiukkaseksi, jolla on kyseisen alkuaineen kemialliset ominaisuudet. Kemiallisiin ominaisuuksiin kuuluvat alkuaineen fysikaalinen tila (kaasu, neste tai kiinteä), sidostyypit, joita alkuaine voi muodostaa, miten se reagoi muiden alkuaineiden kanssa jne. Näin ollen kaikilla atomeilla, jotka muodostavat alkuaineen hiili, on samat kemialliset ominaisuudet.
Fyysikot ovat onnistuneet räjäyttämään atomit hajalle kymmeniksi erilaisiksi subatomisiksi hiukkasiksi, joista kuitenkin vain kolme on stabiileja. Nämä ovat protonit, neutronit ja elektronit. Protonit ovat positiivisesti varattuja hiukkasia, niillä on massa, ja ne sijaitsevat atomin keskellä eli ytimessä. Neutronit ovat varauksettomia, niillä on massa, ja ne sijaitsevat myös atomin ytimessä. Neutronit sitoutuvat protonien kanssa tavalla, joka auttaa vakauttamaan ydintä. Jos neutroneita on liikaa tai liian vähän, atomiydin voi olla epävakaa ja hajota muodostaen muita alkuaineita. Näitä atomeja kutsutaan radioaktiivisiksi. Vaikka neutronin massa on hieman suurempi kuin protonin massa, voimme antaa molemmille suhteellisen massan 1 (1 atomimassayksikkö eli amu). Neutronit ja protonit muodostavat lähes koko atomin massan. Kolmas stabiili hiukkastyyppi on elektroni. Elektronilla on negatiivinen varaus, mutta se on erittäin pieni ja sen massa on vain 1/1850 protonin tai neutronin massasta. Ne ovat niin pieniä, että ne eivät käytännössä vaikuta atomin massaan. Elektronit liikkuvat ytimen ympärillä valtavan suurella nopeudella, itse asiassa lähes valonnopeudella. Vaikka kuvaamme usein, että elektronit kiertävät ytimen ympärillä, kuten planeetat kiertävät aurinkoa, moderni fysiikka opettaa meille, että tämä malli on virheellinen. Nämä ”kiertoradat” ovat itse asiassa ytimen ympärillä olevia alueita, joilla elektronit ovat suurimman osan ajasta. Tätä aluetta kutsutaan usein elektronien ”pilveksi”. Totta, se on edelleen tietty alue, mutta se on hieman muodottomampi kuin pallomainen kiertorata. Yksinkertaisuuden vuoksi ajattelemme näitä kuitenkin usein satelliitin kaltaisina ympyränmuotoisina kiertoratoina. Alla oleva kuva esittää nykyistä malliamme typpiatomista.
Typpiytimessä on 7 protonia (oranssi) ja 7 neutronia (vihreä). Ytimen ympärillä olevat tummennetut alueet edustavat elektroniorbitaaleja (pilviä). Elektronit (sininen) löytyvät jostain näiden orbitaalien sisältä. (Huomautus: kuvaa ei ole piirretty mittakaavassa. On esitetty, että jos ydin olisi koripallon kokoinen, elektronit olisivat noin kuuden kilometrin eli 3¾ mailin päässä!)
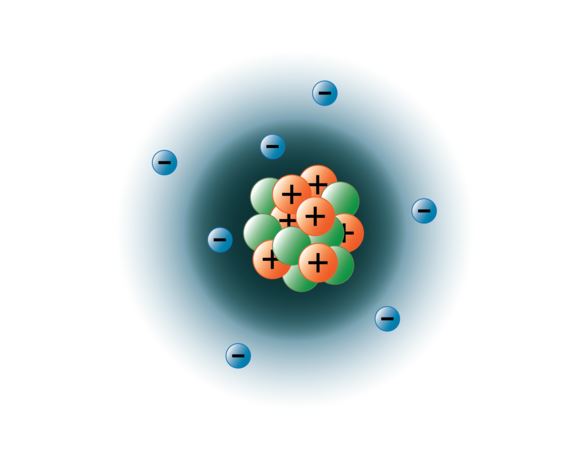
kuvan on luonut BYU-I:n opiskelija Hannah Crowder syksyllä 2013
Atominumero
Katsele jaksollista järjestelmää vielä kerran ja huomaa kunkin laatikon yläreunassa oleva numero. Tämä numero on alkuaineen atomiluku, ja se on yksilöllinen jokaiselle eri alkuaineelle. Esimerkiksi vedyn järjestysluku on 1. Millään muulla alkuaineella ei ole järjestyslukua 1. Hiilen järjestysluku on 6, eikä millään muulla alkuaineella ole järjestyslukua 6. Järjestysluvun merkitys on siinä, että se kertoo kunkin alkuaineen ytimessä olevien protonien määrän. Näin ollen kaikilla vetyatomeilla on 1 protoni ja kaikilla hiiliatomeilla on 6 protonia. Koska atomeilla on neutraali varaus, atomiluku kertoo myös atomissa olevien elektronien määrän. Kemiallisessa merkintätavassa alkuaineen järjestysluku ilmaistaan alkuaineen symbolin edessä olevana alaviitteenä. Esimerkiksi hiili ilmaistaan muodossa 6C.
Massaluku (atomimassa)
Atomin massaluku kertoo nimensä mukaisesti atomin kokonaismassan. Koska elektronin massa on erittäin pieni (häviävän pieni), sitä ei käytetä massalukua laskettaessa. Muista myös, että jokaisen protonin sekä jokaisen neutronin massa on 1 atomimassayksikkö. Siksi massaluku on atomin protonien ja neutronien summa. Koska massaluku on protonien lukumäärä plus neutronien lukumäärä ja atomiluku on protonien lukumäärä, voit löytää neutronien lukumäärän yksinkertaisesti vähentämällä atomiluvun massaluvusta. Oletetaan esimerkiksi, että meillä on alkuaine, jonka järjestysluku on 8 ja massaluku 17. Näistä tiedoista voit päätellä, että tässä alkuaineessa on 8 protonia, 8 elektronia ja 9 neutronia (17-8=9). Nyt heitän sinulle mutkapallon. Kuten edellä mainittiin, kaikilla tietyn alkuaineen atomeilla on sama määrä protoneja (atomiluku), mutta tietyn alkuaineen eri atomeilla voi olla eri määrä neutroneita. Sanomme, että nämä ovat alkuaineen eri isotooppeja. Esimerkiksi vetyä on kolme isotooppia. Yleisimmän isotoopin, joka muodostaa 99,98 prosenttia kaikista vetyatomeista, massaluku on 1. Se koostuu siis yhdestä protonista, yhdestä neutronista ja yhdestä elektronista. Muiden harvinaisempien vedyn isotooppien massaluvut ovat 2 ja 3. Nämä isotoopit eivät ole yhtä yleisiä. Nämä isotoopit eroavat toisistaan ytimissään olevien neutronien lukumäärän suhteen, mutta kaikissa kolmessa on yksi protoni ja yksi elektroni. Todellisuudessa jokaisesta alkuaineesta on luonnossa esiintyviä isotooppeja, joilla kullakin on oma massalukunsa. Kemiallisessa merkintätavassa tietyn isotoopin massaluku ilmaistaan alkuaineen symbolin edessä olevana ylinumerona. Vedyn kolme isotooppia ilmaistaan muodossa 1H, 2H ja 3H. Koska jokainen alkuaine koostuu useista isotoopeista, herää kysymys, mikä on tietyn alkuaineen todellinen massa. Jos taas katsot edellä olevaa jaksollista järjestelmää, huomaat numeron kunkin laatikon alareunassa. Tämä on alkuaineen atomipaino. Esimerkiksi vedyn atomipaino on 1,00794 amu. Tämä luku on saatu laskemalla vedyn kolmen isotoopin keskimääräinen massa. Oletetaan esimerkiksi, että luokassamme on 10 poikaa. Jos haluaisimme tietää poikien keskimääräisen painon, laskisimme poikien yksittäiset painot yhteen ja jakaisimme summan 10:llä. Näin saisimme poikien keskipainon. Atomipainot määritetään pohjimmiltaan näin. Koska 1H on vedyn runsain isotooppi, on järkevää, että vedyn atomipaino on hyvin lähellä 1H:n atomimassaa.
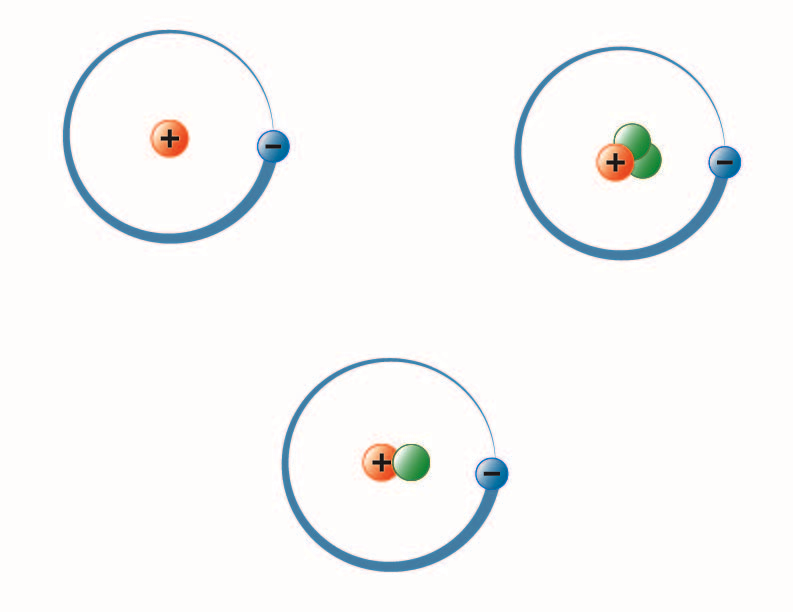
kuvan on luonut BYU-I:n opiskelija Hannah Crowder syksyllä 2013
Yllä oleva kuva esittää vedyn kolme isotooppia. Yleisimmässä (vasemmalla ylhäällä) ytimessä on yksi protoni eikä yhtään neutronia. Deuteriumissa (alhaalla) on yksi protoni ja yksi neutroni ja tritiumissa (ylhäällä oikealla) on yksi protoni ja kaksi neutronia.
**Voit käyttää alla olevia painikkeita siirtyäksesi tämän moduulin seuraavaan tai edelliseen lukukertaan**

