Introduction
Metaani (CH4) on merkittävä kasvihuonekaasu. Sen päästöt luonnonympäristöistä, kuten kosteikoista, meristä ja sedimenteistä, muodostavat yli 70 % ilmakehän metaanista maailmanlaajuisesti (IPCC, 2007). Julkaistujen tietojen arvioinnissa kävi ilmi, että kosteikkojen, järvien, jokien, jokisuistojen ja valtamerien metaanipäästöjen määrät vaihtelevat (vähenevässä järjestyksessä, lisäkuva S1). Pelkästään luonnontilaisten kosteikkojen osuus biogeenisen CH4:n tuotannosta on 62 prosenttia (Kirschke et al., 2013; Nazaries et al., 2013), ja kosteikkojen päästöt hallitsevat metaanilähteiden vuosien välistä vaihtelua (Bousquet et al., 2006). Sen sijaan meriekosysteemien valtavan pinta-alan osuus CH4:n luonnollisista lähteistä on vain noin 8 % (Nazaries et al., 2013). Maailmanlaajuisista valtamerten metaanipäästöistä alle 10 % tulee suistoalueilta (Bange et al., 1994).
Metaanogeneesi eli metaanin biologinen muodostuminen tapahtuu metanogeenisten arkeoiden toimesta, jotka tuottavat metaania pääasiassa H2/CO2:sta, metyyliryhmistä tai asetaatista anoksisissa olosuhteissa (Thauer et al., 2008). Tätä reaktiota katalysoi metyyli-koentsyymi M-reduktaasi (MCR). Tämän entsyymin alayksikköä koodaava mcrA-geeni on yleisesti käytetty geenimarkkeri molekyylitutkimuksissa (Conrad, 2007; Bridgham ym., 2013). mcrA-geenimarkkerin etuna on, että se tavoittaa sekä metanogeenien fylogeneettiset että toiminnalliset tunnusmerkit ja tarjoaa suuren sekvensointisyvyyden tälle erityiselle toiminnalle (Luton et al., 2002; Borrel et al., 2013; Yang et al., 2014). Suuri määrä mcrA-sekvenssejä haettiin erilaisista luonnollisista ympäristöistä. Julkisen mcrA-aineiston avulla voidaan poimia yleisiä ekologisia malleja ja tutkia muokkaavia ympäristögradientteja globaalissa ja alueellisessa mittakaavassa. Lisäksi saatavilla on tietokanta, jossa on yhteenveto 152 metanogeenisen isolaatin fysiologisista ominaisuuksista1 (Jabłoński et al., 2015). Hiljattain genomien yhdistämisessä havaittiin epätavallisia mcrA-sekvenssejä uudessa Methanofastidiosa-luokassa (Nobu et al., 2016) ja uusissa Bathyarchaeota- (Evans et al., 2015) ja Verstraetearchaeota- (Vanwonterghem et al., 2016) fyloissa. Nämä uudet havainnot laajensivat tietämystämme potentiaalisten metanogeenien monimuotoisuudesta, mutta eivät kuitenkaan hämärtäneet mcrA-geenin soveltuvuutta molekyylimarkkerina suurimmalle osalle metanogeenisistä yhteisöistä.
Tähän mennessä metanogeenisiä yhteisöjä on havaittu kosteikoissa, sedimenteissä, ikirouta-alueilla, riisipelloilla, mädättämöissä, geotermisissä lähteissä ja hydrotermisissä purkautumislähteissä (Conrad, 2007; Thauer et al., 2008; Wagner ja Liebner, 2009). Metanogeenisen yhdyskuntarakenteen havaittiin olevan yhteydessä ympäristön pH:hon, lämpötilaan, suolapitoisuuteen, pohjaveden tasoon ja kasvillisuuden dynamiikkaan eri alueellisissa ja ajallisissa mittakaavoissa (Megonigal et al., 2005; Milferstedt et al., 2010; Frank-Fahle et al., 2014; McCalley et al., 2014; Cui et al., 2015; Liebner et al., 2015). Esimerkiksi asetoklastista metanogeneesiä haittaa yleensä matala pH, koska se vähentää asetaatin dissosiaatiota (Megonigal et al., 2005; Kotsyurbenko et al., 2007). Kasvillisuus voi tarjota labiilia, korkealaatuista orgaanista hiiltä metanogeenien polttoaineeksi juurten eksudaattien tai detrituksen muodossa, joten kasvien eksudaatit suosivat yleensä asetoklastisia metanogeeneja pääasiassa soilla (Bridgham et al., 2013). Merivedestä peräisin oleva sulfaatti estää metaanintuotantoa vuorovesikosteikoissa, minkä vuoksi suolapitoisuutta on käytetty metaanipäästöjen yleisenä ennustajana (Holm ym., 2016). Tiibetinjärven sedimenteistä tehty tutkimus osoitti, että suolapitoisuuden nousu estää hydrogenotrofisia metaanigeenejä mutta tehostaa asetoklastista metaanogeneesiä (Liu et al., 2016). Nämä tutkimukset viittasivat metanogeenisten yhteisöjen ympäristötekijöihin, mutta niissä on keskitytty yksittäisiin elinympäristöihin tai rajoitettuihin alueellisiin mittakaavoihin.
Metanogeenien sopeutumisen ymmärtäminen erilaisiin ympäristömuutoksiin edellyttää kuitenkin mikrobiyhteisöjen koostumuksen ja ympäristöolosuhteiden välisten korrelaatioiden systemaattista ja kokonaisvaltaista tutkimista (Lozupone ja Knight, 2007). Tällä hetkellä vain muutamat tutkimukset käsittelevät metanogeenisten yhteisöjen leviämistä ja elinympäristöjen suodattumista (Auguet et al., 2010; Barreto et al., 2014). Hypoteesimme on, että metanogeenisiin kokoonpanoihin vaikuttaa pääasiassa elinympäristön suodattuminen ja että sitä ohjaavat globaalit ympäristösäädöt. Kun otetaan huomioon, että metaanipäästöjen määrät vaihtelevat suuresti luonnon ekosysteemien välillä, näiden ekosysteemien metaanogeenisten kokoonpanojen koostumuksen, monimuotoisuuden ja biogeografian eksplisiittinen integrointi voi olla olennaista määritettäessä metaanintuotannon vastetta nykyiseen ja tulevaan ilmastonmuutokseen. Tässä metatutkimuksessa pyritään täyttämään metaanigeenien biogeografiaan, monimuotoisuuteen ja sen ympäristökontrolliin liittyvät aukot käyttämällä julkisesti saatavilla olevia mcrA-sekvenssitietoja ja kirjallisuutta, joita täydennetään metaanigeeni-isolaattien fysiologisilla tiedoilla.
Aineisto ja menetelmät
Tiedonkeruu
Hain mcrA-sekvenssejä, jotka ovat saatavissa GenBankista (tammikuu 2016)2. Jokaisesta osumasta tarkistettiin alkuperäinen paperi ja sen mukaiset mcrA-sekvenssit jäsennettiin mukautetulla Perl-skriptillä. Koska keskityimme luonnollisiin ympäristöihin, metanogeeniset mcrA-sekvenssit saatiin luonnollisista elinympäristöistä, ja ne luokiteltiin maaperään, järvi-, suisto-, meri- ja hydrotermisiin sedimentteihin sekä mutavyöryihin. Kloonikirjastojen sekvenssien lisäksi mukaan otettiin viisi seuraavan sukupolven sekvensoinnista (NGS) peräisin olevaa kirjastoa. Sekvenssit ladattiin ottamatta huomioon suhteellista runsautta alkuperäisessä tietokokonaisuudessa. Koska kloonikirjastojen sekvenssit kattavat pääasiassa runsaat fylotyypit, kun taas NGS-menetelmällä voidaan tallentaa paljon syvempi diversiteetti, teimme kompromissin NGS-tietojen käyttämiseksi, mutta lievensimme sekvensointimenetelmien erilaisesta resoluutiosta johtuvaa mahdollista virhettä. Siksi valitsimme vain sellaisten runsaiden OTU:iden edustavat sekvenssit, joiden suhteellinen runsaus on yli 1 %. Lisäksi hylkäsimme ne NGS-sekvenssit, jotka eivät läpäisseet translaatiotarkastusta nukleotidisekvensseistä proteiinisekvensseiksi tai joiden laatu oli heikko (sekvenssit < 250 bps). Lopulta muodostimme tietokokonaisuuden, joka sisälsi 4466 ainutlaatuista mcrA-sekvenssiä 94 globaalisti jakautuneesta paikasta (kuva 1 ja lisätaulukot S1, S2). Emme myöskään vähentäneet aineistosta mahdollisten arkeaalisten metanotrofisten mcrA-sekvenssejä, jotka väistämättä havaittiin genomitutkimuksessa (Conrad, 2007). Tämä osa ei kuulu tämän tutkimuksen piiriin.
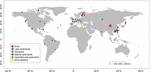
KUVIO 1. Tässä tutkimuksessa käytettyjen kohteiden sijainti. Kohteet ryhmiteltiin kuuteen eri luokkaan niiden elinympäristöjen mukaan ja merkittiin eri väreillä. Yhteenveto kuudesta luontotyypistä on esitetty lisätaulukoissa S1 ja S2.
Geografiset koordinaatit ja ympäristöolosuhteet, mukaan lukien pH, suolapitoisuus, korkeusasema, keskimääräinen vuotuinen ilmalämpötila (MAAT) ja keskimääräinen vuotuinen sademäärä (MAP), poimittiin kullekin tässä tutkimuksessa tarkastellulle tutkimuskohteelle vastaavista julkaisuista edellyttäen, että tiedot olivat saatavilla (ks. lisätaulukko S1). Ottaaksemme huomioon puuttuvat ympäristöparametrit useista tutkimuksista, määrittelimme kvalitatiivisesti joitakin ympäristömuuttujia asiaankuuluvan kirjallisuuden paikkakuvausten mukaisesti ja muutimme sitten nämä luokkatiedot puolimetrisiksi numeerisiksi arvoiksi, esimerkiksi määrittelimme merisedimentit, hydrotermiset sedimentit, vulkaanisen mudan ja soodajärven sedimenttinäytteet ”suolaisiksi”, maaperä- ja makeanveden järvisedimenttinäytteet ”ei-suolaisiksi” ja mangrove- ja suistonäytteet ”sekanäytteiksi”.
Sekvenssien raakakäsittely
Sekvenssien käsittely toteutettiin Mothur-ohjelmistoalustalla (Schloss et al., 2009). Eri kirjastojen sekvenssit yhdistettiin ennen käsittelyä. Sekvenssit, joiden pituus oli alle 350 bp tai joissa oli yli 8 epäselvää emästä, hylättiin. Tämän jälkeen nämä sekvenssit kohdistettiin mcrA-sekvenssien ennalta kohdistettuun osajoukkoon, joka haettiin FunGene-tietokannasta osoitteesta http://fungene.cme.msu.edu/ (Fish et al., 2013). Kimeeriset sekvenssit tunnistettiin Mothur-ohjelmistolla käyttäen uchime-menetelmää (Edgar et al., 2011), jossa itse tietokokonaisuus oli referenssinä. Tämän jälkeen kelvollisia mcrA-geenin nukleotidisekvenssejä käytettiin korjaamattomien pareittaisten etäisyyksien laskemiseen linjattujen DNA-sekvenssien välillä, ja ne luokiteltiin edelleen operatiivisiin taksonomisiin yksiköihin (OTU) 84 prosentin raja-arvolla, joka vastaa 97 prosenttia 16S rRNA -geenin osalta (Yang et al., 2014). Kunkin mcrA OTU:n runsaus kirjattiin vain läsnäolona tai poissaolona. Lisäsimme OTU:iden taksonomisen luokittelun tarkkuutta ottamalla huomioon sekä nukleotidi- että aminohapposekvenssit. DNA-tasolla taksonominen identiteetti määritettiin Mothur-alustalla viitetietokannan mukaisesti (Yang et al., 2014). Proteiinitasolla linjattuja proteiinisekvenssejä käytettiin puun rakentamiseen ARB:ssä, minkä jälkeen taksonominen määritys perustui vastaavaan tietokantaan. Jos OTU:n määritys oli epäjohdonmukainen, blastasimme manuaalisesti sekä nukleotidi- että proteiinisekvenssin NCBI:ssä ja määritimme lopullisen taksonomisen identiteetin ottamalla huomioon kyselyn kattavuuden (>95 %), identiteetin (>84 %) ja e-arvon (<1E-5). Proteiinisekvenssien osalta rajaus suvun tasolla viittasi 83,5 %:n kynnysarvoon (Hunger et al., 2011).
Ekologinen ja tilastollinen analyysi
Tilastollinen analyysi tehtiin eri R-paketeilla. Pääkoordinaatistoanalyysin (PCoA) ordinaatiot luotiin Jaccard-etäisyysmatriisien perusteella, jotka rakennettiin vegan-paketilla v2.2.0 (Oksanen ym., 2015). Permutatiivinen MANOVA (monimuuttujainen varianssianalyysi) suoritettiin Jaccard-matriisin (McArdle ja Anderson, 2001) vaihtelun lähteen arvioimiseksi vegaanissa 104 permutaation avulla. Jaccardin etäisyysmittaukset perustuvat lajien läsnäoloon/poissaoloon, mikä soveltuu paremmin meidän aineistoomme, sillä useimmat tutkimukset toimittivat vain edustavia sekvenssejä, kun taas tiedot runsauksista puuttuvat. Taksonomiset esiintymistiheydet eri elinympäristöissä visualisoitiin kuplaplottien avulla ggplot2-paketilla (v1.0.0) (Wickham, 2009). Muiden kuin suolaisen maaperän ja järvisedimentin yhteisöjen hierarkkinen klusterointianalyysi tehtiin R-funktiolla ’hclust’ (R Core Team, 2014). Saadut yhteisölliset klusterit kuvattiin alkuperäisten näytteiden pH- ja lämpötilajärjestelmän mukaan, koska PCoA:n avulla tunnistimme etukäteen, että sekä pH että lämpötila vaikuttavat metanogeenisten yhteisöjen koostumukseen ei-suolaisissa maaperissä ja järvisedimenteissä. Kunkin metanogeenisen linjan yhteys kuhunkin näistä klustereista määritettiin korrelaatioon perustuvan indikaattorilajianalyysin avulla (Dufrene ja Legendre, 1997). Indikaattorilajeiksi määritellään tässä yhteydessä lajit, joita esiintyy runsaasti tietyntyyppisessä elinympäristössä (spesifisyys) ja jotka esiintyvät pääasiassa kyseisessä elinympäristössä (uskollisuus). Tässä tutkimuksessa indikaattoritaksonit poimittiin indikaattorilaji-käsitteen tapaan ei-suolaisten maaperien ja järvisedimenttien indikaattoriarvon (IndVal-arvo) mukaan R-paketin labdsv (Roberts, 2016) avulla, jos todennäköisyys saada yhtä suuri indikaattoriarvo kuin havaittu määritettyjen iteraatioiden aikana on alle 0,05. Chao2-indeksit laskettiin kullekin näytteelle vegan-paketilla. Elinympäristöjen välisten Chao2-indeksien Wilcoxon-rank-summatesti suoritettiin R-funktiolla ”wilcox.test” (R Core Team, 2014). Elinympäristön suodatuksen vaikutuksen vakiinnuttamiseksi metanogeenisten arkeoiden isolaatteihin haettiin kuvattujen metanogeenisten viljelmien fysiologiset ja biokemialliset ominaisuudet3 ’Methanogenic archaea database’ -tietokannasta (Jabłoński et al., 2015). Niistä suodatettiin, luokiteltiin ja piirrettiin eristyslähteen mukaan isolaatit, joilla oli tietoa optimaalisesta NaCl-tarpeesta.
Tarkastellaksemme leviämisrajoituksen vaikutusta metanogeenisen yhteisön rakenteeseen tehtiin lineaarinen regressioanalyysi maantieteellisen etäisyysmatriisin ja yhteisön Jaccard-etäisyysmatriisin perusteella R-funktiolla ’lm’ (R Core Team, 2014). Suoritimme Mantelin ja osittaisen Mantelin testit arvioidaksemme leviämisrajoituksen vaikutuksia näiden kahden matriisin mukaan käyttäen jälleen R:n vegan-pakettia (Oksanen et al., 2015). Lisäksi 16 eurooppalaiseen maaperä- ja järvisedimenttinäytteeseen sovellettiin Moranin I-indeksiin perustuvaa monimuuttujaista spatiaalista analyysiä (spatiaalista PCA:ta) metanogeenien spatiaalisen rakenteen tutkimiseksi R ade4-paketin ”multispati”-funktiolla (Dray ja Dufour, 2007). Lisäksi näille 16 näytteelle toteutettiin Jaccardin etäisyysmatriisiin perustuva Wardin minimivarianssin klusterointi R-funktiolla ”hclust” (R Core Team, 2014), ja lisäksi projisoimme klusterointitulokset maantieteelliselle kartalle. Eurooppalainen shapefile osavaltiotason kartoitusta varten on saatavilla GSHHG-tietokannassa (v2.3.6)4. Kartta luotiin käyttämällä QGIS v2.18.25.
Tulokset
Biogeography of Methanogenic Archaea in Natural Environments
Haintiin mcrA-geenisekvenssit 94:stä maailmanlaajuisesti jakautuneesta luonnonympäristöstä. Kunkin 94 kohteen sijainti ja ekosysteemityyppi on esitetty kuvassa 1. Metanogeenisten linjojen esiintymisfrekvenssit (läsnäolo/poissaolo) yhdistettiin ekosysteemityypin mukaan ja havainnollistettiin kuvassa 2. Lyhyesti sanottuna Methanoregula on yleisin maaperässä havaittu taksoni yhdessä Methanobacteriumin, Methanosaetan, Methanocellan, Methanomassiliicoccuksen ja Methanosarcinan kanssa. Suistojen sedimenteissä havaittiin yleisesti Methanosaeta-, Methanobacterium-, Methanoregula- ja Methanoculleus-seekvenssejä. Lisäksi järvisedimenteissä esiintyi pääasiassa Methanoregulaa ja Methanosaetaa. Merisedimenteissä Methanoculleus ja Methanosaeta olivat yleisimpiä linjoja, joita seurasi Methanolinea.
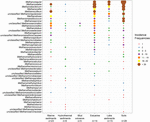
KUVIO 2. Methanoculleus ja Methanosaeta. Kuplakaavio, jossa esitetään metanogeenisten linjojen esiintymisfrekvenssit eri luonnonympäristöissä. Pystyakselilla oleva järjestys vastaa linjojen kokonaisesiintymistiheyden vähenemistä. Taksonomia on esitetty suvun tasolla. Jos sukutason määrittäminen ei ollut mahdollista, käytettiin seuraavaksi korkeampaa taksonomista tasoa. Näytteiden lukumäärä (n) on ilmoitettu kunkin elinympäristön osalta.
Vaikka monet taksonit havaittiin eri ympäristöissä, joillakin taksoneilla on edelleen ympäristöpreferenssejä. Methanoregula, taksoni, joka esiintyy usein muissa kuin merellisissä ja siirtymävaiheen ympäristöissä (maaperä, järvisedimentit ja suistot), puuttuu merellisistä elinympäristöistä (merisedimentit, hydrotermiset sedimentit ja mutavyöryt). Methanobacteriumia ja Methanocellaa, jotka ovat vallitsevia muissa kuin meriympäristöissä ja siirtymävaiheen ympäristöissä, tavataan harvoin merellisissä elinympäristöissä. Sitä vastoin Methanococcoides, joka on vallitseva suku merisedimenteissä, hydrotermisissä sedimenteissä ja mutavyöryissä, ei juurikaan esiinny maaperässä ja järvisedimenteissä. Lisäksi Methanogenium- ja Methanolacinia-linjoja esiintyy vain jokisuiden ja merien sedimenteissä, kun taas Methanospirillum- ja Methanosphaerula-linjoja esiintyy vain maaympäristöissä. Lisäksi joitakin tiettyjä taksoneita esiintyy yksinomaan hydrotermisissä sedimenteissä, kuten Methanocaldococcus, Methanothermococcus, Methanopyrus, Methanotorris ja Methanococcus. Vaikka jotkin sukulinjat, kuten Methanosaeta, esiintyvät useimmissa ympäristöissä, mitään sukulinjaa ei voida pitää kaikkialle levinneenä.
Linjaryhmien rikkaus oli suurinta suistoalueen sedimenteissä, joissa eri sukulinjojen esiintymistiheys on myös tasaisempi. Sen sijaan mutavyöryissä ja hydrotermisissä ekosysteemeissä metanogeeninen monimuotoisuus on suhteellisen vähäistä. Maaperässä ja järvisedimenteissä, jotka ovat samanlaisia kuin suistoalueet, esiintyy monimuotoisia metanogeenisia kokoonpanoja.
Metanogeenisten yhteisöjen alfadiversiteetti luonnonympäristöissä
Metanogeenisten arkeoiden rikkaus Chao2-indeksin mukaan vaihteli suuresti ekosysteemityyppien välillä (kuva 3). Alfa-diversiteettien suoraa vertailua varten ja kohtuullisen kompromissin saamiseksi näytteiden välille suoritettiin osittaisnäytteenotto 15 sekvenssiin kutakin paikkaa kohti. Chao2-indeksi osoittaa, että suiston sedimenteissä metanogeenien lajirikkaus on suurin kaikissa kuudessa ekosysteemityypissä (lisätaulukko S3), mikä korostaa kuplakaavion tuloksia (kuva 2). Maaperän ja järvisedimenttien, joiden lajirikkaus on pienempi kuin suistonäytteiden, Chao2-indeksit ovat merkitsevästi korkeammat kuin merisedimenttien ja hydrotermisten sedimenttien, ja merisedimenttien ja hydrotermisten sedimenttien välillä ei ole merkitseviä eroja (Täydentävä taulukko S3) (Täydentävä taulukko S3).
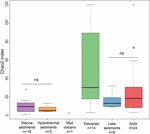
KUVIO 3. Eri ekosysteemityyppien Chao2-indeksejä kuvaava laatikkokuva. Kaavio perustuu 15 sekvenssiä sisältäviin osittaisnäytteistettyihin tietokokonaisuuksiin kustakin paikasta, jotta alfadiversiteettimittojen vertailu olisi kestävämpää. Kunkin elinympäristön näytteiden lukumäärä ilmoitetaan ”n” -merkinnällä elinympäristömerkinnän alapuolella. Merkintä ”ns” tarkoittaa, että Wilcoxonin testissä ei ole tilastollista merkitsevyyttä. Tilastollinen tulos alfadiversiteetistä OTU-tasolla on esitetty lisätaulukossa S3.
Global Controls on Methanogenic Communities in Natural Environments
94 globaalisti jakautunutta metanogeenista yhteisöä ryhmiteltiin ordinaatiokuvioon soveltamalla Jaccardin etäisyysmatriisiin perustuvaa PCoA:ta. PCoA-analyysin mukaan ensimmäinen ja toinen akseli selittävät yhdessä 16,3 % kokonaisvarianssista. Näytteiden väliset vaihtelut voidaan siten suurelta osin selittää suolapitoisuudella (kuva 4). Koska joissakin tapauksissa suolapitoisuuksia koskevia alkuperäisiä tietoja ei ollut saatavilla, luokittelimme nämä näytteet kvalitatiivisesti suolapitoisiksi, sekoittuneiksi (välimuotoisiksi) ja ei-suolapitoisiksi näytteiksi edellä kuvatulla tavalla. Suolaiset ja ei-suolaiset näytteet erottuvat tehokkaasti toisistaan ensimmäistä akselia pitkin. Sekanäytteet sijoittuvat kokonaisuudessaan suolaisen ja ei-suolaisen näytteen väliin. Jaccardin etäisyysmatriisiin perustuva permutaatio-MANOVA viittaa myös siihen, että suolaisuus on ensisijainen abioottinen tekijä, joka kontrolloi maailmanlaajuisten metanogeenisten yhteisöjen jakautumista (R2 = 0,099, P < 0,001) (taulukko 1).
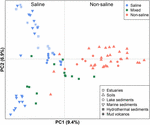
KUVIO 4. Suolapitoisuus. Metanogeenisten mcrA-geenisekvenssikirjastojen Jaccard-etäisyysmatriisiin perustuva pääkoordinaatistoanalyysi (PCoA), jossa verrataan 94 näytettä. PCoA on väritetty suolapitoisuuden mukaan: Punaiset symbolit merkitsevät ei-suolaisia ympäristöjä, siniset symbolit merkitsevät suolaisia ympäristöjä ja vihreät symbolit merkitsevät väliympäristöjä. Eri symbolit kuvaavat eri ympäristöjä. Akseleilla on merkitty piirrettyjen pääkoordinaattien selittämä prosenttiosuus vaihtelusta.

TAULUKKO 1. Kuuden elinympäristön kaikkien näytteiden Jaccardin etäisyysmatriisin permutaatio MANOVA-analyysi, jolla testattiin yhteisön varianssin yhteyttä eri ympäristömuuttujiin.
Lisäksi tarkistimme mahdollisen yhteyden metanogeenisten puhdasviljelmien eristyslähteen ja kasvun kannalta optimaalisen NaCl-pitoisuuden välillä. Metanogeenisten puhdasviljelmien optimaalinen NaCl-pitoisuus osoitti laskua merestä suistoihin, järvisedimentteihin ja maaperäekosysteemeihin (täydentävä kuva S2). Muutamat poikkeavat isolaatit ovat peräisin soodajärvien sedimenteistä tai hypersuolaisista maaperistä.
Ympäristön kontrollit ja metanogeeniset indikaattoritaksonit ei-suolaisissa maaperissä ja järvisedimenteissä
Yleismaailmallisessa mittakaavassa ei-suolaisista maaperistä ja järvisedimenteistä peräisin olevat metanogeeniset yhteisöt klusteroituvat tiiviisti (kuva 4), joten analysoimme tarkemmin ympäristöllisiä kontrollitekijöitä näiltä kahdelta elinympäristöltä peräisin oleville metanogeenisille yhteisöille, jotka edustavat kaikkiaan 33:aa tutkimuspaikkaa. Yhteisöihin perustuva klusterianalyysi näille kahdelle elinympäristötyypille paljasti neljä klusteria Jaccardin etäisyysmatriisin perusteella (täydentävä kuva S3). Permutatiivinen MANOVA viittaa siihen, että sekä pH (R2 = 0,099, P < 0,001) että lämpötila (R2 = 0,069, P < 0,001) vaikuttavat metanogeeniseen β- monimuotoisuuteen ei-suolaisissa maaperissä ja järvisedimenteissä (taulukko 2). Näin ollen määrittelimme neljä klusteria alkuperäisen näytteenottopaikan pH:n ja MAAT:n mukaan ja saimme pitkälti yhdenmukaisia alaryhmiä yhteisöjen klusterointiin (kuvat 5C,D). Ympäristöominaisuuksien ja näiden neljän yhteisöklusterin yhdistelmän ansiosta voimme määritellä nämä neljä alaryhmää neutraaliksi ja kylmäksi ryhmäksi 1, happamaksi ja kylmäksi ryhmäksi 2, happamaksi ja kohtalaiseksi ryhmäksi 3 ja neutraaliksi ja lämpimäksi ryhmäksi 4 (kuva 5). Jaccardin dissimilariteettimatriisiin perustuva PCoA-järjestys osoittaa, että PC1-akselilla suurin osa ryhmän 2 ja ryhmän 3 näytteistä on peräisin happamista maaperistä ja järvisedimenteistä, kun taas ryhmän 1 ja ryhmän 4 näytteet olivat pääasiassa neutraaleista ympäristöistä (kuva 5A). Lisäksi maltillisilta paikoilta (ryhmä 3) peräisin olevat näytteet erottuivat lämpimiltä ja kylmiltä paikoilta peräisin olevista näytteistä PC2-akselia pitkin, kun taas lämpimistä ympäristöistä peräisin olevat näytteet (ryhmä 4) erottuivat muista näytteistä PC3-akselia pitkin (kuva 5B). Näin ollen PCoA-ordinaation kolme ensimmäistä akselia selittävät 38,8 % kokonaisvaihtelusta.

TAULUKKO 2. Suolattoman maaperän ja järvisedimenttinäytteiden Jaccard-etäisyysmatriisiin perustuva permutaatio-MANOVA, jolla testataan yhteisöjen vaihtelun yhteyttä eri ympäristömuuttujiin.
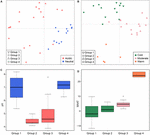
KUVIO 5. Yhteisön vaihtelun yhteys eri ympäristömuuttujiin. Jaccardin etäisyysmatriisiin perustuva pääkoordinaattianalyysin kuvaaja 33 ei-suolaisen maaperän ja järvisedimentin osalta. Osakaavio (A) esittää PC1:n ja PC2:n ja symbolit on väritetty pH:n mukaan, ja osakaavio (B) esittää PC2:n ja PC3:n ja symbolit on väritetty lämpötilan mukaan. Kolme ensimmäistä komponenttia selittävät 17,1, 11,7 ja 10 % varianssista. Laatikkokuvioissa näkyvät neljän tunnistetun alaryhmän pH (C) ja MAAT (keskimääräinen vuotuinen ilman lämpötila) (D). Kuvan C laatikon väri vastaa pH-luokkaa kuvassa (A). Laatikkokaavioiden värit osoittavat tilastollista merkitsevyyttä pareittaisen Wilcoxonin testin perusteella (P < 0,05), jossa samanväriset näytteet eivät eroa merkittävästi toisistaan. Vastaavasti väri kohdassa (D) seuraa lämpötilaryhmittelyä kohdassa (B). Alaryhmät viittaavat yhteisöjen samankaltaisuuksien hierarkkiseen klusterianalyysiin.
Tarkastelimme metanogeenisten linjojen esiintymistä kussakin alaryhmässä esiintymisfrekvenssien perusteella (kuva 6). Methanoregula vallitsee kaikentyyppisissä ei-suolaisissa elinympäristöissä. Methanoregulan lisäksi neutraalissa ja kylmässä alaryhmässä (ryhmä 1) esiintyy runsaasti Methanosaeta-, Methanobacterium- ja Methanosarcina-linjoja. Happamat ja kylmät -ryhmää 2 edustavat Methanobacterium, Methanocella ja Methanosarcina, kun taas Methanosaeta puuttuu täältä. Methanocella ja Methanosaeta ovat yleisiä happamassa ja kohtalaisessa ryhmässä 3. Neutraalissa ja lämpimässä ryhmässä 4 Methanolinea ja Methanosaeta ovat tärkeitä jäseniä. Tämä ryhmä on ainoa ryhmä, jossa Methanoculleus tunnistettiin.

KUVIO 6. Metanogeenisten linjojen esiintymisfrekvenssit neljässä määritellyssä metanogeenisten yhteisöjen ryhmässä maaperässä ja järvisedimentissä. Pystyakseli on järjestetty aakkosjärjestykseen. Palkin pituus vastaa kunkin linjan keskimääräisiä esiintymisfrekvenssejä vastaavassa ryhmässä. Virhepalkit edustavat tietyn taksonin keskihajontaa kyseisen ryhmän eri näytteissä. Tähdillä on merkitty erikoistuneet taksonit, joiden P-arvo on < 0,05. Taksonomia on esitetty suvun tasolla. Jos luokittelu sukutasolle ei ollut mahdollista, käytettiin seuraavaksi korkeampaa luokiteltavaa taksonomista tasoa. Neljän ryhmän kuvaus on esitetty kuvassa 5.
Kaikkien neljän ryhmän osalta taksonit, joiden esiintyvyys on korkea, ovat Methanoregula, Methanobacterium, Methanosarcina, Methanosaeta, Methanomassiliicoccus ja Methanocella. Erikoistuneet taksonit, jotka ovat huomattavasti enemmän edustettuina useimmissa tietyn ryhmän kohteissa, havaittiin indikaattorilajianalyysin perusteella, kuten edellä on kuvattu. Kaikkiaan 31 taksonista kuudella oli merkitsevä indikaattoriarvo (P < 0,05) (merkitty tähdellä kuvassa 6). Ryhmässä 1 (neutraali ja kylmä) esiintyi eniten spesialisteja Methanosaeta-, Methanolobus- ja Methanomethylovorans-linjojen kanssa. Methanobacterium toimi spesialistitaksonina kylmässä ja happamassa ryhmässä 2, kun taas Methanolinea tunnistettiin spesialistiksi ryhmässä 4 (neutraali ja lämmin), mutta sitä ei juuri havaittu muissa ryhmissä. Lisäksi Methanoregula on suurelta osin edustettuna happamassa ja maltillisessa ryhmässä 3.
Dispersal Limitation
Lineaarinen regressioanalyysi (R2= 0,05, P < 0,001) osoitti, että maantieteellisen etäisyyden ja metanogeenisen yhteisöllisyyden rakenteen välillä oli heikko korrelaatio maailmanlaajuisessa aineistossa. Samaan aikaan Mantelin testi osoitti, että ympäristömuuttujilla on korkeampi korrelaatio yhteisön rakenteeseen kuin maantieteellisillä etäisyyksillä (ks. taulukko 3). Tämä suuntaus vahvistetaan myös osittaisella Mantel-testillä, jolla kontrolloidaan autokorrelaatiovaikutuksia. Maantieteellisen etäisyyden kuvaaminen suhteessa Jaccard-yhteisön samankaltaisuuteen ei osoita selvää lineaarista trendiä, vaan kuvioita, jotka johtuvat pääasiassa näytteenottopisteiden globaalista jakaumasta (ks. lisäkuva S4).

TAULUKKO 3. JOHDANTO. Mantelin ja osittaisen Mantelin testin analyysit ympäristömuuttujien ja maantieteellisen etäisyyden vaikutuksen määrittämiseksi mikrobijakaumaan maailmanlaajuisessa aineistossa ja 16 eurooppalaisen näytteen alaotoksessa.
Voidaksemme analysoida tarkemmin leviämisen vaikutusta rajasimme analyysimme Eurooppaan, josta otettiin tihein ja tasaisin näytemäärä. Mantelin testit ja osittaiset Mantelin testit tällä osajoukolla toistivat trendin, jonka mukaan yhteisötiedot korreloivat enemmän ympäristömuuttujien kuin maantieteellisten etäisyyksien kanssa (ks. taulukko 3). Ympäristömuuttujat kontrolloivalla osittaisella Mantelin testillä ei havaittu tilastollisesti merkitsevää korrelaatiota mikrobiyhteisön ja maantieteellisen etäisyyden välillä. Näiden 16 eurooppalaisen paikan spatiaalinen PCA-analyysi osoittaa metanogeenisen yhteisön spatiaalisen rakenteen (23,7 prosenttia kokonaisvarianssista selittyi tällä rakenteella), mikä vastaa paikkojen positiivista spatiaalista autokorrelaatiota, kuten Moranin I-indeksi osoittaa (Moranin I = 0,4018). Ainoastaan ensimmäinen ominaisarvo oli vakaa ja vastasi näytteiden erottelua Keski-Euroopan ja Baltian maiden välillä (täydentävä kuva S5). Pieni aineisto kuitenkin vaikeuttaa tämän havaitun alueellisen rakenteen vahvaa liittämistä maantieteellisiin, ympäristömuuttujiin tai molempiin. Sen vuoksi teimme metanogeenisille yhteisöille klusterianalyysin edellä kuvatulla tavalla ja havaitsimme kolme ryhmää (kuva 7A), jotka heijastimme maantieteelliselle kartalle (kuva 7B). Klusterointi ei toistanut spatiaalisen PCA:n erottelua Itämeren varrella. Näin ollen joillakin maantieteellisesti hyvin lähellä toisiaan sijaitsevilla paikoilla on erilaisia metanogeenisten yhteisöjen rakenteita, ja ne yhdistyvät eri klustereihin. Toisaalta joillakin maantieteellisesti hyvin kaukana sijaitsevilla paikoilla on hyvin samankaltainen yhteisökoostumus, ja ne ryhmittyvät yhteen (kuva 7B). Ryhmien alueellinen hajaantuminen Euroopassa ei näytä vastaavan maantieteellistä rakennetta tai olevan sen rajoittama.
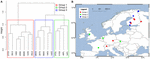
KUVA 7. Ryhmien alueellinen hajaantuminen Euroopassa. Jaccardin etäisyysmatriisin hierarkkinen klusterianalyysi 16 eurooppalaisen maaperä- ja järvisedimenttinäytteen kesken. Analyysissä käytettiin Wardin klusterointimenetelmää. Kohteet jaettiin kolmeen ryhmään, jotka on klusterointidendrogrammissa (A) väritetty eri suorakulmioilla, ja ne projisoitiin Euroopan kartalle (B).
Keskustelu
Biogeografian käsitteiden tunnistaminen ja soveltaminen mikrobiyhteisöihin on erittäin kiinnostavaa mikrobiologian alalla. Mikrobien biogeografiaa uskotaan ohjaavan neljän tärkeän prosessin evolutiivinen ja ekologinen vuorovaikutus: elinympäristön suodattuminen, leviäminen, ajautuminen ja mutaatio (Hanson et al., 2012). Vaikka ajelehtimisen ja mutaation vaikutus on tämän tutkimuksen tulkintakyvyn ulkopuolella, osoitamme, että metanogeenisten yhteisöjen globaalit mallit luonnollisissa ympäristöissä ovat olemassa. Tämä tutkimus osoittaa metanogeenisten yhteisöjen globaalin biogeografisen kuvion, joka liittyy enemmän elinympäristöjen suodattumiseen kuin maantieteelliseen leviämiseen. Esimerkiksi soodajärvien sedimenteistä saadut metanogeeniset yhteisöt klusteroituvat tiiviisti maantieteellisesti kaukana sijaitsevien merinäytteiden kanssa (kuva 4), ja hyvin samankaltaisia metanogeenisia yhteisöjä esiintyy Euroopan maaperä- ja järvisedimenteissä huolimatta siitä, että ne sijaitsevat hyvin kaukana toisistaan (kuva 7). Kaiken kaikkiaan pyrkimyksemme paljastaa mahdolliset leviämisrajoitukset paljastivat maantieteellisen sijainnin heikon vaikutuksen metanogeenisten yhteisöjen rakenteeseen, mikä on ristiriidassa ympäristöolosuhteiden selvän vaikutuksen kanssa. Saatavilla olevilla tiedoilla ei ole mahdollista sulkea lopullisesti pois alueellisia vaikutuksia mikrobiyhteisöihin. Näytteenottopaikat keskittyvät tiettyihin elinympäristöihin ja/tai alueisiin, ja näytteiden kokonaismäärä on vähäinen. Jos vaikutusta on, oletamme, että alueellisia vaikutuksia esiintyy vain alueellisella tai paikallisella tasolla. Paikallisia leviämisrajoituksia raportoitiin maantieteellisten esteiden aiheuttamista hypertermofiilisistä arkeoista (Whitaker et al., 2003), ammoniakkia hapettavista bakteereista paikallisilla suolamailla, mutta ei alueellisella tai mantereellisella mittakaavalla (Martiny et al., 2011), syvänmeren sedimenteissä esiintyvistä mikro-organismeista yhdessä ympäristöolosuhteiden kanssa (Schauer et al., 2011)., 2009), ja bakteereille suuressa joukossa heterogeenisia lumiympäristöjä, jotka johtuvat pääasiassa alloktonisen hiilen saatavuudesta (Lutz et al., 2016). Leviämisrajoituksen vähäinen vaikutus metanogeeneihin luonnollisissa ympäristöissä tarkoittaa sitä, että metanogeenit voivat levittäytyä satunnaisesti avaruuteen, valikoitua menestyksekkäästi paikalliseen ympäristöön, jos niiden fysiologiset vaatimukset täyttyvät, ja pystyä perustamaan vakaita yhteisöjä (Martiny ym., 2006; von Mering ym., 2007).
Elinympäristön suodattamisen käsite viittaa siihen, että lajeilla, joilla on samankaltaiset ekologiset tarpeet, pitäisi esiintyä yhtä aikaa useammin kuin sattumalta odotetaan (Weiher ja Keddy, 2001; Cornwell ym., 2006; Ulrich ym., 2010). Tuloksemme osoittavat, että metanogeenisten yhteisöjen koostumuksessa on suuria eroja meren ja kosteikkojen ja järvien ekosysteemien välillä, kun taas suistot sijoittuvat niiden väliin. Ympäristönäytteiden geenitutkimusjoukkoon perustuvia biogeografisia malleja on raportoitu myös yleisten bakteerien (Nemergut et al., 2011), metaanivuodon mikrobiomin (Ruff et al., 2015), ammoniakkia hapettavien arkeoiden (Cao et al., 2013), merien pelagisten ja pohjaeläinten bakteerien (Zinger et al., 2011) ja typpeä kierrättävien mikro-organismien (Church et al., 2008) osalta. Elinympäristön suodattamista raportoitiin erityisesti viljelemättömille arkeoille (Auguet et al., 2010), kokonaisille bakteeriyhteisöille erilaisissa ympäristöissä (von Mering et al., 2007; Chaffron et al., 2010) tai eteläamerikkalaisilla soilla alueellisessa mittakaavassa (Oloo et al., 2016) sekä tiettyjä bakteeriryhmiä, kuten metaania hapettavia (Knief, 2015) ja typpeä sitovia bakteereita (Nelson et al., 2016).
Tuloksemme osoittavat, että globaalissa mittakaavassa suolapitoisuus säätelee olennaisesti metaaniyhteisön koostumusta ja määrittää suuria eroja merellisten ja terrestristen metaaniyhteisöjen välillä. Myös soodajärvisedimenttien metanogeenit klusteroituvat merisedimenttien metanogeenien kanssa (kuva 4), mikä korostaa suolapitoisuuden globaalia vaikutusta. Tämä tulos on yhdenmukainen muiden 16S rRNA -geeniin perustuvien tutkimusten kanssa, jotka paljastavat, että suolapitoisuus on ensisijainen tekijä, joka muokkaa yleisten bakteeri- ja arkeaaliyhteisöjen maailmanlaajuisia malleja (Lozupone ja Knight, 2007; Auguet et al., 2010; Caporaso et al., 2011; Cao et al., 2013). Aiemmissa tutkimuksissa havaittiin myös maantieteellisen erillisyyden vähäinen vaikutus mutta suolapitoisuuden voimakas vaikutus yleisiin mikrobiyhteisöihin (Logares et al., 2013; Yang et al., 2016). Näin ollen suolapitoisuus määrittää pitkälti sen, mitkä linjat voivat selviytyä. Eri elinympäristöissä metaanintuotantoaktiivisuus korreloi negatiivisesti suolapitoisuuden kanssa (Bartlett et al., 1987; Potter et al., 2009; Poffenbarger et al., 2011). Metaanintuotannon estymisen suolapitoisuuden kautta oletetaan siten olevan yhteydessä metaanipopulaation koon pienenemiseen (Pattnaik et al., 2000). Suolapitoisuuden vaikutus vetytrofiseen, asetotrofiseen ja metyylitrofiseen metanogeneesiin riippuu siten suolapitoisuudesta ja on erilainen metanogeneesin eri reiteillä (Liu et al., 2016). Tällä hetkellä ei ole olemassa selkeää mekanismia, joka selittäisi suolapitoisuuden vaikutuksen yhdyskuntarakenteeseen, mutta useita hypoteeseja voidaan käyttää mahdollisena selityksenä. Fysiologisesti suolapitoisuus vaikuttaa solujen ulkoiseen ja sisäiseen osmolaarisuuteen. Suolaan sopeutumattomat metanogeeniset solut ovat kehittäneet fysiologisia sopeutumia sisäisen turgoripaineen torjumiseksi, kun taas suolaan sopeutuneet solut ovat menettäneet tällaisen ominaisuuden (Zinder, 1993). Lisäksi lisääntyvä suolapitoisuus voi saada metanogeenit syntetisoimaan tai ottamaan käyttöönsä suuremman osuuden yhteensopivia liuottimia, mikä aiheuttaa merkittäviä energeettisiä ja siten metabolisia kustannuksia (McGenity, 2010). Suolankestävyyden piirre ilmenee jopa NaCl:n optimaalisessa pitoisuudessa metanogeenisten puhdasviljelmien kasvulle, sillä havaitsimme, että merisedimenteistä ja hydrotermisistä sedimenteistä peräisin olevilla isolaateilla on huomattavasti korkeampi NaCl:n optimaalinen pitoisuus kuin maaperästä peräisin olevilla isolaateilla (Täydentävä kuva S2).
Epäsuolapitoisissa maaekosysteemeissä, erityisesti maaperässä ja järvisedimenteissä, metanogeenisen eliöyhteisön koostumusta kontrolloidaan lämpötilojen ja pH:n yhdistelmästä. Näin ollen näiden ympäristöjen metanogeenit voitiin luokitella neljään ryhmään (kuva 6). Toisin kuin meriekosysteemeissä, ei-suolaisissa maaekosysteemeissä sekä pH:n että lämpötilan luonnollinen vaihtelu on suurta. Lämpötila voi vaikuttaa metanogeenisen reitin lisäksi myös itse metanogeenisiin populaatioihin (Conrad, 2007; Rooney-Varga et al., 2007). Metaanintuotanto voi lisääntyä huomattavasti, jos lämpötila nousee fermentaation ja asetogeneesin lämpötilaherkkien vaiheiden seurauksena (Megonigal et al., 2005; Kotsyurbenko et al., 2007). Lisäksi alhainen pH voi merkittävästi rajoittaa asetaatin saatavuutta estämällä asetaatin dissosioitumisen ja siten vaikuttaa negatiivisesti asetoklastiseen metanogeneesiin (Fukuzaki et al., 1990; Bridgham et al., 2013). Tämä voi olla mahdollinen syy siihen, että Methanosaeta puuttui ryhmästä2, kun taas Methanosarcina voi vaihtaa eri lähteiden välillä, eikä siihen ollut merkittävää vaikutusta. Lisäksi pH voi säädellä metaanintuotannon tehokkuutta ja metaanogeneettisiä reittejä ombrotrofisista minerotrofisiin turvemaihin sekä estämällä suoraan molempia metaanogeneettisiä reittejä että epäsuorasti vaikuttamalla fermentaatioon (Ye et al., 2012). Näin ollen sekä lämpötila että pH voivat suoraan tai epäsuorasti säädellä aineenvaihdunnan vaiheita, jotka liittyvät metanogeneesiin ja sitä edeltävään fermentaatioon, joka tarjoaa substraatin metanogeeneille.
Methanoregula on kaikkialla läsnä ja erittäin runsas kaikissa neljässä maaympäristöryhmässä (kuva 6), mutta sitä ei esiinny käytännössä lainkaan merialueella, ja se voi näin ollen osoittautua makeanveden vaikutuksen sijaiskärsijäksi merialueella. Sen maailmanlaajuisesta merkityksestä raportoitiin hiljattain muualla (Yang et al., 2017). Huolimatta sen yleisestä levinneisyydestä maaperässä ja järvisedimenteissä Methanoregula esiintyy indikaattorilinjana happamissa elinympäristöissä, joissa lämpötila on kohtalainen. Lisäksi (1) Methanolinea näyttää sopeutuneen erityisesti lämpimiin, neutraaleihin maaympäristöihin, (2) Methanobacterium kylmiin, happamiin ympäristöihin ja (3) Methanosaeta pH:n suhteen neutraaleihin ympäristöihin, mikä on johdonmukaista muiden tutkimusten kanssa (Rosenberg ym., 2014) ja korostaa lähestymistapamme kestävyyttä. Yleisesti ottaen metanogeenisia yhteisöjä ympäröivät geokemialliset olosuhteet johtavat markkinarakojen eriytymiseen. Koska kapeikkojen lajittumisella on taipumus jättää sopeutumiskykyiset spesialistit (Langenheder ja Székely, 2011), asteittainen pitkäaikainen ympäristövalinta synnytti erilaisia kapeikkoja, joita täytti joukko endeemisiä elinympäristön spesialisteja, jotka voivat olla vähemmän edustettuina tai puuttua muista erilaisista ympäristöolosuhteista. Yhteisöä muokkaavat myös bioottiset tekijät, kuten ekologiset vuorovaikutukset, dynamiikka, kilpailu ja symbioosit. Näistä biologisista tekijöistä huolimatta von Mering et al. (2007) havaitsivat, että elinympäristöpreferenssit ovat usein huomattavan vakaita ajan mittaan, ja ympäristöyhteisöjen erottuva taksonominen koostumus voi puolestaan olla tärkeä indikaattori niiden ekologiasta ja toiminnasta.
Yhteensopivasti metanogeenisten arkeoiden elinympäristöpreferenssien kanssa näyttää siltä, että läheisesti sukua olevat metanogeeniset kannat eristettiin usein vertailukelpoisista ympäristöistä. Esimerkiksi Methanoregulaceae näyttää olevan varsin monimuotoinen luonnollisissa ympäristöissä (Yang et al., 2017) ja neutraalit kannat saattavat toistaiseksi vastustaa viljelyä. Tällä hetkellä kuvatut Methanoregula-suvun kannat on molemmat saatu lievästi hapottomista ympäristöistä, kun taas Methanolinea-suvun kaksi edustajaa ovat peräisin suhteellisen lämpimistä elinympäristöistä, kuten mädätyslietteestä ja riisipellon maaperästä (Rosenberg et al., 2014). Vaikka Methanobacterium-kantoja eristettiin erilaisista ympäristöistä, noin puolella tämän suvun nykyisistä isolaateista on pH-optimi hieman alle 7. Tämä tarkoittaa, että ympäristösekvenssien perusteella tunnistetut indikaattorilinjat voivat heijastaa nykyisten metanogeenisten lajikkeiden fysiologian ja lähteiden eroja. Esimerkiksi elinympäristön suolapitoisuus elinympäristön yleisenä ominaisuutena voi asteittain altistaa organismeja voimakkaalle ympäristövalinnalle ja suodattaa uusien, ympäristön suolapitoisuuteen parhaiten soveltuvien lajien kokoonpanon (Logares et al., 2013).
Biodiversiteetin säilyttäminen ja hallinta on nykyisen yhteiskuntamme ensisijainen haaste. Tässä osoitamme, että luonnonympäristöjen metanogeeniset arkeat ovat monimuotoisimpia suistoalueiden sedimenteissä. Suistot ovat siirtymävyöhykkeitä meri- ja maaekosysteemien välillä. Tämä mahdollistaa kaksi merkittävää prosessia, jotka voivat vaikuttaa lajirikkauteen. Ensinnäkin merestä ja maalta peräisin olevat mikrobit sekoittuvat suistoalueilla ja kattavat lopulta suuren yleisen monimuotoisuuden (McLusky ja Elliott, 2004). On esimerkiksi havaittu suistoalueiden bakteerien, arkeoiden, sienten ja jopa erityisten, ainutlaatuisia toimintoja suorittavien bakteerien suuri monimuotoisuus (Cunliffe et al., 2008; Mosier ja Francis, 2008; Crump et al., 2012). Toinen näkökohta on korkea ravinnetaso, joka johtuu maanpäällisistä, vuoroveden aiheuttamista syötteistä, joilla suiston eliöt voivat ruokailla (McLusky ja Elliott, 2004; Statham, 2012). Tässä yhteydessä suistoalueiden ympäristöillä on merkitystä metanogeenien geneerisen uutuuden palauttamisessa. Tähän mennessä lajien monimuotoisuuden vaikutukset ekosysteemiprosesseihin ovat herättäneet huomattavaa tutkimustyötä. Biologisen monimuotoisuuden ja ekosysteemin toiminnan välisestä yhteydestä käydään edelleen keskustelua, ja se on mikrobiyhteisöjen osalta edelleen vaikeasti selvitettävissä (Loreau et al., 2001; Tilman et al., 2014). Vaikka maaperä ja järvisedimentit ovat metaanin ensisijaisia lähteitä ja myös elinympäristöjä, joissa on suuri metaanogeeninen monimuotoisuus, ehdotamme, että lajirikkaus ei ole sopiva metaanintuotantopotentiaalin ja ekosysteemin metaanipäästöjen mittari, vaan se näyttää pikemminkin heijastavan ympäristön heterogeenisuutta ja historiaa. Ympäristöjen asettaminen paremmuusjärjestykseen lajirikkauden mukaan ei välttämättä tarkoita metaanipäästöjen potentiaalia, joka on suurin maaperästä ja järvistä ja verrattain vähäinen suistoista (kuva 3 ja lisäkuva S1).
Loppujen lopuksi ympäristötietojen puuttuminen julkisista tietokannoista on saattanut vaikeuttaa tässä havaittujen ympäristötekijöiden täydellistä tulkintaa. Vaikka kirjallisuudessa ja julkisissa tietokannoissa on yhä enemmän sekvensointitietoa metanogeeneista, niihin liittyvät abioottiset muuttujat ovat usein epäjohdonmukaisia ja niukkoja. Ympäristömuuttujia koskevien johdonmukaisten tietojen vähäinen määrä rajoittaa monimuuttujaisten tilastollisten analyysien soveltamista. Kun muistutetaan, että tässä tutkimuksessa abioottiset tekijät voivat selittää vain pienen osan yhteisöjen vaihteluista, voidaan olettaa, että muita selittäviä muuttujia puuttuu. Erityisen tärkeitä voisivat olla metanogeenisten substraattien, kuten asetaatin, vedyn ja metyyliamiinien, pitoisuudet ja saatavuus. Abioottiset muuttujat eivät kuitenkaan ehkä koskaan riitä selittämään täysin metanogeenisten ryhmien rakenteita, koska elinympäristöillä on erilainen historia ja niitä voidaan tutkia vain paikallisesti. Myös Venäjän ja Kanadan subarktisen ja arktisen alueen laajat alueet ovat huonosti edustettuina käytettävissä olevissa mcrA-aineistoissa. Parempi maantieteellinen kattavuus ja mcrA-geenitietoaineiston tasaisempi jakautuminen parantaisi metanogeenisten yhteisöjen arviointia globaalissa mittakaavassa.
Author Contributions
SL ja XW suunnittelivat tutkimuksen. XW ja SY keräsivät ja analysoivat tiedot. XW, SY ja FH suorittivat tilastollisen analyysin. XW, MW ja SY tekivät fylogeneettisen korjauksen. XW, SY, FH, MW, DW ja SL tulkitsivat tulokset ja kirjoittivat artikkelin. Kaikki kirjoittajat osallistuivat keskusteluihin ja tarkistivat käsikirjoituksen.
Kiinnostusristiriitoja koskeva lausunto
Tekijät ilmoittavat, että tutkimus suoritettiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Kiitokset
Kiitokset
Kiinan stipendiaattilautakunnan (China Scholarship Council (CSC)) myöntämästä taloudellisesta tuesta XW:lle (apuraha N:o 201408620031 XW:lle) ollaan kiitollisia. Tätä tutkimusta tuki Helmholtz Gemeinschaft (HGF) rahoittamalla SL:n Helmholtz Young Investigators Group -ryhmää (VH-NG-919).
Lisäaineisto
Tämän artikkelin lisäaineisto löytyy verkosta osoitteesta: https://www.frontiersin.org/article/10.3389/fmicb.2017.01339/full#supplementary-material
Alaviitteet
- ^ http://metanogen.biotech.uni.wroc.pl/
- ^ http://www.ncbi.nlm.nih.gov/
- ^ http://metanogen.biotech.uni.wroc.pl/
- ^ https://www.ngdc.noaa.gov/mgg/shorelines/gshhs.html
- ^ http://qgis.osgeo.org
Auguet, J. C., Barberan, A. ja Casamayor, E. O. (2010). Global ecological patterns in uncultured Archaea. ISME J. 4, 182-190. doi: 10.1038/ismej.2009.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Bange, H. W., Bartell, U. H., Rapsomanikis, S., and Andreae, M. O. (1994). Metaani Itämeressä ja Pohjanmeressä ja metaanin meripäästöjen uudelleenarviointi. Glob. Biogeochem. Cycles 8, 465-480. doi: 10.1029/94GB02181
CrossRef Full Text | Google Scholar
Barreto, D. P., Conrad, R., Klose, M., Claus, P. ja Enrich-Prast, A. (2014). Distance-decay and taxa-area relationships for bacteria, archaea and methanogenic archaea in a tropical lake sediment. PLoS ONE 9:e110128. doi: 10.1371/journal.pone.0110128
PubMed Abstract | CrossRef Full Text | Google Scholar
Bartlett, K. B., Bartlett, D. S., Harriss, R. C., and Sebacher, D. I. (1987). Metaanipäästöt suolaisten soiden suolaisuusgradienttia pitkin. Biogeochemistry 4, 183-202. doi: 10.1007/BF02187365
CrossRef Full Text | Google Scholar
Borrel, G., O’Toole, P. W., Harris, H. M. B., Peyret, P., Brugere, J. F., and Gribaldo, S. (2013). Fylogenomitiedot tukevat metylotrofisten metanogeenien seitsemättä järjestystä ja antavat tietoa metanogeneesin evoluutiosta. Genome Biol. Evol. 5, 1769-1780. doi: 10.1093/Gbe/Evt128
PubMed Abstract | CrossRef Full Text | Google Scholar
Bousquet, P., Ciais, P., Miller, J., Dlugokencky, E., Hauglustaine, D., Prigent, C., et al. (2006). Antropogeenisten ja luonnollisten lähteiden osuus ilmakehän metaanin vaihtelusta. Nature 443, 439-443. doi: 10.1038/nature05132
PubMed Abstract | CrossRef Full Text | Google Scholar
Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., and Zhuang, Q. (2013). Methane emissions from wetlands: biogeochemical, microbial, and modeling perspectives from local to global scales. Glob. Chang. Biol. 19, 1325-1346. doi: 10.1111/gcb.12131
PubMed Abstract | CrossRef Full Text | Google Scholar
Cao, H., Auguet, J.-C., and Gu, J.-D. (2013). Ammoniakkia hapettavien arkeoiden globaali ekologinen malli. PLoS ONE 8:e52853. doi: 10.1371/journal.pone.0052853
PubMed Abstract | CrossRef Full Text | Google Scholar
Caporaso, J. G., Lauber, C. L., Walters, W. A., Berg-Lyons, D., Lozupone, C. A., Turnbaugh, P. J., et al. (2011). 16S rRNA:n monimuotoisuuden globaalit mallit miljoonien sekvenssien syvyydellä näytettä kohti. Proc. Natl. Acad. Sci. U.S.A. 108, 4516-4522. doi: 10.1073/pnas.1000080107
PubMed Abstract | CrossRef Full Text | Google Scholar
Chaffron, S., Rehrauer, H., Pernthaler, J., and von Mering, C. (2010). Maailmanlaajuinen rinnakkain elävien mikrobien verkosto ympäristö- ja kokogenomisekvenssitiedoista. Genome Res. 20, 947-959. doi: 10.1101/gr.104521.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Church, M. J., Bjorkman, K. M., Karl, D. M., Saito, M. A., ja Zehr, J. P. (2008). Typpiä sitovien bakteerien alueelliset levinneisyydet Tyynellämerellä. Limnol. Oceanogr. 53, 63-77. doi: 10.4319/lo.2008.53.1.0063
CrossRef Full Text | Google Scholar
Conrad, R. (2007). ”Microbial ecology of methanogens and methanotrophs,” in Advances in Agronomy, ed. L. S. Donald (Cambridge, MA: Academic Press), 1-63.
Google Scholar
Cornwell, W. K., Schwilk, D. W., and Ackerly, D. D. (2006). Ominaisuuksiin perustuva testi elinympäristön suodatusta varten: kuperan rungon tilavuus. Ecology 87, 1465-1471. doi: 10.1890/0012-9658(2006)872.0.CO;2
PubMed Abstract | CrossRef Full Text | Google Scholar
Crump, B. C., Amaral-Zettler, L. A., and Kling, G. W. (2012). Mikrobien monimuotoisuus arktisissa makeissa vesissä jäsentyy maaperästä peräisin olevien mikrobien inokulaation avulla. ISME J. 6, 1629-1639. doi: 10.1038/ismej.2012.9
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, M., Ma, A., Qi, H., Zhuang, X., Zhuang, G., and Zhao, G. (2015). Lämpimämpi lämpötila kiihdyttää metaanipäästöjä Tiibetin ylängöllä sijaitsevasta Zoige-kosteikosta muuttamatta metanogeenisen yhteisön koostumusta. Sci. Rep. 5:11616. doi: 10.1038/srep11616
PubMed Abstract | CrossRef Full Text | Google Scholar
Cunliffe, M., Schafer, H., Harrison, E., Cleave, S., Upstill-Goddard, R. ja Murrell, J. C. (2008). Suiston pintamikrokerrokseen liittyvien bakteeri- ja arkeaaliyhteisöjen fylogeneettinen ja toiminnallinen geenianalyysi. ISME J. 2, 776-789. doi: 10.1038/ismej.2008.28
PubMed Abstract | CrossRef Full Text | Google Scholar
Dray, S., ja Dufour, A. B. (2007). Ade4-paketti: dualiteettidiagrammin toteuttaminen ekologeille. J. Stat. Softw. 22, 1-20. doi: 10.18637/jss.v022.i04
CrossRef Full Text | Google Scholar
Dufrene, M., and Legendre, P. (1997). Lajikokoonpanot ja indikaattorilajit: joustavan epäsymmetrisen lähestymistavan tarve. Ecol. Monogr. 67, 345-366. doi: 10.2307/2963459
CrossRef Full Text | Google Scholar
Edgar, R. C., Haas, B. J., Clemente, J. C., Quince, C., and Knight, R. (2011). UCHIME parantaa kimeerien havaitsemisen herkkyyttä ja nopeutta. Bioinformatics 27, 2194-2200. doi: 10.1093/bioinformatics/btr381
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, P. N., Parks, D. H., Chadwick, G. L., Robbins, S. J., Orphan, V. J., Golding, S. D., et al. (2015). Methane metabolism in the archaeal phylum Bathyarchaeota revealed by genome-centric metagenomics. Science 350, 434-438. doi: 10.1126/science.aac7745
PubMed Abstract | CrossRef Full Text | Google Scholar
Fish, J. A., Chai, B., Wang, Q., Sun, Y., Brown, C. T., Tiedje, J. M., et al. (2013). FunGene: funktionaalinen geeniputki ja arkisto. Front. Microbiol. 4:291. doi: 10.3389/fmicb.2013.00291
PubMed Abstract | CrossRef Full Text | Google Scholar
Frank-Fahle, B. A., Yergeau, E., Greer, C. W., Lantuit, H., and Wagner, D. (2014). Mikrobien toiminnallinen potentiaali ja yhteisöjen koostumus ikiroudan vaikutuksen alaisissa maaperissä Kanadan luoteisnavan arktisella alueella. PLoS ONE 9:e84761. doi: 10.1371/journal.pone.0084761.g001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fukuzaki, S., Nishio, N., and Nagai, S. (1990). Asetaatin metanogeenisen käymisen kinetiikka. Appl. Environ. Microbiol. 56, 3158-3163.
Google Scholar
Hanson, C. A., Fuhrman, J. A., Horner-Devine, M. C., ja Martiny, J. B. (2012). Beyond biogeographic patterns: processes shaping the microbial landscape. Nat. Rev. Microbiol. 10, 497-506. doi: 10.1038/Nrmicro2795
PubMed Abstract | CrossRef Full Text | Google Scholar
Holm, G. O., Perez, B. C., McWhorter, D. E., Krauss, K. W., Johnson, D. J., Raynie, R. C., et al. (2016). Ecosystem level methane fluxes from tidal freshwater and brackish marshes of the Mississippi River Delta: implications for coastal wetland carbon projects. Wetlands 36, 401-413. doi: 10.1007/s13157-016-0746-7
CrossRef Full Text | Google Scholar
Hunger, S., Schmidt, O., Hilgarth, M., Horn, M. A., Kolb, S., Conrad, R., et al. (2011). Kilpailevat formaatti- ja hiilidioksidia hyödyntävät prokaryootit anoksisessa metaania tuottavassa suomaassa. Appl. Environ. Microbiol. 77, 3773-3785. doi: 10.1128/AEM.00282-11
PubMed Abstract | CrossRef Full Text | Google Scholar
IPCC (2007). ”Climate Change 2007: the Physical Science Basis,” in Proceedings of the Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change, eds D. Qin, S. Solomon, M. Manning, Z. Chen, M. Marquis, K. B. Averyt, et al. (Cambridge: Cambridge University Press).
Google Scholar
Jabłoński, S., Rodowicz, P., ja Łukaszewicz, M. (2015). Fysiologisia ja biokemiallisia ominaisuuksia sisältävä metanogeenisten arkeoiden tietokanta. Int. J. Syst. Evol. Microbiol. Kolme vuosikymmentä maailmanlaajuisia metaanilähteitä ja -nieluja. Nat. Geosci. 6, 813-823. doi: 10.1038/Ngeo1955
CrossRef Full Text | Google Scholar
Knief, C. (2015). Viljeltyjen ja viljelemättömien aerobisten metanotrofisten bakteerien monimuotoisuus ja elinympäristöpreferenssit arvioituna pmoA:n perusteella molekyylimarkkerina. Front. Microbiol. 6:1346. doi: 10.3389/fmicb.2015.01346
PubMed Abstract | CrossRef Full Text | Google Scholar
Kotsyurbenko, O., Friedrich, M., Simankova, M., Nozhevnikova, A., Golyshin, P., Timmis, K., et al. (2007). Siirtyminen asetoklastisesta H2-riippuvaiseen metanogeneesiin Länsi-Siperian turvesuolla alhaisilla pH-arvoilla ja happofiilisen Methanobacterium-kannan eristäminen. Appl. Environ. Microbiol. 73, 2344-2348. doi: 10.1128/AEM.02413-06
PubMed Abstract | CrossRef Full Text | Google Scholar
Langenheder, S., and Székely, A. J. (2011). Lajien lajittelu ja neutraalit prosessit ovat molemmat tärkeitä bakteeriyhteisöjen alkukokoonpanon aikana. ISME J. 5, 1086-1094. doi: 10.1038/ismej.2010.207
PubMed Abstract | CrossRef Full Text | Google Scholar
Liebner, S., Ganzert, L., Kiss, A., Yang, S., Wagner, D. ja Svenning, M. M. (2015). Shifts in methanogenic community composition and methane fluxes along the degradation of discontinuous permafrost. Front. Microbiol. 6:356. doi: 10.3389/fmicb.2015.00356
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y. Q., Priscu, J. C., Xiong, J. B., Conrad, R., Vick-Majors, T., Chu, H. Y., et al. (2016). Salinity drives archaeal distribution patterns in high altitude lake sediments on the Tibetan Plateau. FEMS Microbiol. Ecol. 92:fiw033. doi: 10.1093/femsec/fiw033
PubMed Abstract | CrossRef Full Text | Google Scholar
Logares, R., Lindstrom, E. S., Langenheder, S., Logue, J. B., Paterson, H., Laybourn-Parry, J., ym. et al. (2013). Biogeography of bacterial communities exposed to progressive long-term environmental change. ISME J. 7, 937-948. doi: 10.1038/ismej.2012.168
PubMed Abstract | CrossRef Full Text | Google Scholar
Loreau, M., Naeem, S., Inchausti, P., Bengtsson, J., Grime, J. P., Hector, A., et al. (2001). Biodiversiteetti ja ekosysteemien toiminta: nykytietämys ja tulevaisuuden haasteet. Science 294, 804-808. doi: 10.1126/science.1064088
PubMed Abstract | CrossRef Full Text | Google Scholar
Lozupone, C. A., and Knight, R. (2007). Bakteerien monimuotoisuuden globaalit mallit. Proc. Natl. Acad. Sci. U.S.A. 104, 11436-11440. doi: 10.1073/pnas.0611525104
PubMed Abstract | CrossRef Full Text | Google Scholar
Luton, P. E., Wayne, J. M., Sharp, R. J., ja Riley, P. W. (2002). mcrA-geeni vaihtoehtona 16S rRNA:lle kaatopaikkojen metanogeenipopulaatioiden fylogeneettisessä analyysissä. Microbiology 148, 3521-3530. doi: 10.1099/00221287-148-11-3521
PubMed Abstract | CrossRef Full Text | Google Scholar
Lutz, S., Anesio, A. M., Raiswell, R., Edwards, A., Newton, R. J., Gill, F., et al. (2016). Punaisen lumen mikrobiomien biogeografia ja niiden rooli arktisten jäätiköiden sulamisessa. Nat. Commun. 7:11968. doi: 10.1038/ncomms11968
PubMed Abstract | CrossRef Full Text | Google Scholar
Martiny, J. B. H., Bohannan, B. J. M., Brown, J. H., Colwell, R. K., Fuhrman, J. A., Green, J. L., et al. (2006). Mikrobien biogeografia: mikro-organismit kartalla. Nat. Rev. Microbiol. 4, 102-112. doi: 10.1038/Nrmicro1341
PubMed Abstract | CrossRef Full Text | Google Scholar
Martiny, J. B. H., Eisen, J. A., Penn, K., Allison, S. D., and Horner-Devine, M. C. (2011). Bakteerien beetadiversiteetin ajurit riippuvat alueellisesta mittakaavasta. Proc. Natl. Acad. Sci. U.S.A. 108, 7850-7854. doi: 10.1073/pnas.1016308108
PubMed Abstract | CrossRef Full Text | Google Scholar
McArdle, B. H., and Anderson, M. J. (2001). Monimuuttujamallien sovittaminen yhteisötietoihin: kommentti etäisyyteen perustuvasta redundanssianalyysistä. Ecology 82, 290-297. doi: 10.1890/0012-9658(2001)0822.0.CO;2
CrossRef Full Text | Google Scholar
McCalley, C. K., Woodcroft, B. J., Hodgkins, S. B., Wehr, R. A., Kim, E.-H., Mondav, R., et al. (2014). Metaanin dynamiikkaa säätelee mikrobiyhteisön vaste ikiroudan sulamiselle. Nature 514, 478-481. doi: 10.1038/nature13798
PubMed Abstract | CrossRef Full Text | Google Scholar
McGenity, T. J. (2010). ”Methanogens and Methanogenesis in Hypersaline Environments,” in Handbook of Hydrocarbon and Lipid Microbiology, ed. K. N. Timmis (Berlin: Springer), 665-680. doi: 10.1007/978-3-540-77587-4_53
CrossRef Full Text | Google Scholar
McLusky, D. S., and Elliott, M. (2004). The Estuarine Ecosystem: Ecology, Threats and Management. New York, NY: Oxford University Press. doi: 10.1093/acprof:oso/9780198525080.001.0001
CrossRef Full Text | Google Scholar
Megonigal, J. P., Mines, M. E., and Visscher, P. T. (2005). ”Anaerobinen aineenvaihdunta: yhteydet hivenkaasuihin ja aerobisiin prosesseihin”, teoksessa Biogeokemia, toim. W. H. Schlesinger (Oxford: Elsevier), 350-362.
Google Scholar
Milferstedt, K., Youngblut, N. D., and Whitaker, R. J. (2010). Metanogeenipopulaatioiden spatiaalinen rakenne ja pysyvyys humuspitoisissa suojärvissä. ISME J. 4, 764-776. doi: 10.1038/Ismej.2010.7
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosier, A. C., and Francis, C. A. (2008). Ammoniakkia hapettavien arkeoiden ja bakteerien suhteellinen runsaus ja monimuotoisuus San Franciscon lahden suistossa. Environ. Microbiol. 10, 3002-3016. doi: 10.1111/j.1462-2920.2008.01764.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Nazaries, L., Murrell, J. C., Millard, P., Baggs, L. ja Singh, B. K. (2013). Metaani, mikrobit ja mallit: maaperän metaaninkierron perustavanlaatuinen ymmärtäminen tulevaisuuden ennusteita varten. Environ. Microbiol. 15, 2395-2417. doi: 10.1111/1462-2920.12149
PubMed Abstract | CrossRef Full Text | Google Scholar
Nelson, M. B., Martiny, A. C., and Martiny, J. B. H. (2016). Mikrobien typen kierron piirteiden globaali biogeografia maaperässä. Proc. Natl. Acad. Sci. U.S.A. 113, 8033-8040. doi: 10.1073/pnas.1601070113
PubMed Abstract | CrossRef Full Text | Google Scholar
Nemergut, D. R., Costello, E. K., Hamady, M., Lozupone, C., Jiang, L., Schmidt, S. K., et al. (2011). Global patterns in the biogeography of bacterial taxa. Environ. Microbiol. 13, 135-144. doi: 10.1111/j.1462-2920.2010.02315.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Nobu, M. K., Narihiro, T., Kuroda, K., Mei, R., ja Liu, W. T. (2016). Chasing the elusive Euryarchaeota class WSA2: genomes reveal a uniquely fastidious methyl-reducing methanogen. ISME J. 10, 2478-2487. doi: 10.1038/ismej.2016.33
PubMed Abstract | CrossRef Full Text | Google Scholar
Oksanen, J., Blanchet, F. G., Kindt, R., Legendre, P., Minchin, P. R., O’Hara, R. B., ym. et al. (2015). vegan: Community Ecology Package. R-paketin versio 2.2.0. Saatavilla osoitteessa: https://CRAN.R-project.org/package=vegan
Google Scholar
Oloo, F., Valverde, A., Quiroga, M. V., Vikram, S., Cowan, D., and Mataloni, G. (2016). Habitaatin heterogeenisuus ja kytkeytyneisyys muokkaavat mikrobiyhteisöjä eteläamerikkalaisilla soilla. Sci. Rep. 6:25712. doi: 10.1038/srep25712
PubMed Abstract | CrossRef Full Text | Google Scholar
Pattnaik, P., Mishra, S. R., Bharati, K., Mohanty, S. R., Sethunathan, N. ja Adhya, T. K. (2000). Suolapitoisuuden vaikutus metanogeneesiin ja siihen liittyvään mikroflooraan trooppisessa riisimaassa. Microbiol. Res. 155, 215-220. doi: 10.1016/S0944-5013(00)80035-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Poffenbarger, H. J., Needelman, B. A., and Megonigal, J. P. (2011). Suolapitoisuuden vaikutus vuorovesisoiden metaanipäästöihin. Wetlands 31, 831-842. doi: 10.1007/s13157-011-0197-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Potter, E. G., Bebout, B. M., and Kelley, C. A. (2009). Metaanin ja metanogeenisten substraattien isotooppikoostumus suolaisuusgradienttia pitkin hypersuolaisessa mikrobimattojärjestelmässä. Astrobiology 9, 383-390. doi: 10.1089/ast.2008.0260
PubMed Abstract | CrossRef Full Text | Google Scholar
R Core Team (2014). R: A Language and Environment for Statistical Computing (versio 3.0.3). Wien: R Foundation for Statistical Computing.
Google Scholar
Roberts, D. (2016). labdsv: Ordination and Multivariate Analysis for Ecology. R-paketin versio 1.8-0. Saatavilla osoitteessa: https://CRAN.R-project.org/package=labdsv
Google Scholar
Rooney-Varga, J. N., Giewat, M. W., Duddleston, K. N., Chanton, J. P., ja Hines, M. E. (2007). Arkeaaliyhteisön rakenteen, kasvillisuustyypin ja metanogeenisen reitin väliset yhteydet Alaskan turvemailla. FEMS Microbiol. Ecol. 60, 240-251. doi: 10.1111/j.1574-6941.2007.00278.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Rosenberg, E., DeLong, E. F., Lory, S., Stackebrandt, E. ja Thompson, F. (2014). The Prokaryotes: Other Major Lineages of Bacteria and the Archaea. Berlin: Springer.
Google Scholar
Ruff, S. E., Biddle, J. F., Teske, A. P., Knittel, K., Boetius, A., and Ramette, A. (2015). Metaanivuodon mikrobiomin globaali hajaantuminen ja paikallinen monipuolistuminen. Proc. Natl. Acad. Sci. U.S.A. 112, 4015-4020. doi: 10.1073/pnas.1421865112
PubMed Abstract | CrossRef Full Text | Google Scholar
Schauer, R., Bienhold, C., Ramette, A., ja Harder, J. (2009). Bakteerien monimuotoisuus ja biogeografia Etelä-Atlantin syvänmeren pintasedimenteissä. ISME J. 4, 159-170. doi: 10.1038/ismej.2009.106
PubMed Abstract | CrossRef Full Text | Google Scholar
Schloss, P. D., Westcott, S. L., Ryabin, T., Hall, J. R., Hartmann, M., Hollister, E. B., et al. (2009). Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities. Appl. Environ. Microbiol. 75, 7537-7541. doi: 10.1128/Aem.01541-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Statham, P. J. (2012). Ravinteet suistoissa – yleiskatsaus ja ilmastonmuutoksen mahdolliset vaikutukset. Sci. Total Environ. 434, 213-227. doi: 10.1016/j.scitotenv.2011.09.088
PubMed Abstract | CrossRef Full Text | Google Scholar
Thauer, R. K., Kaster, A.-K., Seedorf, H., Buckel, W. ja Hedderich, R. (2008). Metanogeeniset arkeat: ekologisesti merkityksellisiä eroja energiansäästössä. Nat. Rev. Microbiol. 6, 579-591. doi: 10.1038/Nrmicro1931
PubMed Abstract | CrossRef Full Text | Google Scholar
Tilman, D., Isbell, F., ja Cowles, J. M. (2014). Biodiversiteetti ja ekosysteemien toiminta. Annu. Rev. Ecol. Evol. Syst. 45, 471-493. doi: 10.1146/annurev-ecolsys-120213-091917
CrossRef Full Text | Google Scholar
Ulrich, W., Hajdamowicz, I., Zalewski, M., Stañska, M., Ciurzycki, W. ja Tykarski, P. (2010). Lajivalikoima vai elinympäristön suodattaminen: tapaustutkimus hämähäkkiyhteisöistä järvisaarilla. Ecol. Res. 25, 375-381. doi: 10.1007/s11284-009-0661-y
CrossRef Full Text | Google Scholar
Vanwonterghem, I., Evans, P. N., Parks, D. H., Jensen, P. D., Woodcroft, B. J., Hugenholtz, P., et al. (2016). Metylotrofinen metanogeneesi löydetty arkeaalisesta heimosta Verstraetearchaeota. Nat. Microbiol. 1:16170. doi: 10.1038/nmicrobiol.2016.170
PubMed Abstract | CrossRef Full Text | Google Scholar
von Mering, C., Hugenholtz, P., Raes, J., Tringe, S. G., Doerks, T., Jensen, L. J., et al. (2007). Mikrobiyhteisöjen kvantitatiivinen fylogeneettinen arviointi erilaisissa ympäristöissä. Science 315, 1126-1130. doi: 10.1126/science.1133420
PubMed Abstract | CrossRef Full Text | Google Scholar
Wagner, D., and Liebner, S. (2009). ”Global warming and carbon dynamics in permafrost soils: methane production and oxidation,” in Permafrost Soils, ed. R. Margesin (Berlin: Springer), 219-236.
Google Scholar
Weiher, E., and Keddy, P. (2001). Ekologiset kokoontumissäännöt: Perspectives, Advances, Retreats. Cambridge: Cambridge University Press.
Google Scholar
Whitaker, R. J., Grogan, D. W., and Taylor, J. W. (2003). Geographic barriers isolate endemic populations of hyperthermophilic archaea. Science 301, 976-978. doi: 10.1126/science.1086909
PubMed Abstract | CrossRef Full Text | Google Scholar
Wickham, H. (2009). ggplot2: Elegant Graphics for Data Analysis. New York, NY: Springer-Verlag. doi: 10.1007/978-0-387-98141-3
CrossRef Full Text | Google Scholar
Yang, J., Ma, L. A., Jiang, H., Wu, G., and Dong, H. (2016). Suolapitoisuus muokkaa mikrobien monimuotoisuutta ja yhteisörakennetta Qinghai-Tibetin järvien pintasedimenteissä. Sci. Rep. 6:25078. doi: 10.1038/srep25078
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, S., Liebner, S., Alawi, M., Ebenhöh, O. ja Wagner, D. (2014). Taksonominen tietokanta ja cut-off-arvo mcrA-geenin 454-pyrosekvensointidatan käsittelyä varten MOTHURilla. J. Microbiol. Methods 103, 3-5. doi: 10.1016/j.mimet.2014.05.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, S., Liebner, S., Winkel, M., Alawi, M., Horn, F., Dörfer, C., et al. (2017). Syvällinen analyysi metanogeenisten ydinyhteisöjen syvyysanalyysi korkealla sijaitsevista ikiroudan vaikutuksen alaisista kosteikoista. Soil Biol. Biochem. 111, 66-77. doi: 10.1016/j.soilbio.2017.03.007
CrossRef Full Text | Google Scholar
Ye, R. Z., Jin, Q. S., Bohannan, B., Keller, J. K., McAllister, S. A., and Bridgham, S. D. (2012). pH controls over anaerobic carbon mineralization, the efficiency of methane production, and methanogenic pathways in peatlands across an ombrotrophic-minerotrophic gradient. Soil Biol. Biochem. 54, 36-47. doi: 10.1016/j.soilbio.2012.05.015
CrossRef Full Text | Google Scholar
Zinder, S. H. (1993). ”Metanogeenien fysiologinen ekologia”, teoksessa Methanogenesis: Ecology, Physiology, Biochemistry & Genetics, ed. J. G. Ferry (Boston, MA: Springer), 128-206.
Google Scholar
Zinger, L., Amaral-Zettler, L. A., Fuhrman, J. A., Horner-Devine, M. C., Huse, S. M., Welch, D. B. M., et al. (2011). Global patterns of bacterial beta-diversity in seafloor and sea water ecosystems. PLoS ONE 6:e24570. doi: 10.1371/journal.pone.0024570
PubMed Abstract | CrossRef Full Text | Google Scholar