Kuva 1. Tollin kaltaisen reseptorin signalointireitti
Mikä on Tollin kaltainen reseptori?
Tollin kaltaiset reseptorit (TLR) ovat proteiiniluokka, jolla on keskeinen rooli synnynnäisessä immuniteetissa. Ne ovat yhden domeenin transmembraanireseptoreita, jotka kuuluvat hahmontunnistusreseptoreihin (PRR) ja jotka yleensä ilmentyvät sentinellisoluissa, kuten makrofageissa, dendriittisoluissa ja monissa muissa ei-immuunisoluissa, kuten fibroblasteissa ja epiteelisoluissa. Ne tunnistavat rakenteellisesti konservoituneita mikrobeista peräisin olevia molekyylejä, joita kutsutaan patogeeni-assosioituneiksi molekyylimalleiksi (pathogen-associated molecular patterns, PAMP), tai vaurioituneista soluista peräisin olevia molekyylejä, joita kutsutaan vaurioassosioituneiksi molekyylimalleiksi (damage associated molecules patterns, DAMP). PAMP-molekyyleihin kuuluvat erilaiset bakteerien soluseinän komponentit, kuten lipopolysakkaridi (LPS), peptidoglykaanit (PGN) ja lipopeptidit, sekä flagelliini, bakteeri-DNA ja viruksen kaksisäikeinen RNA. DAMP:eihin kuuluvat solunsisäiset proteiinit, kuten lämpösokkiproteiinit, sekä solunulkoisen matriisin proteiinifragmentit. PRR:t aktivoivat jatkoketjun signaalireittejä, jotka johtavat synnynnäisten immuunivasteiden induktioon tuottamalla tulehdussytokiineja, tyypin I interferonia (IFN) ja muita välittäjiä. Nämä prosessit eivät ainoastaan laukaise välittömiä isännän puolustusreaktioita, kuten tulehdusta, vaan myös käynnistävät ja organisoivat antigeenispesifisiä adaptiivisia immuunivasteita. Nämä vasteet ovat välttämättömiä infektoivien mikrobien puhdistumiselle sekä ratkaisevia antigeenispesifisten adaptiivisten immuunivasteiden myöhemmälle ohjeistamiselle.
Avio 2. Kaaviokuva TLR:ien molekyylirakenteesta.
Tollin kaltaisten reseptorien perhe
Tollin kaltaisten reseptorien perheeseen kuuluu ihmisellä 10 jäsentä (TLR1-TLR10) ja hiirellä 12 (TLR1-TLR9, TLR11-TLR13). TLR:t lokalisoituvat solun pinnalle tai solunsisäisiin lokeroihin, kuten ER:ään, endosomiin ja lysosomiin. Solupinnan TLR:iin kuuluvat TLR1, TLR2, TLR4, TLR5, TLR6 ja TLR10, kun taas solunsisäiset TLR:t lokalisoituvat endosomiin, ja niihin kuuluvat TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 ja TLR13 (kuva 1). Solupinnan TLR:t tunnistavat pääasiassa mikrobien kalvokomponentteja, kuten lipidejä, lipoproteiineja ja proteiineja. Solunsisäiset TLR:t tunnistavat bakteereista ja viruksista peräisin olevia nukleiinihappoja, ja ne tunnistavat myös itsestään peräisin olevia nukleiinihappoja sairaustiloissa, kuten autoimmuniteetissa.
Tollin kaltaisen reseptorin toiminta perustuu yleensä kahden TLR-molekyylin dimerisaatioprosessiin, mutta ei aina. Esimerkiksi TLR-1 ja TLR-2 sitoutuvat toisiinsa muodostaen dimerin, kun ne tunnistavat PAMP-molekyylejä, joihin kuuluvat pääasiassa lipoproteiinit, peptidoglykaanit, lipoteiinihapot (LTA, Gram-), zymosaani, mannaani ja tGPI-musiini. TLR-2 voi myös muodostaa himmentimen TLR-6:n kanssa, kun ne tunnistavat samoja edellä lueteltuja PAMP-molekyylejä. TLR-4 voi tunnistaa lipopolysakkaridia (LPS, Gram+) ja muodostaa homodimeerin toisen TLR-4-molekyylin kanssa. TLR-5 voi tunnistaa bakteerien flagelliinin, mutta ne eivät muodosta dimmeriä. TLR-11 on hiirillä toimiva ja tunnistaa pääasiassa uropatogeenisiä bakteereja. TLR-3, 7, 8, 9 ja 13 ilmentyvät endosomin pinnalla sytoplasmassa. TLR3 tunnistaa virusperäistä kaksijuosteista RNA:ta (dsRNA), pientä häiritsevää RNA:ta ja vaurioituneista soluista peräisin olevaa omaa RNA:ta. TLR-7 ilmentyy pääasiassa plasmasytoidisissa DC:ssä (pDC), ja se tunnistaa viruksista peräisin olevaa yksijuosteista (ss) RNA:ta. Se tunnistaa myös streptokokki B -bakteerien RNA:ta tavanomaisissa DC:ssä (cDC). TLR8 reagoi virus- ja bakteeri-RNA:han. TLR-9 tunnistaa bakteerien ja virusten DNA:ta, jossa on runsaasti metyloimattomia CpG-DNA-motiiveja. TLR13 tunnistaa bakteerien 23S rRNA:ta ja vesicular stomatitis -viruksen tuntemattomia komponentteja.
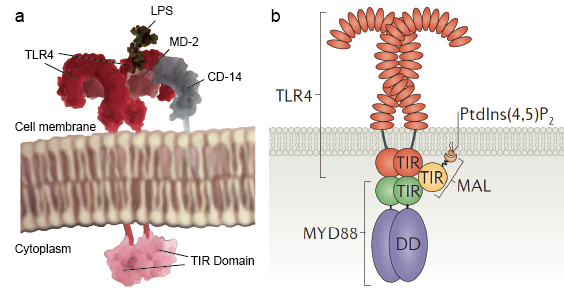
Vaikka on olemassa niin monenlaisia TLR-molekyylejä, jotka tunnistavat monenlaisia ligandeja, kaikilla näillä TLR:illä on yhteinen rakenteellinen kehys niiden solunulkoisissa, ligandia sitovissa domeeneissa. Nämä domeenit ovat kaikki hevosenkengän muotoisia ja rakentuvat leusiinirikkaista toistomotiiveista. Tyypillisesti kaksi solunulkoista domeenia muodostavat ligandiin sitoutuessaan ”m”-muotoisen dimeerin, joka leikkaa ligandimolekyylin ja tuo transmembraaniset ja sytoplasmiset domeenit lähelle toisiaan ja käynnistää alempana kulkevan signaalikaskadin (kuva 2).
Tollin kaltaisten reseptorien signaalireitti
1. Tollin kaltaisten reseptoreiden signalointikaskadi
Tollin kaltaisten reseptoreiden avulla sentinellisolut, kuten makrofagit, voivat havaita mikrobeja PAMP:ien, kuten LPS:n, avulla. LPS on bakteerien soluseinän komponentti. Tollin kaltaisten reseptorien lipopolysakkaridien tunnistamismekanismi on monimutkainen ja vaatii useita lisäproteiineja. Seerumin proteiini, LPS-sitova proteiini, sitoo LPS-monomeerejä ja siirtää ne CD14-nimiseen proteiiniin. CD14 voi olla liukoinen tai sitoutua solun pinnalle glykosyylifosfatidyylinositoli-ankkurin kautta. CD 14 kuljettaa ja kuormittaa LPS:ää Tollin kaltaisten reseptorien solunulkoiseen domeeniin. TLR:t pystyvät havaitsemaan LPS:n MD-2-nimisen lisäproteiinin avulla. TLR:ien homodimerisaatio indusoituu, kun LPS sitoutuu TLR-CD14-MD2-kompleksiin. Solunulkoisten domeenien konformaatiomuutos käynnistää sytoplasmisen Toll IL-1-reseptorin (TIR) domeenin dimerisaation. TIR-konformaatiomuutos tarjoaa uuden telineen, joka mahdollistaa adaptoriproteiinien rekrytoinnin reseptorin jälkeisen signaalikompleksin muodostamiseksi. TIR sisältää adaptaattoriproteiinia myeloidinen erilaistumisen primaarivasteproteiini 88 (MyD88).
MyD88 toimii adaptaattorina, joka yhdistää TLR:t/IL-1R:t alempana oleviin signaalimolekyyleihin, joilla on DD:t. Se tunnistaa TLR:ien TIR-domeenin konformaatiomuutoksen, sitoutuu uuteen reseptorikompleksiin ja siirtää signalointia amino(N)-terminaalisen kuoleman domeenin (DD) vuorovaikutuksen kautta IL-1R-assosioituneiden kinaasien (IRAK) kanssa. Näistä tuloksista syntyy monimutkainen signaalikaskadi, joka varoittaa solua patogeenin hyökkäyksestä. IRAKeja on neljä (IRAK 1, 2, 4, M). Ne sisältävät N-terminaalisen DD:n ja keskimmäisen seriini/treoniinikinaasidomeenin. IRAK1:llä ja IRAK4:llä on luontainen kinaasiaktiivisuus, kun taas IRAK2:lla ja IRAK-M:llä ei ole havaittavaa kinaasiaktiivisuutta. IRAK4 aktivoituu MyD88:n vaikutuksesta, ja se aktivoi edelleen IRAK1:n. IRAK1 aktivoi sen jälkeen TRAF6:n. TRAF6 on tuumorinekroositekijäreseptoriin (TNFR) liittyvän tekijän (TRAF) perheen jäsen, joka välittää sytokiinien signaalireittejä. Stimulaation yhteydessä TRAF6 rekrytoituu reseptorikompleksiin ja aktivoituu IRAK-1:n avulla, joka sitoutuu TRAF6:n TRAF-domeeniin. Tämän jälkeen IRAK-1/TRAF6-kompleksi dissosioituu reseptorista ja assosioituu TGF-beeta-aktivoituneen kinaasi 1:n (TAK1) ja TAK1:tä sitovien proteiinien TAB1 ja TAB2 kanssa. TRAF6:n, TAK1:n, TAB1:n ja TAB2:n muodostama kompleksi siirtyy sytoplasmaan, jossa se muodostaa suuren kompleksin muiden proteiinien, kuten E2-ligaasien Ubc13 ja Uev1A, kanssa. Ubc13- ja Uev1A-kompleksin on osoitettu katalysoivan TRAF6:n Lys 63:een sidotun polyubikitiiniketjun synteesiä ja siten indusoivan TRAF6:n välittämän TAK1:n ja lopulta NF-kB:n aktivoinnin. Näitä edellä kuvattuja signaalireittejä kutsutaan MyD88-riippuvaisiksi reiteiksi, koska signaali lähtee MyD88-molekyylistä. On olemassa myös toinen polku, jota kutsutaan MyD88-riippumattomaksi poluksi, jossa signaalinanto ei lähde MyD88:sta. Sen sijaan signaali lähtee TRIF-proteiinista. TRIF on vuorovaikutuksessa TRAF6:n ja TRAF3:n kanssa. TRAF6 rekrytoi kinaasi RIP-1:n, joka puolestaan on vuorovaikutuksessa TAK1-kompleksin kanssa ja aktivoi sen, mikä johtaa NF-kB:n ja MAPK:iden aktivoitumiseen ja tulehdussytokiinien induktioon. Sitä vastoin TRAF3 rekrytoi IKK:hen liittyvät kinaasitTBK1 ja IKKi yhdessä NEMO:n kanssa IRF3:n fosforylaatiota ja aktivoitumista varten. IRF3 muodostaa dimeerin ja translokoituu sytoplasmasta tumaan, indusoi tyypin I IFN:n ilmentymistä.
2. Alaspäin suuntautuva signalointi
TLR:t signaloivat itse asiassa pääasiassa erityisten adaptorimolekyylien rekrytoinnin kautta, mikä johtaa transkriptiotekijöiden NF-kB:n ja IRF:ien aktivoitumiseen, jotka sanelevat synnynnäisten immuunivasteiden tuloksen. Niinpä tämä reitin jälkeinen signalointi aktivoi IRFs-transkriptiotekijän, NF-kB-signalointireitin ja MAKP-reitin. Löydät tarkempia tietoja NF-kB- ja MAKP-reitistä osoitteesta:
NF-kB-signalointireitti, P38-signalointireitti ja MAKP-signalointireitti.
3. Reitin säätely
Syistä on olemassa jonkin verran negatiivista säätelyä useiden molekyylien toimesta erilaisten mekanismien avulla, jotta voidaan ehkäistä tai lopettaa liialliset immuunivasteet, jotka johtavat autoimmuniteettiin ja tulehdussairauksiin liittyviin haitallisiin seurauksiin. MyD88-riippuvaisen reitin aktivoitumista tukahduttavat ST2825, SOCS1 ja Cbl-b, ja TRIF-riippuvaisen reitin aktivoitumista tukahduttavat SARM ja TAG. Nämä molekyylit assosioituvat MyD88:n tai TRIF:n kanssa estääkseen niitä sitoutumasta TLR:iin tai jatkoketjun molekyyleihin. TRAF3:n aktivoitumista säätelevät negatiivisesti SOCS3 ja DUBA. TRAF6:een kohdistuu useita estäviä molekyylejä, kuten A20, USP4, CYLD, TANK, TRIM38 ja SHP. TAK1:n aktivaatiota estävät TRIM30a ja A20.
4. Yhteys sairauksiin
Koska TLR osallistuu LPS:n aistimiseen ja sillä voi olla merkitystä sepsiksessä, TLR:n kohdentaminen on tärkeää useiden sairauksien hoidossa. Sen lisäksi, että TLR-vasteisiin puututaan patogeeni-infektioiden hoitamiseksi, TLR-tutkimuksista saadun tiedon ilmeinen kliininen sovellus oli TLR-ligandien käyttäminen rokotteiden adjuvantteina. Lisäksi klinikassa on yritetty myös TLR:n estoa, jonka tavoitteena on rajoittaa liiallista tulehdusta, joka oletettavasti johtuu tietyn TLR:n liiallisesta aktivoitumisesta.
| Takeda, Kiyoshi ja Shizuo Akira. ”TLR-signalointireitit”. Seminars in immunology. Vol. 16. No. 1. Academic Press, 2004. | |
| Akira, Shizuo, and Kiyoshi Takeda. ”Tollin kaltaisten reseptorien signalointi”. Nature reviews immunology 4.7 (2004): 499-511. | |
| Lim, Kian-Huat ja Louis M. Staudt. ”Tollin kaltaisten reseptorien signalointi”. Cold Spring Harbor perspectives in biology 5.1 (2013): a011247. | |
| jaTaro Kawai, Takumi Kawasaki. ”Tollin kaltaisten reseptorien signaalireitit”. Pattern Recognition Receptors and Cancer 8916 (2015): 7. | |
| Gay, Nicholas J., et al. ”Assembly and localization of Toll-like receptor signalling complexes.” Nature reviews Immunology 14.8 (2014): 546-558. | |
| O’Neill, Luke AJ, Douglas Golenbock ja Andrew G. Bowie. ”Tollin kaltaisten reseptorien historia sisäsyntyisen immuniteetin uudelleenmäärittelyssä”. Nature Reviews Immunology 13.6 (2013): 453-460. | |
| Botos, Istvan, David M. Segal ja David R. Davies. ”Tollin kaltaisten reseptorien rakennebiologia”. Structure 19.4 (2011): 447-459. |