Geneerinen nimi: naftifiinihydrokloridi
Dosointimuoto: kerma
Lääketieteellisesti tarkistanut Drugs.com. Päivitetty viimeksi 1. tammikuuta 2021. tinea cruris ja tinea corporis, jotka ovat Trichophyton rubrum -organismin aiheuttamia.
Naftifiinivoide Annostus ja antotapa
Vain paikalliseen käyttöön. Naftifiinihydrokloridivoidetta ei ole tarkoitettu silmäkäyttöön, suun kautta tai intravaginaaliseen käyttöön. Levitä ohut kerros naftifiinihydrokloridivoidetta kerran päivässä sairastuneille alueille sekä ½ tuuman marginaali terveelle ympäröivälle iholle 2 viikon ajan.
Adostusmuodot ja vahvuudet
Jokainen gramma sisältää 20 mg naftifiinihydrokloridia (2 %) valkoisessa tai luonnonvalkoisessa pohjassa.
Vasta-aiheet
Ei ole
Varoitukset ja varotoimet
Lokaaliset haittavaikutukset
Hoito on keskeytettävä, jos naftifiinihydrokloridivoiteen käytön yhteydessä ilmenee ärsytystä tai herkkyyttä. Ohjeista potilaita ottamaan yhteyttä lääkäriin, jos nämä tilat kehittyvät naftifiinihydrokloridivoiteen käytön jälkeen.
Haittavaikutukset
Kliinisistä tutkimuksista saadut kokemukset
Koska kliiniset tutkimukset tehdään hyvin erilaisissa olosuhteissa, yhden lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määriä ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin määriin, eivätkä ne välttämättä vastaa kliinisessä käytännössä havaittuja määriä.
Kliinisissä tutkimuksissa 903 koehenkilöä altistui 1 %:n ja 2 %:n naftifiinivoidemuotoilulle. Yhteensä 564 koehenkilöä, joilla oli interdigitaalinen tinea pedis, tinea cruris tai tinea corporis, hoidettiin naftifiinihydrokloridivoiteella.
Kahdessa satunnaistetussa, lääkeaineella kontrolloidussa tutkimuksessa (400 koehenkilöä hoidettiin naftifiinihydrokloridivoiteella). Väestö oli 12-88-vuotiasta, pääasiassa miehiä (79 %), 48 % valkoihoisia, 36 % mustia tai afroamerikkalaisia, 40 % latinalaisamerikkalaisia tai latinalaisamerikkalaisia, ja heillä oli joko pääasiassa interdigitaalinen tinea pedis tai tinea cruris. Useimmat koehenkilöt saivat annoksia kerran päivässä paikallisesti 2 viikon ajan peittääkseen sairastuneet ihoalueet sekä ½ tuuman marginaalin ympäröivää tervettä ihoa. Kahdessa aineella kontrolloidussa tutkimuksessa 17,5 %:lla naftifiinihydrokloridivoidetta saaneista koehenkilöistä ilmeni haittavaikutuksia verrattuna 19,3 %:iin aineella hoidetuista koehenkilöistä. Yleisin haittavaikutus (yli tai yhtä suuri kuin 1 %) on kutina. Useimmat haittavaikutukset olivat vakavuudeltaan lieviä. Haittavaikutusten esiintyvyys naftifiinihydrokloridivoidetta saaneessa populaatiossa ei eronnut merkitsevästi valmisteella hoidetusta populaatiosta.
Kolmannessa satunnaistetussa, valmisteella kontrolloidussa tutkimuksessa 116:ta tinea corporis -tautia sairastavaa pediatrista henkilöä hoidettiin naftifiinihydrokloridivoiteella. Väestö oli iältään vähintään 2-vuotiaita ja alle 18-vuotiaita (keski-ikä 9 vuotta), pääasiassa miehiä (61 %), 47 % valkoihoisia, 51 % mustia tai afroamerikkalaisia, 92 % latinalaisamerikkalaisia tai latino-amerikkalaisia, ja heillä oli tinea corporis -infektio. Naftifiinihydrokloridivoidetta levitettiin paikallisesti kerran päivässä 2 viikon ajan kaikille kehon pinta-alueille, joilla oli tinea corporis -tartunta, sekä ½ tuuman marginaalille tervettä ihoa, joka ympäröi kyseisiä leesioita. Haittavaikutusten esiintyvyys naftifiinihydrokloridivoidetta saaneessa populaatiossa ei eronnut merkitsevästi aineella käsitellystä populaatiosta.
Kahdessa avoimessa pediatrisessa farmakokinetiikka- ja turvallisuustutkimuksessa naftifiinihydrokloridivoidetta annettiin 49:lle 2-18-vuotiaalle pediatriselle henkilölle, joilla oli interdigitaalista tinea pedis -, tinea cruris – ja tinea corporis -tauti. Haittavaikutusten esiintyvyys pediatrisessa populaatiossa oli samanlainen kuin aikuispopulaatiossa havaittu.
Kokemukset markkinoille tulon jälkeen
Naftifiinihydrokloridivoiteen myyntiluvan myöntämisen jälkeisen käytön aikana on havaittu seuraavia haittavaikutuksia: punoitus/ärsytys, tulehdus, maseroituminen, turvotus, polttava tunne, rakkulat, seroosinen valuminen, kuorenmuodostus, päänsärky, heitehuimaus, leukopenia, agranulosytoosi.
Koska nämä reaktiot ilmoitetaan vapaaehtoisesti populaatiosta, jonka koko on epävarma, niiden esiintymistiheyttä ei ole aina mahdollista arvioida luotettavasti eikä todeta syy-yhteyttä lääkealtistukseen.
KÄYTTÖ ERITYISRYHMISSÄ
Raskaus
Riskin yhteenveto
Naftifiinihydrokloridivoiteen käytöstä raskaana olevilla naisilla ei ole saatavilla tietoja, jotka antaisivat tietoa lääkkeeseen liittyvästä suurten synnynnäisten epämuodostumien ja keskenmenon riskistä. Eläimillä tehdyissä lisääntymistutkimuksissa ei havaittu haitallisia vaikutuksia sikiön kehitykseen annoksilla, jotka annettiin oraalisesti organogeneesin aikana raskaana oleville rotille enintään 18-kertaisina suurimpaan suositeltuun ihmisannokseen (maximum recommended human dose, MRHD) asti, tai ihonalaisilla annoksilla, jotka annettiin organogeneesin aikana raskaana oleville rotille enintään 2-kertaisina MRHD-arvoihin nähden tai raskaana oleville kaneille enintään 4-kertaisina MRHD-arvoihin nähden.
Merkityn väestöryhmän suurten synnynnäisten epämuodostumien ja keskenmenon arvioitua tausta-altistumisriskiä ei tunneta. Kaikissa raskauksissa on synnynnäisen epämuodostuman, menetyksen tai muun haitallisen lopputuloksen taustariski. Yhdysvaltain yleisväestössä suurten synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti todetuissa raskauksissa on 2-4 % ja 15-20 %.
Tiedot
Tiedot eläimistä
Systeemisiä alkion ja sikiön kehitystutkimuksia on tehty rotilla ja kaneilla. Vertailtaessa eläinannoksia ihmisannoksiin kehon pinta-alan vertailun perusteella (mg/m2) MRHD-arvoksi on asetettu 8 g 2 % voidetta päivässä (2,67 mg/kg/vrk 60 kg painavalle yksilölle).
Oraalisia annoksia 30, 100 ja 300 mg/kg/vrk naftifiinihydrokloridia annettiin tiineille naaraspuolisille rotille organogeneesin aikana. Hoitoon liittyviä vaikutuksia sikiön kehitykseen ei havaittu annoksilla 300 mg/kg/vrk asti (18 kertaa MRHD). Naftifiinihydrokloridia annettiin tiineille naarasrotille ihonalaisina annoksina 10 ja 30 mg/kg/vrk organogeneesin aikana. Hoitoon liittyviä vaikutuksia sikiön kehitykseen ei havaittu annoksella 30 mg/kg/vrk (2 kertaa MRHD). Naftifiinihydrokloridia annettiin 3, 10 ja 30 mg/kg/vrk ihonalaisina annoksina tiineille naaraskaniineille organogeneesin aikana. Hoitoon liittyviä vaikutuksia sikiön kehitykseen ei havaittu annoksella 30 mg/kg/vrk (4 kertaa MRHD).
Rotilla tehtiin peri- ja postnataalista kehitystä koskeva tutkimus. Naftifiinihydrokloridia annettiin naaraspuolisille rotille suun kautta annoksina 30, 100 ja 300 mg/kg/vrk 14. tiineyspäivästä 21. imetyspäivään. Naaraiden painonnousu tiineyden aikana ja jälkeläisten painonnousu imetyksen aikana väheni annoksella 300 mg/kg/vrk (18 kertaa MRHD). Kehitystoksisuutta ei havaittu annoksella 100 mg/kg/vrk (6 kertaa MRHD).
Laktatointi
Riskien yhteenveto
Naftifiinihydrokloridikerman esiintymisestä ihmismaidossa, lääkeaineen vaikutuksista imetettävään lapseen tai lääkeaineen vaikutuksista maidontuotantoon ei ole saatavilla tietoa. Kliinisten tietojen puuttuminen imetyksen aikana estää selkeän määrityksen naftifiinihydrokloridivoiteen imeväisikäiselle imeväiselle aiheuttamasta riskistä imetyksen aikana; siksi on otettava huomioon imetyksen kehitys ja terveyshyödyt sekä äidin kliininen tarve naftifiinihydrokloridivoiteen käytölle ja mahdolliset naftifiinihydrokloridivoiteen tai äidin perussairauden aiheuttamat haittavaikutukset imettävälle imeväiselle.
Pediatrinen käyttö
Naftifiinihydrokloridivoiteen turvallisuus ja teho on todettu pediatrisilla potilailla, jotka ovat vähintään 12-vuotiaita ja joilla on interdigitaalinen tinea pedis ja tinea cruris sekä vähintään 2-vuotiaita ja joilla on tinea corporis .
Naftifiinihydrokloridivoiteen käyttöä näissä ikäryhmissä tukevat aikuisilla ja lapsilla tehdyistä riittävistä ja hyvin kontrolloiduista tutkimuksista saadut todisteet ja lisäksi turvallisuus- ja PK-tiedot kahdesta avoimesta tutkimuksesta, jotka tehtiin 49:llä naftifiinihydrokloridivoiteelle altistuneella pediatrisella koehenkilöllä .
Naftifiinihydrokloridivoiteen turvallisuutta ja tehoa tinea cruriksen ja interdigitaalisen jalkapohjatulehduksen (interdigitaalinen jalkapohjavaltimotulehdus, interdigitaalinen tinea pedis, tinea tinea crursis, interdigitaalinen tinea pedis ) hoidossa alle 12- vuotiailla pediatrisilla potilailla ei ole osoitettu. Naftifiinihydrokloridivoiteen turvallisuutta ja tehoa tinea corporiksen hoidossa alle 2-vuotiailla lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Naftifiinihydrokloridivoiteella tehdyissä kliinisissä tutkimuksissa ei ollut mukana riittävästi 65 vuotta täyttäneitä koehenkilöitä, jotta olisi voitu määrittää, reagoivatko he eri tavalla kuin nuoremmat koehenkilöt.
Naftifiinivoiteen kuvaus
Naftifiinihydrokloridivoide, USP, on valkoisesta luonnonvalkoiseen vaihteleva voide, joka on tarkoitettu vain paikalliseen käyttöön. Jokainen gramma sisältää 20 mg naftifiinihydrokloridia, USP, (2 %), synteettistä allyyliamiini antifungaalista yhdistettä.
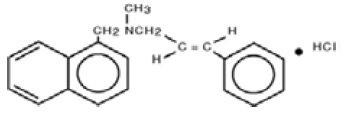
Kemiallisesti naftifiinihydrokloridi on (E)-N-kinnamyyli-N-metyyli-1-naftaleenimetyyliamiinihydrokloridia.
Molekyylikaava on C21H21N-HCl, jonka molekyylipaino on 323,86.
Naftifiinihydrokloridi, USP:n rakennekaava on:
Naftifiinihydrokloridivoide, USP sisältää seuraavia inaktiivisia aineosia: bentsyylialkoholi, setyylialkoholi, setyyliestereiden vaha, isopropyylimyristaatti, polysorbaatti 60, puhdistettu vesi, natriumhydroksidi, sorbitaanimonostearaatti ja stearyylialkoholi. Suolahappoa voidaan lisätä pH:n säätämiseksi.
Naftifiinihydrokloridivoide – Kliininen farmakologia
Vaikutusmekanismi
Naftifiinihydrokloridivoide on paikallisesti käytettävä sienilääke.
Farmakodynamiikka
Naftifiinihydrokloridivoiteen farmakodynamiikkaa ei ole vahvistettu.
Farmakokinetiikka
In vitro- ja in vivo -biologisen hyötyosuuden tutkimukset ovat osoittaneet, että naftifiini tunkeutuu sarveiskerrokseen riittävänä pitoisuutena estämään dermatofyyttien kasvua.
Naftifiinihydrokloridivoiteen farmakokinetiikkaa arvioitiin sen jälkeen, kun sitä oli sovellettu kerran vuorokaudessa paikallisesti 2 viikon ajan 21:lle aikuiselle koehenkilölle, jotka edustivat sekä mies- että naispuolisia henkilöitä ja joilla oli sekä tinea pedis- että tinea cruris-tauti. Käytetyn voiteen kokonaismäärän mediaani oli 6,4 g (vaihteluväli 5,3 g – 7,5 g) päivässä. Tulokset osoittivat, että systeeminen altistuminen (eli enimmäispitoisuus (Cmax) ja käyrän alle jäävä pinta-ala ajasta 0-24 tuntiin (AUC0-24) naftifiinille lisääntyi kahden viikon hoitojakson aikana kaikilla 21 tutkittavalla. Geometrinen keskiarvo (variaatiokerroin tai CV%) AUC0-24 oli 117 (41,2) ng*hr/ml päivänä 1 ja 204 (28,5) ng*hr/ml päivänä 14. Geometrinen keskiarvo (CV-%) Cmax oli 7 ng/ml (55,6) päivänä 1 ja 11 ng/ml (29,3) päivänä 14. Cmax-arvon saavuttamiseen kuluneen ajan (Tmax) mediaani oli 8 tuntia (vaihteluväli 4-24 tuntia) päivänä 1 ja 6 tuntia (vaihteluväli 0-16 tuntia) päivänä 14. Kertymä 14 päivän paikallisen annostelun jälkeen oli alle kaksinkertainen. Pohjakonsentraatiot kasvoivat yleensä koko 14 päivän tutkimusjakson ajan. Naftifiinia havaittiin edelleen plasmassa 13/21 (62 %) koehenkilöllä päivänä 28. Plasmapitoisuuksien keskiarvo (keskihajonta tai SD) oli 1,6 ± 0,5 ng/ml (vaihteluväli alle määritysrajan (BLQ) – 3 ng/ml). Samassa farmakokineettisessä tutkimuksessa, joka tehtiin potilailla, joilla oli tinea pedis ja tinea cruris, mediaaniosuus annoksesta, joka erittyi virtsaan hoitojakson aikana, oli 0,0016 % päivänä 1 verrattuna 0,0020 %:iin päivänä 14.
Toisessa tutkimuksessa, johon osallistui 22 koehenkilöä, arvioitiin naftifiinihydrokloridivoiteen farmakokinetiikkaa 20:llä pediatrisella koehenkilöillä, jotka olivat 13 ja jotka olivat alle 18-vuotiaita ja joilla esiintyi sekä tinea pedis että tinea cruris. Koehenkilöitä hoidettiin 8,1 g:n (vaihteluväli 6,6 g-10,1 g) mediaaniannoksella, joka levitettiin sairastuneille alueille kerran päivässä 2 viikon ajan. Tulokset osoittivat, että systeeminen altistus lisääntyi hoitojakson aikana. Geometrinen keskiarvo (CV%) AUC0-24 oli 138 (50,2) ng*hr/ml päivänä 1 ja 192 (74,9) ng*hr/ml päivänä 14. Geometrinen keskiarvo (CV %) Cmax oli 9,21 ng/ml (48,4) päivänä 1 ja 12,7 ng/ml (67,2) päivänä 14. Hoitojakson aikana virtsaan erittyneen annoksen mediaaniosuus oli 0,0030 % päivänä 1 ja 0,0033 % päivänä 14.
Kolmannessa tutkimuksessa arvioitiin naftifiinihydrokloridivoiteen farmakokinetiikkaa 27:llä 2-12-vuotiaalla lapsella, joilla oli vähintään keskivaikea tinea corporis. Koehenkilöt jaettiin nuorempiin (2-6-vuotiaat, 17 koehenkilöä) ja vanhempiin (6-12-vuotiaat, 10 koehenkilöä) ryhmiin. Mediaaniannokset 1,3 g (vaihteluväli 1 g-3,1 g) ja 2,3 g (vaihteluväli 2,2 g-4,2 g) annosteltiin kerran päivässä kahden viikon ajan nuoremmissa ja vanhemmissa ryhmissä sairastuneelle alueelle ja ½ tuuman marginaaliin. Plasman ja virtsan farmakokineettiset arvioinnit tehtiin päivänä 1 vain vanhemmassa ryhmässä ja päivänä 14 molemmissa ryhmissä. Kaikilla koehenkilöillä todettiin mitattavia naftifiinipitoisuuksia plasmassa naftifiinihydrokloridivoiteen paikallisen käytön jälkeen. Päivänä 1 annetun kerta-annoksen jälkeen 6-12-vuotiailla koehenkilöillä Cmax-arvon geometrinen keskiarvo (CV%) oli 3,60 (76,6) ng/ml ja AUC0-24-arvon geometrinen keskiarvo (CV%) oli 49,8 (64,4) ng*h/ml. Päivänä 14 tässä ryhmässä Cmax- ja AUC0-24-arvot olivat 3,31 (51,2) ng/ml ja 52,4 (49,2) ng*h/ml. Päivänä 14 2-6-vuotiailla koehenkilöillä Cmax ja AUC0-24 olivat 3,98 (186) ng/ml ja 54,8 (150) ng*h/ml. Vanhemmassa, 6-12-vuotiaiden koehenkilöiden ryhmässä systeemiset altistukset (sekä Cmax että AUC0-24) päivinä 1 ja 14 olivat vertailukelpoisia. Mediaaniosuus annoksesta, joka erittyi virtsaan 24 tunnin aikana lääkkeen annostelun jälkeen päivänä 1 ja päivänä 14, oli 0,0029 % ja 0,0014 %.
Mikrobiologia
Vaikka tarkkaa vaikutusmekanismia sieniä vastaan ei tunneta, naftifiinihydrokloridi näyttää häiritsevän sterolien biosynteesiä estämällä skvaleeni2, 3-epoksidaasientsyymiä.Tämä entsyymin toiminnan esto johtaa sterolien, erityisesti ergosterolin, määrän vähenemiseen ja vastaavasti skvaleenin kertymiseen soluihin.
Resistenssimekanismi
Naftifiinille ei ole toistaiseksi tunnistettu resistenssimekanismia.
Naftifiinin on osoitettu tehoavan useimpiin seuraavien sienten isolaatteihin sekä in vitro että kliinisissä infektioissa, kuten kohdassa Käyttöaiheet ja käyttö on kuvattu:
Trichophyton rubrum
Nonkliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikentyminen
Kaksi vuotta kestäneessä ihokarsinogeenisuustutkimuksessa naftifiinihydrokloridivoidetta annosteltiin Sprague-Dawley-rotille paikallisina annoksina 1 %:n, 2 %:n ja 3 %:n annoksina (naftifiinihydrokloridiannoksia oli 1 %, 2 %:n ja 3 %:n pitoisuuksina (naftifiinihydrokloridiannoksia oli annosteltavissa 10, 20 ja 30 mg/kg/päivä). Tässä tutkimuksessa ei havaittu lääkkeeseen liittyviä kasvaimia suurimpaan tässä tutkimuksessa arvioituun annokseen 30 mg/kg/vrk asti (12 kertaa MRHD AUC-vertailun perusteella).
Naftifiinihydrokloridilla ei havaittu viitteitä mutageenisesta tai klastogeenisesta potentiaalista kahden in vitro -genotoksisuustestin (Amesin testi ja kiinalaisen hamsterin munasarjasolujen kromosomipoikkeavuustesti) ja yhden in vivo -genotoksisuustestin (hiiren luuytimen mikronukleuskoe) tulosten perusteella.
Naftifiinihydrokloridin oraalinen anto rotille koko astutuksen, tiineyden, synnytyksen ja laktaation ajan ei osoittanut vaikutuksia kasvuun, hedelmällisyyteen tai lisääntymiseen annoksilla, jotka olivat enintään 100 mg/kg/vrk (6 kertaa MRHD).
Kliiniset tutkimukset
Tinea cruris
Naftifiinihydrokloridivoiteen turvallisuutta ja tehoa on tutkittu satunnaistetussa, kaksoissokkoutetussa, lääkeaineella kontrolloidussa, monikeskustutkimuksessa 146:lla henkilöllä, joilla oli oireinen ja dermatofyyttiviljelypositiivinen tinea cruris. Koehenkilöt satunnaistettiin saamaan naftifiinihydrokloridivoidetta tai lääkettä. Koehenkilöt levittivät naftifiinihydrokloridivoidetta tai valmisteyhteenvetoa sairastuneelle alueelle sekä ½ tuuman marginaalille tervettä ihoa, joka ympäröi sairastunutta aluetta, kerran päivässä 2 viikon ajan. Tinea cruriksen merkit ja oireet (eryteeman, kutinan ja hilseilyn esiintyminen tai puuttuminen) arvioitiin, ja KOH-tutkimus ja dermatofyyttiviljely tehtiin ensisijaisessa tehon päätetapahtumassa viikolla 4.
Tutkimuspopulaation keski-ikä oli 47 vuotta, ja heistä 87 % oli miehiä ja 43 % valkoihoisia. Lähtötilanteessa tutkittavilla vahvistettiin olevan tinea cruriksen merkkejä ja oireita, positiivinen KOH-tutkimus ja vahvistettu dermatofyyttien esiintyminen keskitetyn mykologian laboratorion viljelytulosten perusteella. Käsiteltävää väestöä koskevassa analyysissä verrattiin niiden koehenkilöiden osuuksia, joilla oli täydellinen paraneminen viikon 4 tutkimuskäynnillä (ks. taulukko 1). Täydellinen paraneminen määriteltiin sekä kliiniseksi paranemiseksi (eryteeman, kutinan ja hilseilyn puuttuminen) että mykologiseksi paranemiseksi (negatiivinen KOH- ja dermatofyyttiviljely).
Kliinisen paranemisen kokeneiden koehenkilöiden prosentuaalinen osuus ja niiden koehenkilöiden prosentuaalinen osuus, joilla oli todettu mykologinen paraneminen viikolla 4, esitetään yksitellen taulukossa 1 jäljempänä.
|
Loppupiste |
Naftifiinihydrokloridivoide, 2% |
Vehicle |
|
N=75 |
N=71 |
|
|
Täydellinen Curea |
19 (25%) |
2 (3%) |
|
Tehokas hoitob |
45 (60%) |
7 (10%) |
|
Mycological Curec |
54 (72%) |
11 (16%) |
|
a. Täydellinen paraneminen on sekä mykologisen paranemisen että kliinisen paranemisen yhdistetty päätetapahtuma. Kliininen paraneminen määritellään eryteeman, kutinan ja hilseilyn puuttumiseksi (aste 0). |
||
|
b. Tehokkaaksi hoidoksi katsotaan negatiivinen KOH-valmiste ja negatiivinen dermatofyyttiviljely, eryteema, hilseily ja pruritus asteella 0 tai 1 (puuttuu tai lähes puuttuu). |
||
|
c. Mykologinen paraneminen määritellään negatiiviseksi KOH- ja dermatofyyttiviljelyksi. |
||
Interdigitaalinen tinea pedis
Naftifiinihydrokloridivoiteen tehoa on tutkittu satunnaistetussa, kaksoissokkoutetussa, lääkeaineella kontrolloidussa, monikeskustutkimuksessa 217:llä koehenkilöllä, joilla oli oireileva ja dermatofyyttiviljelyssä positiivinen interdigitaalinen tinea pedis. Koehenkilöt satunnaistettiin saamaan naftifiinihydrokloridivoidetta tai lääkettä. Koehenkilöt levittivät naftifiinihydrokloridivoidetta tai valmisteyhteenvetoa jalkaterän sairastuneelle alueelle sekä ½ tuuman marginaalille tervettä ihoa, joka ympäröi sairastunutta aluetta, kerran päivässä 2 viikon ajan. Interdigitaalisen tinea pediksen merkit ja oireet (eryteema, kutina ja hilseily) arvioitiin ja tehtiin KOH-tutkimus ja dermatofyyttiviljely ensisijaisessa tehon päätetapahtumassa viikolla 6.
Tutkimuspopulaation keski-ikä oli 42 vuotta, ja 71 % oli miehiä ja 57 % valkoihoisia. Lähtötilanteessa tutkittavilla vahvistettiin interdigitaalisen tinea pediksen merkit ja oireet, positiivinen KOH-tutkimus ja vahvistettu dermatofyyttiviljely. Ensisijainen tehon päätetapahtuma oli niiden koehenkilöiden osuus, joilla oli täydellinen paraneminen viikon 6 tutkimuskäynnillä (ks. taulukko 2). Täydellinen paraneminen määriteltiin sekä kliiniseksi paranemiseksi (eryteeman, kutinan ja hilseilyn puuttuminen) että mykologiseksi paranemiseksi (negatiivinen KOH- ja dermatofyyttiviljely).
Tehokkuustulokset viikolla 6, neljä viikkoa hoidon päättymisen jälkeen, on esitetty taulukossa 2. Naftifiinihydrokloridivoide osoitti täydellistä paranemista koehenkilöillä, joilla oli interdigitaalinen tinea pedis, mutta täydellistä paranemista koehenkilöillä, joilla oli vain mokkasiinityyppinen tinea pedis, ei osoitettu.
|
Loppupiste |
Naftifiinihydrokloridivoide, 2% |
Vehikkeli |
|
N=147 |
N=70 |
|
|
Täydellinen Curea |
26 (18%) |
5 (7%) |
|
Tehokas hoitob |
83 (57 %) |
14 (20 %) |
|
Mycological Curec |
99 (67%) |
15 (21%) |
|
a. Täydellinen paraneminen on sekä mykologisen paranemisen että kliinisen paranemisen yhdistetty päätetapahtuma. |
||
|
b. Tehokkaalla hoidolla tarkoitetaan negatiivista KOH-valmistetta ja negatiivista dermatofyyttiviljelmää, eryteemaa, hilseilyä ja kutinaa asteikolla 0 tai 1 (puuttuu tai lähes puuttuu). |
||
|
c. Mykologinen paraneminen määritellään negatiiviseksi KOH- ja dermatofyyttiviljelyksi. |
||
Tinea corporis
Naftifiinihydrokloridivoiteen turvallisuutta ja tehoa on tutkittu satunnaistetussa, kaksoissokkoutetussa, lääkeaineella kontrolloidussa, monikeskustutkimuksessa 184:llä koehenkilöllä, joilla oli oireileva ja dermatofyyttiviljelyssä positiivinen tinea corporis. Koehenkilöt satunnaistettiin saamaan naftifiinihydrokloridivoidetta tai lääkettä. Koehenkilöt levittivät tutkimusainetta kaikille kehon pinta-alueille, joilla esiintyi tinea corporis -bakteeria, sekä ½ tuuman marginaalille tervettä ihoa, joka ympäröi kyseisiä leesioita, kahden viikon ajan. Tinea corporiksen merkit ja oireet (eryteeman, kovettumien ja kutinan esiintyminen tai puuttuminen) arvioitiin ja tehtiin KOH-tutkimus ja dermatofyyttiviljely ensisijaisen tehon päätetapahtuman arvioimiseksi päivänä 21.
Tutkimuspopulaatio oli pediatrinen (vähintään 2 ja enintään 18-vuotias), ja sen mediaani-ikä oli 9 vuotta (naftifiinihydrokloridivoidetta) tai 8 vuotta (valmisteyhteenveto). 61 % koehenkilöistä oli uroksia, ja heistä 45 % oli valkoihoisia. Lähtötilanteessa koehenkilöillä vahvistettiin olevan tinea corporiksen merkkejä ja oireita, positiivinen KOH-tutkimus ja vahvistettu dermatofyyttiviljely. Ensisijainen tehon päätetapahtuma oli niiden koehenkilöiden osuus, joilla oli täydellinen paraneminen päivän 21 tutkimuskäynnillä. Täydellinen paraneminen määriteltiin sekä kliiniseksi paranemiseksi (eryteeman, kovettumien ja kutinan puuttuminen kaikista lähtötilanteessa esiintyneistä leesioista) että mykologiseksi paranemiseksi (negatiivinen KOH- ja dermatofyyttiviljely).
Tehokkuustulokset hoitopäivänä 21, viikon kuluttua hoidon päättymisestä, on esitetty alla olevassa taulukossa 3.
|
Naftifiinihydrokloridivoide, 2 % |
Valmiste |
|
|
Loppupiste |
N=91 |
N=93 |
|
Täydellinen kura |
42 (46%) |
26 (28%) |
|
Tehokas hoitob |
53 (58%) |
32 (34%) |
|
Mycological Curec |
57 (63%) |
36 (39%) |
|
a. Täydellinen paraneminen on sekä mykologisen paranemisen että kliinisen paranemisen yhdistetty päätetapahtuma. |
||
|
b. Tehokkaaksi hoidoksi katsotaan negatiivinen KOH-valmiste ja negatiivinen dermatofyyttiviljely, eryteema, kovettuma ja kutina asteella 0 tai 1 (puuttuu tai on lievää). |
||
|
c. Mykologinen paraneminen määritellään negatiiviseksi KOH- ja dermatofyyttiviljelyksi. |
||
MITEN SAATAVA/ VARASTOINTI JA KÄSITTELY
Naftifiinihydrokloridivoide, USP 2 %, on valkoisesta luonnonvalkoiseen vaihteleva voide, joka toimitetaan seuraavassa koossa:
45 gramman tuubit – NDC 70700-161-18
60 gramman tuubit – NDC 70700-161-17
Varastoi naftifiinihydrokloridivoide 25°C:ssa (77°F); poikkeamat sallittu 15°-30°C:een (59°-86°F) .
Potilasohjeet
- Kertokaa potilaille, että naftifiinihydrokloridivoide on tarkoitettu vain paikalliseen käyttöön. Naftifiinihydrokloridivoidetta ei ole tarkoitettu oraaliseen, intravaginaaliseen tai silmäkäyttöön.
- Jos naftifiinihydrokloridivoiteen käytön yhteydessä kehittyy ärsytystä tai herkkyyttä, hoito on lopetettava ja aloitettava asianmukainen hoito. Potilaita on ohjattava ottamaan yhteyttä lääkäriin, jos nämä tilat kehittyvät naftifiinihydrokloridivoiteen käytön jälkeen.
Jakelija:
Xiromed, LLC,
Florham Park, NJ 07932
Rev. 09/2020
PI-161-00
PAKKAUSSELOSTE PAKKAUSSELOSTEEN PÄÄLLEKIRJOITUSTAULUKKO – 45g tuubi

NDC 70700-161-18
Naftifiinivoide, 2 %
Xiromed, LLC
Valmistetta vain paikalliseen käyttöön
ei silmäkäyttöön, Oraaliseen tai intravaginaaliseen käyttöön
45 g
Vain reseptilääkkeeksi
PAKKAUSSELOSTE PAKKAUSSELOSTEEN PÄÄLLEKIRJOITUSPANEELI – 60 g:n tuubi

NDC 70700-161-17
Naftifine Cream, 2%
Xiromed, LLC
Vain paikalliseen käyttöön
Ei silmäkäyttöön, Oraaliseen tai intravaginaaliseen käyttöön
60 g
Vain reseptilääke
| NAFTIFIINIHYDROKLORIDI naftifiinihydrokloridivoide |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
| Markkinointitiedot | |||
| Markkinointiluokka | Hakemuksen numero tai monografian viittaus | Markkinoinnin alkamispäivä | Markkinoinnin päättymispäivä |
| ANDA | ANDA210038 | 01/15/2021 | |
Labeler – Xiromed, LLC (080228637)
Rekisteröijä – Xiromed Pharma España, S.L. (468835741)
Lisätietoa naftifine ajankohtainen
- Haittavaikutukset
- Raskauden tai imetyksen aikana
- Asietiedot
- Hinnoittelu &Kuponkeja
- En Español
- 7 Arvosteluja
- Lääkeaineluokka:
Kuluttajan resurssit
- Potilastiedot
- Naftifine Topical (Advanced Reading)
Ammattilaisen resurssit
- Reseptitiedot
- Naftifine (Ammattimainen potilasohje)
- Naftifiinigeeli (FDA)
Muut tuotemerkit Naftin
Hoito-oppaat
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Lääketieteellinen vastuuvapauslauseke