Tässä luvussa esitellään sellaista asiaa, joka antaa opiskelijalle käsityksen raudan ja teräksen teknisessä tutkimuksessa käytettävistä analyysimenetelmistä. Tämän työn luonne estää aiheen yksityiskohtaisen käsittelyn – käsittelyn, joka voi vaatia minkä tahansa yhden tai useamman seuraavan aineen arviointia: Hiili (vapaa ja yhdistetty), rikki, pii, fosfori, mangaani, titaani, kupari, nikkeli, koboltti, kromi, alumiini, arseeni, antimoni, tina, volframi, vanadiini, typpi, rauta. Yleisesti ottaen eniten tarvitaan hiilen, rikin, piin ja fosforin arviointia. Muista mainituista alkuaineista ja yhdisteistä yhden tai useamman määrittäminen on tarpeen erikoisterästen tapauksessa. Näitä määrityksiä koskevat tiedot löytyvät teoksesta Chemical Analysis and Foundry Chemistry, Crobaugh ; The. Chemical Analysis of Iron, kirjoittanut Blair ; ”Carbon in Steel by Direct Combustion”, kirjoittanut Blount, The Analyst, Jan. 1902; ”Sulphur in Wrought Iron and Steel”, kirjoittanut Auchy, Jour. Amer. Chem. Soc., maaliskuu 1901, ja muita artikkeleita samoissa lehdissä. Opiskelijan, joka haluaa edetä pidemmälle, tulisi mahdollisuuksien mukaan tutustua Campbellin, Drownin ja muiden julkaisuihin ja artikkeleihin, joita julkaistaan aika ajoin eri kemian ja metallurgian alan lehdissä.
Koska opiskelijan aika on rajallinen, hän voi toistaiseksi lykätä piin ja fosforin arviointia, vaikka ne esitetäänkin, koska ne ovat tärkeitä sekä metallurgille että valimomiehelle.
Jotta opiskelija saisi perusteellisemman käsityksen aiheesta, muutama huomautus 0n tarkasteltujen aineiden koostumuksesta ja ominaisuuksista ei ole paikallaan. Mitä tulee eri alkuaineiden vaikutukseen teräkseen, tutustu H. H. Campbellin teokseen The Manufacture and Properties of Structural Steel.
Hiili esiintyy raudassa kolmessa tilassa – grafiittisena, liuenneena ja yhdistettynä. Näiden lisäksi mikroskoopilla on tunnistettu muitakin muotoja.
Rikki esiintyy raudassa pääasiassa sulfidina FeS. joka liukenee sulaan rautaan.
Fosfori esiintyy raudan fosfidina, joka liukenee täysin sulaan rautaan.
Pii muodostaa raudan silisidiä, joka myös liukenee sulaan rautaan.
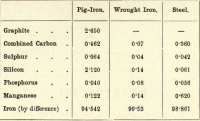
Näistä neljästä alkuaineesta hiili on siis ainoa, joka voi esiintyä vapaana. Vaihtelut eri alkuaineiden osuuksissa ovat lähes äärettömät, mutta seuraavassa lyhyessä taulukossa esitetään rautaraudan, takorautojen ja teräksen likimääräinen koostumus, vaikka kussakin näistä esiintyy huomattavia vaihteluita.
Opiskelijan on arvioitava seuraavat:-
(1) Hiili,
(a) Yhteensä.
(b) Grafiitti.
(c) Yhdistetty.
(2) Rikki.
(3) Pii. (Jos aika sallii.)
(4) Fosfori. (Jos aika sallii.)
HIILI Yhteensä
Tässä arviossa hiili muuttuu CO2:ksi, joka imeytyy kalimaasälpäliuokseen. Näin saadun CO2:n painosta lasketaan hiili.
Ensi silmäyksellä näyttäisi siltä, että yksinkertaisin menettelytapa olisi sytyttää rauta- tai teräsporat suoraan happivirrassa ja absorboida näin muodostunut CO2 KHO:ssa. Valitettavasti tämä menetelmä on toistaiseksi joko osoittautunut epätarkaksi, tai jos täydellinen palaminen on saatu aikaan, korkeaa lämpötilaa tai muita käsittelyssä tapahtuvia vaihteluita kestämään tarvittava laite ei ole soveltunut tekniseen työhön (ks. Blountin artikkelit The Analyst -lehdessä). Opiskelija huomaa, että tässä esitetty menetelmä ei ole teknisestä näkökulmasta mitenkään ihanteellinen mukavuuden ja nopeuden kannalta, ja näyttää todennäköiseltä, että se korvataan lähitulevaisuudessa jollakin nopeammalla suoralla hapetusmenetelmällä.
Hyväksytty menetelmä.
Viitattaessa moniin tätä aihetta käsitteleviin teoksiin, menetelmiä löytyy hyvin monenlaisia. Tässä esitetyllä menetelmällä saadaan tavanomaisella huolellisuudella tarkkoja tuloksia. Lyhyesti se on seuraava:-
Rauta liuotetaan kaliumin ja kuparin kaksoiskloridin liuokseen, joka on tehty happamaksi HCl:llä. Metallinen kupari saostetaan ja liuotetaan uudelleen; rauta liuotetaan, hiili jätetään suspensioon. Sitten se kerätään talteen ja sytytetään polttouunissa hapen kanssa, ja kehittynyt hiilidioksidi punnitaan.
Raudan liuotus.-Punnitaan 1 gramma raakarautaporaa. Siirretään 300 cc:n dekantterilasiin. Lisätään 100 c.cs. CuCl2,2KCl,2H2O-liuosta, joka valmistetaan seuraavasti. Liuotetaan veteen 149,1 osaa KCl ja 170,3 osaa kiteistä CuCl2,2H2O. Haihdutetaan ja kiteytetään kaksoiskloridi. Liuotetaan 300 g kaksoissuolaa tislattuun veteen. Suodatetaan sytytetyn asbestin läpi ja säilötään tulpattuihin lasipulloihin.
Lisätään dekantterilasin sisältöön 7 c.cs. HCl, jotta liuos saadaan happamaksi. Sekoitetaan ajoittain, kunnes rauta on liuennut. Asetetaan dekantterilasi sisältöineen liuoksen loppupuolelle vesihauteeseen, jonka lämpötila on noin 60° C. Seuraavat reaktiot tapahtuvat-Fe + CuCl2 = FeCl2 + Cu ja Cu + CuCl2 = 2CuCl. KCl vain auttaa saostuneen kuparin liukenemista. Noin 40 minuutin kuluttua kaksoiskloridien lisäämisestä liuoksen pitäisi olla lähes täydellinen ja suurimman osan kuparista liuennut. Huuhtele dekantterilasin sivut pienellä määrällä hapatettua kaksoiskloridia. Liuokseen lisätään hieman sytytettyä asbestia, jotta hiilipitoinen aines laskeutuu ja estää sitä tukkimasta suodatinta (Barban suositusten mukaisesti).
Suodatusta varten erityiset platinaveneet, jotka on asennettu Goochin upokkaan periaatteella, ovat erittäin käteviä. Opiskelija voi kuitenkin suodattaa hiilipitoisen aineksen pois Goochin upokkaalla, jota tuetaan keinotekoisella imulla, jolloin hiilipitoinen aines pestään vesisuihkulla sen jälkeen, kun neste on kulkenut suodattimen läpi. Suodattimessa oleva hiili pestään huolellisesti kuumalla vedellä. Kuivataan upokas ja
sisältö ilmauunissa 100 C:ssa. Hiilipitoinen aine on nyt valmis sytytystä varten.
Hiilen hapettaminen.
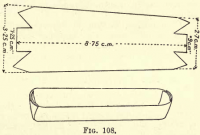
Valmistetaan platinalaiva leikkaamalla pala platinafoliota kuvassa 108 esitetyllä tavalla ja taittamalla sivut ja päät ylöspäin niin, että muodostuu kaukalo. Siirretään hiilipitoinen aines ja asbesti Goochista veneeseen.
Polttouuni, tarvikkeet ja varusteet on asetettava kuntoon. Hapenpuhdistuslaitetta käytetään jälleen, mutta tällä kertaa se varustetaan kolmitieputkella, jonka hanat asetetaan varaston ja puhdistimien väliin. Tämä mahdollistaa ilmavirran johtamisen laitteen läpi. Polttoputki voi olla kovaa Jenan lasia, posliinia tai platinaa. U-putkia käytetään kahta U-putkea uunin ja potaskapolttimien välillä. Ensimmäisen putken uunia lähinnä oleva osa sisältää vedetöntä CuSO4:ää ja toinen osa vedetöntä CuCl:ää. Toinen U-putki sisältää kuivattua CaCl2:ta. Nämä kaksi putkea muodostavat ”puhdistusjunan”. CuCl absorboi kaiken Cl:n ja muut aineet kaiken H2O:n. Tätä sarjaa voidaan käyttää monissa määrityksissä. Kalilamput ja suojaputket seuraavat perässä, ja aspiraattorin pitäisi olla kätevä, jotta laitteiston läpi voidaan tarvittaessa vetää ilmavirta. Kalilamput täytetään 8E:lla. KHO:lla ja suojaputki CaCl2:lla. Testataan uunia ja polttimoita kuten edellä on kuvattu (ks. Hiili ja koksi), putki täytetään kuten luonnoksessa, venettä pidetään toistaiseksi ilmauunissa 100 °C:n lämpötilassa.
Kun kaikki on valmista, kun polttimet on sammutettu joksikin aikaa, venettä ja sisältöä asetetaan sisään. Polttimet sytytetään etupäästä, vähitellen työskennellään taaksepäin, ja hidas happivirta, noin kaksi kuplia sekunnissa, on aiemmin kytketty päälle, kunnes putki on täynnä happea. Säädetään lämpötilaa, kunnes vene on himmeän punainen, ja jos polttimoissa oleva liuos osoittaa merkkejä juoksemisesta takaisin uuniin, lisätään happivirtausta kolmeen tai neljään kuplaan sekunnissa.
Veneen asettamisesta sisään noin viisikymmentä minuuttia riittää täydelliseen palamiseen. Kytketään happi pois päältä ja johdetaan ilmavirtaa kymmenen minuutin ajan.
Potilaslamput ja suojaputki otetaan nyt pois ja punnitaan, ja hiili lasketaan tavalliseen tapaan.
(b) Grafiittihiili -Rauta liuotetaan toisilla HCl:llä, toisilla HNO3:lla, jolloin grafiittihiili jää jäännökseksi. Raakaraudalle kumpikin menetelmä antaa varovaisuutta noudattaen hyviä tuloksia, mutta grafiittia sisältäville teräksille Blair suosittelee liuottamista typpihappoon. (Tämän menetelmän osalta käänny Blairin puoleen.)
Punnitaan 5 g raakarautaporausta. Liuotetaan 50 c.cs. SE. HCl:ään hellävaraisen kuumennuksen avulla. Keitetään muutama minuutti. Laimennetaan 100 c.cs. (lähes). Suodatetaan Goochin upokkaan läpi. Pestään hyvin kuumalla vedellä ja sitten kiehuvalla E. KHO:lla. (Tämä liuottaa mahdollisen SiO2:n.) Pestään uudelleen kuumalla vedellä KHO:n poistamiseksi. Kuivataan upokas ja sisältö.
Arvioidaan hiili kuten edellä polttamalla ja lasketaan prosenttiosuus tavalliseen tapaan.
(c) Yhdistetty hiili (erotuksena).- Kun kokonaishiili ja grafiittihiili ovat tiedossa, yhdistetty hiili saadaan vähentämällä grafiittihiili kokonaishiilestä.
Suorista arviointimenetelmistä saa tietoa mainituista viranomaisista.
RAUDAN & TERÄKSEN RIKIN ARVIOINTI
Raudan ja teräksen rikin parhaasta arviointimenetelmästä on huomattavia mielipide-eroja. Vanha kuningasvesiliuoksen ja BaCl2-saostuksen menetelmä on tunnustettu hyvin epätarkaksi; mutta hidas liuottaminen HNO3:een, jossa on hyvin vähän tai ei lainkaan HCl:ää, ja sen jälkeen varovainen saostaminen BaCl2:lla, kun HCl:ää on tietty määrä liikaa, ja saostuksen ajankohdan ja olosuhteiden asianmukainen huolellisuus sekä varotoimet, joilla estetään raudan aiheuttama saostuman kontaminaatio – näillä menetelmillä ja varovaisuudella on mahdollista saada hyviä tuloksia. Blair sitä vastoin suosittelee liuottamista HCl:ään, jolloin S kehittyy H2S:nä, joka imeytyy (emäksiseen) Pb(NO3)2 -liuokseen muodostaen PbS:ää, joka liuotetaan HCl:ään + KClO3:een ja S saostuu BaSO4:ksi. Muita menetelmiä ks. Blair, Stillman, Auchy, Crobaugh ja Drown. Toinen yleisesti käytetty menetelmä on S:n kehittyminen H2S:nä, minkä jälkeen se absorboidaan kadmiumkloridiliuoksessa. Saostunut kadmiumsulfidi liuotetaan HCl:ään ja S arvioidaan titraamalla jodiliuoksella, tai yleisemmin H2S imeytetään Br.-veteen ja saostetaan sitten BaSO4:ksi tai imeytetään NaOH:aan ja titrataan jodilla; tämä jälkimmäinen on suosituin menetelmä. (Ks. Blair.) Tässä esitetään seuraava menetelmä:-
Hapettaminen HNO3:lla (ns. Aqua Regia -menetelmä).-Punnitaan 5 g:n poraus ja siirretään syvään 200 c.c. dekantterilasiin. Lisätään varovasti noin 40 c.cs. 16E. HNO3:a noin 10 c.cs.:n erissä kerrallaan, peittämällä dekantterilasi suurella kellolasilla ja varoen, että vaikutus ei ole liian voimakas. Kun vaikutus näennäisesti lakkaa, todetaan, ovatko kaikki hiukkaset liuenneet (hiiltä lukuun ottamatta). Jos näin ei ole, kuumennetaan hiekkakylpyyn ja lisätään 3 tai 4 tippaa 16E:tä. HCl:ää ja lämmitetään, kunnes se on liuennut.
Kun liuos on täydellinen, lisätään hieman Na2CO3:a, jotta mahdollinen H2SO4 muuttuu Na2SO4:ksi, joka ei haihtuessaan haihtuisi.
Poistetaan hiekkakylvystä ja lisätään 5 c.cs. vahvaa HCl:aa yli sen määrän, joka riittää juuri ja juuri liuottamaan Na2CO3:n saostamat rautayhdisteet. Suodatetaan SiO2 pois ja C. Pestään hyvin. Haihdutetaan kuivaksi, jotta SiO2 ei liukene. Lisätään HCl ja haihdutetaan, kunnes Fe2Cl6 alkaa kiteytyä. Lisätään sitten 5 c.cs. HCl. ja suodatetaan, jos jäämiä on jäljellä. (Jos jäämiä ei ole, SiO2 ei ole ollut liuoksessa, ja haihdutus olisi voitu jättää tekemättä). Suodatetaan ja pestään saostuma huolellisesti Goochissa, jolloin neste ja pesuvedet nostetaan noin 100 c.cs:iin.
Lämmitetään kiehuvaksi. Lisätään 10 c.cs. kyllästettyä BaCl2-liuosta. Kiehutetaan 30 minuuttia. Annetaan seistä yön yli. Suodatetaan Goochin läpi. Pestään pienellä määrällä E. HCl:aa ja sitten vedellä. Kuivataan, sytytetään ja punnitaan tavalliseen tapaan BaSO4, jonka on oltava valkoista, eikä siinä saa olla rautasuoloja.
Lasketaan S-prosenttiosuus tavalliseen tapaan. Koska jotkin käytetyistä reagensseista voivat sisältää rikkiä, on tehtävä nollakoe, jossa käytetään samoja määriä kuin varsinaisessa analyysissä, ja mahdollinen löydetty rikki vähennetään edellisestä tuloksesta.
HIILIN MÄÄRITTÄMINEN
Tässä esitetty menetelmä on Drownin menetelmä, joka on sekä nopea että tarkka. Rauta liuotetaan HNO3:een, jonka jälkeen H2SO4:ään ja haihdutetaan kuiviin. Tämän jälkeen liuotetaan, jolloin pii jää jäännökseksi SiO2:na.
Erittelyt: – Punnitaan 2 g porauksia ja siirretään platina- tai posliiniastiaan. Lisätään 30 c.cs. 8E. HNO3 Kun vaikutus ilmeisesti lakkaa, lisätään 20 c.cs. 18E. H2SO4, ja haihdutetaan. (Blair suosittelee, että nesteen pinnalla leikitellään kevyesti kuuman ilman puhalluksella. Ilma kuumennetaan johtamalla se pienen kupariputkikierukan läpi, jota lämmitetään bunsenin päällä. Näin haihtuminen nopeutuu ja roiskuminen estyy). Haihdutusta jatketaan, kunnes haihtuu runsaasti SO3-huuruja. Jäähdytetään ja laimennetaan varovasti tislatulla vedellä 130 c.cs:ksi. Kuumennetaan, kunnes kaikki FeSO4 on liuennut. Suodatetaan ja pestään ensin pienellä määrällä E. HCl:ää ja sitten kuumalla vedellä. Suodatus onnistuu parhaiten 7 cm:n tuhkattomalla suodatinpaperilla (tuhka tarkistetaan sytyttämällä kaksi tai kolme paperia). Kuivataan; siirretään platinaupokkaaseen; sytytetään tavalliseen tapaan ja punnitaan. Lisätään upokkaaseen 5 c.cs. vahvaa H2SO4:ää ja 5 c.cs. vahvaa HF:ää. Haihdutetaan varovasti kuiviin käyttäen kuumaa ilmapuhallusta haihtumisen nopeuttamiseksi. Sytytetään ja punnitaan uudelleen. Jos H2SO4 ja HF ovat puhtaita, painoero vastaa SiO2:ta. Tarkistetaan H2SO4 ja HF (erityisesti jälkimmäinen) haihduttamalla nollakappale. Mahdolliset jäämät on otettava huomioon.
Fosforin määrittäminen
Tässäkin tapauksessa eri viranomaiset ovat antaneet lukuisia menetelmiä, joista suurin osa antaa tarkkoja tuloksia, kun niitä noudatetaan huolellisesti. Kaksi tekniseen analyysiin parhaiten soveltuvaa menetelmää ovat Yhdysvaltain kansainvälisen terässtandardikomitean (International Steel Standards Committee, U.S.A.) alakomitean (herrat Barba, Blair, Drown, Dudley ja Shimer) laatima volumetrinen reduktiomenetelmä ja muunnettu reduktiomenetelmä, jonka ovat antaneet herrat Dudley ja Pease, Jour. Anal. Appl. Chem., vii. 108. Ensin mainittua menetelmää käsitellään perusteellisesti teoksessa Blair’s Analysis of Iron; jälkimmäinen menetelmä esitetään tässä.
Rauta liuotetaan ja P saostetaan ammoniumfosfo-molybdaattina. Tämä liuotetaan, ja Zn:n ja H2SO4:n vaikutuksesta MoO3 pelkistyy, minkä jälkeen pelkistynyt neste titrataan K2Mn2O8:lla (standardiliuos), ja käytetyn c.cs.-määrän perusteella voidaan laskea P-pitoisuus.
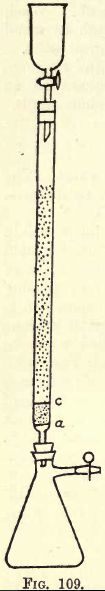
Tietoja. -Jos on tehtävä paljon työtä, tarvitaan ravistelulaite (ks. Kemikaalitarvikeluettelot). Opiskelija voi kuitenkin suorittaa tarvittavan ravistelun käsin. Ennen analyysiin siirtymistä on valmistettava pelkistyslaite (Jonesin pelkistyslaitteen muunnos) (ks. kuva 109).
Kohdassa a on hienosti rei’itetty levy, joka on valmistettu tukevasta platinfoliosta. A:n ja c:n välissä on noin ¾ tuumaa puhdasta valkoista hiekkaa, c on toinen rei’itetty platinakiekko.
Tämän kiekon yläpuolella putki täytetään hienorakeisella amalgaamoituneella sinkillä, joka valmistetaan seuraavasti:-Luota 5 gms. Hg 25 c.cs. vahvaan HNO3:een, laimennetaan vedellä ja tehdään liuoksesta 1 litra. Tähän liuokseen
kaadetaan puoli kiloa rakeistettua sinkkiä, joka läpäisee 20 mutta ei 30 seulan. Ravistellaan yksi tai kaksi minuuttia. Kaadetaan liuos pois. Pestään ja kuivataan sinkki, joka on nyt amalgaamoitunut. Suppilo ja kolvi asennetaan laitteeseen kuvan mukaisesti.
Valmistetaan seuraavat reagenssit :-
(a) K2Mn2O8:n vahvasti hapettava liuos. 12 g puhdasta K2Mn2O8:aa 1 litrassa vettä. Suodatetaan ja pullotetaan.
(b) Molybdaattiliuos.-Liuotetaan 50 gm. MoO3 200 c.cs, NH4HO (S.G. .96). Suodatetaan ja suodokseen lisätään 500 c.cs. HNO3 (S.G. 1,2). Annetaan seistä vähintään 24 tuntia ennen käyttöä.
(c) Hapan amnwniumsulfaattiliuos.-500 c.cs. tislattuun veteen lisätään 27,5 c.cs. NH4HO (S.G. 0.96) ja sitten 24 c.cs. puhdasta H2SO4 (S.G. 1.84) ja laimennetaan 1000 c.cs:ksi.
(d) Standardi K2Mn2O8-liuos.-Liuota 2 g kiteytettyä K2Mn2O8:a 1000 c.cs:aan tislattua vettä. Standardoidaan liuos seuraavasti : Punnitaan 3 erää, joista kukin on 0,1-3 g perusteellisesti puhdistettua rautalankaa, jonka rautapitoisuus tunnetaan. Siirretään 100 c.c. Erlenmeyer-kolviin ja lisätään kuhunkin 40 c.cs. 8E. H2SO4. Kun se on liuennut, keitetään 5 minuuttia; laimennetaan 150 senttimetriin ja ohjataan reduktorin läpi ja pestään, jolloin tilavuus nousee 200 senttimetriin analyysin ohjeiden mukaisesti. Jokainen erä titrataan K2Mn2O8:lla. Tulosten pitäisi olla yhdenmukaisia metallisen raudan osalta 1/100 milligramman tarkkuudella. Otetussa langassa olevat epäpuhtaudet otetaan huomioon. Oletetaan, että 1 c.c. K2Mn2O8 = 0,0034923 gm, Fe, kerrotaan tämä arvo Fe:nä MoO3:n ja Fe:n suhteella eli 0,9076 ja tuote P
:n ja MoO3:n suhteella eli 0,019, jolloin saadaan
1 c.c. K2Mn2O8 = 0,0000602 gm. P
Analyysi
Punnitaan 1 gm:n poraus. Siirretään 200 c.c. Erlenmeyer-kolviin. Lisätään 70 c.cs. 5E. HNO3. Kun liuos on täydellinen, keitetään minuutti ja lisätään 10 c.cs. ”hapettavaa” K2Mn2O8-liuosta. Kiehutetaan, kunnes vaaleanpunainen väri häviää ja MnO2 erottuu. Poistetaan ja lisätään vähitellen sekoittaen puhtaita (fosforittomia) FeSO4-kiteitä, kunnes sisältö kirkastuu. Kuumennetaan liuos 80° C:seen (jos As:aa esiintyy, 35° C:seen). Lisätään 75 c.cs. molybdaattiliuosta 27° C:n lämpötilassa. Pullo suljetaan kumitulpalla ja ravistetaan 5 minuuttia. Annetaan seistä 5 minuuttia. Sitten suodatetaan 9 cm:n suodattimen läpi, suodatetaan ja pestään happamalla ammoniumsulfaattiliuoksella, kunnes muutama tippa pesuvettä ei anna väriä ammoniumsulfidilla.
Luovutetaan paperille jäänyt sakka 5 c.cs. NH4HO:lla (S.G. 0,90) ja 25 c.cs. vedellä ja annetaan liuoksen valua takaisin alkuperäiseen kolviin, jolloin sen kylkiin mahdollisesti tarttunut sakka liukenee. Pestään, kunnes suodos ja pesuvedet ovat 150 c.cs. Lisätään 10 c.cs. vahvaa H2SO4:ää (S.G. 1.84) ja laimennetaan 200 c.cs:aan. Liuos on nyt valmis pelkistämistä varten.
Kaadetaan 100 c.cs. lämmintä ~E/2 H2SO4:ää suppiloon. Kytketään kolvi suodatinpumppuun ja avataan puristin, niin että liuos lähes, mutta ei aivan, virtaa ulos suppilosta. Lisää sitten suppiloon seuraava aihio-5 c.cs. NH4HO (S.G. 0,90), 10 c.cs. H2SO4 (S.G. 1,84) ja 50 c.cs. vettä, sekoitettuna keskenään. Avataan jälleen puristin niin, että tämä seos melkein valuu suppilosta ulos. Lisätään nyt suppiloon 200 c.cs, E/2 H2SO4, ja juoksutetaan seos melkein läpi.
Kytketään kolvi irti sulkemalla ensin suppilon sulkuhana. Titrataan pullon sisältö K2Mn2O8:lla. Yleensä näin kuluu noin 0,1 c.cs. permanganaattia, ja tämä määrä on vähennettävä tulevista lukemista.
Nyt siirretään pelkistettävä liuos suppiloon. Kiinnitetään puhdas kolvi. Kytketään ja käynnistetään suodatinpumppu. Avataan sulkuhana ja puristin, jotta liuos kulkee lähes läpi. Huuhtele liuosta sisältänyt pullo 100 c.cs:lla. E/2 H2SO4. Lisätään tämä suppiloon ja käsitellään kuten edellä.
Lisätään lopuksi ja juoksutetaan lähes läpi vielä 100 c.cs. happoa.
Suodatinkolvissa olevan pelkistetyn liuoksen pitäisi nyt olla kirkkaanvihreää.
Poistetaan kuten edellä ja titrataan permanganaattiliuoksella. Vihreä muuttuu vaaleanpunaisen ruskeaksi, sitten vaaleankeltaiseksi, sitten värittömäksi ja lopulta saadaan pysyvä vaaleanpunainen väri (minuutin seisottamisen jälkeen). Saadusta lukemasta vähennetään nollalukema ja lasketaan läsnä olevan P:n prosenttiosuus edellä annetuista tiedoista.
Tämän volumetrisen menetelmän sijasta jotkut kemistit punnitsevat mieluummin suoraan keltaisen fosfo-molybdaattisakan. Ks. tarkemmin Blair’s Analysis of Iron, s. 108.
Huom.-Opiskelijan on mahdollisuuksien mukaan hyödynnettävä viitteitä erityisiin auktoriteetteihin. Tähän mennessä hänen pitäisi pystyä tutustumaan tällaiseen aineistoon, vertailemaan sitä ja jossain määrin käyttämään sitä harkitusti. Mikään yksittäinen oppikirja ei voi antaa kattavaa käsittelyä ”raudasta ja teräksistä” tai mistään tässä jaksossa käsitellyistä aiheista; siksi analyytikon, joka haluaa kunnostautua teknisessä työssä, on tutustuttava huolellisesti annettuihin viitteisiin ja ajankohtaiseen kirjallisuuteen. Yhdistetyn hiilen kolorimetrinen määritys Eggertzin menetelmällä on annettu ; mangaani voidaan määrittää jokseenkin samalla tavalla Peterin kolorimetrisellä menetelmällä tai asetaattimenetelmällä (ks. Blair jne.).