Les pyroxènes constituent le groupe le plus important et le plus abondant de silicates ferromagnésiens formant des roches. Ils sont présents dans presque toutes les variétés de roches ignées et se retrouvent dans des roches de compositions très différentes formées dans des conditions de métamorphisme régional et de contact. Le nom de pyroxène est dérivé du grec pyro, qui signifie « feu », et xenos, qui signifie « étranger », et a été donné par Haüy aux cristaux verdâtres trouvés dans de nombreuses laves, qu’il considérait comme ayant été inclus là accidentellement.
La composition chimique des minéraux du groupe pyroxène peut être exprimée par la formule générale :
XYZ2O6
dans laquelle X = Na+, Ca2+, Mn2+, Fe2+, Mg2+, Li+ ; Y = Mn2+, Fe2+, Mg2+, Fe3+, Al3+, Cr3+, Ti4+ ; et Z= Si4+, Al3+. La gamme des substitutions chimiques possibles dans le pyroxène est limitée par la taille des sites disponibles dans la structure et la charge des cations de substitution. Les sites des cations X sont en général plus grands que ceux des cations Y. Une substitution atomique étendue se produit entre les compositions idéales des membres finaux. La plupart des pyroxènes ne présentent qu’une substitution limitée de l’aluminium au silicium dans le site Z (tétraédrique). Lorsqu’un ion substituant diffère en charge, la neutralité électrique est maintenue par des substitutions couplées. Par exemple, la paire constituée de Na+ et Al3+ se substitue à 2Mg2+.
Les pyroxènes les plus courants peuvent être représentés comme faisant partie du système chimique CaSiO3 (wollastonite, un pyroxénoïde), MgSiO3 (enstatite), et FeSiO3 (ferrosilite). (Fig.1). Comme il n’existe pas de vrais pyroxènes dont la teneur en calcium est supérieure à celle de la jointure diopside-hedenbergite, la partie de ce système située en dessous de cette jointure est connue sous le nom de quadrilatère pyroxène.
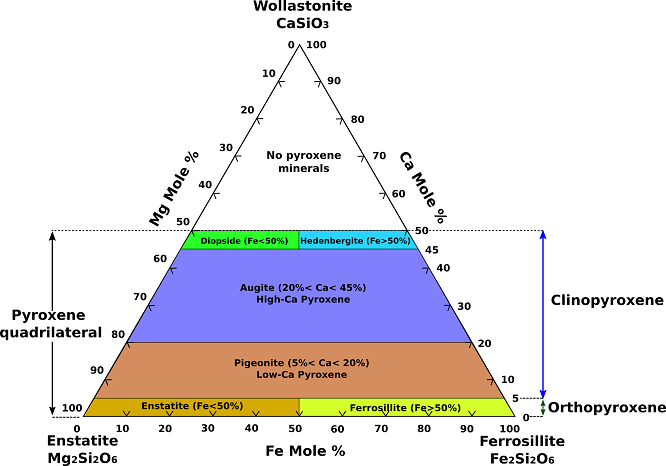
Fig.1Diagramme de composition ternaire des pyroxènes.
Une substitution complète existe entre l’enstatite (Mg2Si2O6) et la ferrosilite (Fe2Si2O6), et une solution solide complète de fer pour le magnésium existe entre le diopside (CaMgSi2O6) et l’hedenbergite (CaFeSi2O6). L’augite, l’augite subcalcique et la pigeonite se trouvent à l’intérieur du quadrilatère pyroxénique. Au niveau de la composition, l’augite est apparentée aux membres de la série diopside-hedenbergite avec une substitution limitée de Na+ pour Ca2+, Al3+ pour Mg2+ et Fe2+, et Al3+ pour Si4+ dans le site Z (tétraédrique). Les augites contenant une quantité importante d’aluminium ou de sodium ne peuvent pas être représentées strictement dans le plan quadrilatéral. La pigeonite monoclinique englobe un champ de solution solide magnésium-fer avec une teneur en calcium légèrement plus élevée que la série orthorhombique enstatite-orthoferrosilite.
Les substitutions couplées impliquant Na+, Li+ ou Al3+ pour Mg2+ dans la structure enstatite donnent des pyroxènes qui se trouvent en dehors du champ de composition quadrilatéral. La substitution couplée de Na+ et Al3+ pour 2Mg2+ dans l’enstatite produit le pyroxène jadéite. La substitution couplée de Na+ et Fe3+ pour 2Mg2+ produit le pyroxène aegirine (acmite). La substitution de 2Mg2+ par Li+ et Al3+ donne le spodumène. La substitution de Al3+ pour Mg2+ et de Al3+ pour Si4+ donne le composant idéal de la tschermakite MgAlSiAlO6. D’autres pyroxènes moins courants dont la composition se situe en dehors du quadrilatère des pyroxènes comprennent la johannsenite et le kosmochlor (uréyite). La johannsenite implique la substitution du manganèse au fer dans l’hedenbergite. Le kosmochlor a du chrome (Cr) à la place du fer ou de l’aluminium dans un pyroxène sodique.
À des températures élevées, les pyroxènes ont des champs de solution solide plus étendus qu’à des températures plus basses. Par conséquent, lorsque les températures diminuent, le pyroxène ajuste sa composition à l’état solide en exsolvant une phase séparée sous forme de lamelles à l’intérieur du grain de pyroxène hôte. Les lamelles sont exsolues le long de directions cristallographiques spécifiques, produisant des intercroissances orientées avec une texture parallèle et en chevrons. Il existe cinq combinaisons principales de paires d’exsolution : (1) l’augite avec des lamelles d’enstatite, (2) l’augite avec des lamelles de pigeonite, (3) l’augite avec des lamelles de pigeonite et d’enstatite, (4) la pigeonite avec des lamelles d’augite, et (5) l’enstatite avec des lamelles d’augite.
Les pyroxènes diffèrent en composition des amphiboles sur deux points majeurs. Les pyroxènes ne contiennent pas d’eau essentielle sous forme d’hydroxyles dans leur structure, alors que les amphiboles sont considérées comme des silicates hydratés. La deuxième différence chimique clé entre les deux est la présence du site A dans les amphiboles qui contient les grands éléments alcalins, typiquement le sodium et parfois le potassium ; les pyroxènes n’ont pas de site équivalent pouvant accueillir le potassium.
Structure
Le groupe des pyroxènes comprend des minéraux qui se forment à la fois dans les systèmes cristallins orthorhombique et monoclinique. Les pyroxènes orthorhombiques sont appelés orthopyroxènes, et les pyroxènes monocliniques sont appelés clinopyroxènes. La caractéristique essentielle de toutes les structures pyroxéniques est la liaison des tétraèdres silicium-oxygène (SiO4) par le partage de deux des quatre coins pour former des chaînes continues. Les chaînes, qui s’étendent indéfiniment parallèlement à l’axe cristallographique c, ont la composition de (Si2O6) (Fig.2). Une distance de répétition d’environ 5,3 Å sur la longueur de la chaîne définit l’axe c de la cellule unitaire. Les chaînes Si2O6 sont liées à une couche de bandes cationiques à coordination octaédrique qui s’étendent également parallèlement à l’axe c.
.png)
Fig.2 : schéma de la structure du pyroxène à chaîne unique. Lorsque deux tétraèdres se touchent, ils partagent un ion oxygène. De Wikipédia
Les bandes octaédriques sont constituées d’octaèdres M1 et M2 pris en sandwich entre deux chaînes tétraédriques de direction opposée. Les sites M1 sont occupés par des cations plus petits comme le magnésium, le fer, l’aluminium et le manganèse, qui sont coordonnés à six atomes d’oxygène pour former un octaèdre régulier. Dans les pyroxènes monocliniques, le site M2 est un grand polyèdre irrégulier occupé par les plus grands cations calcium et sodium qui sont en coordination octuple. Dans les pyroxènes orthorhombiques à faible teneur en calcium, M2 contient du magnésium et du fer, et le polyèdre prend une forme octaédrique plus régulière. La bande de cations M1 est liée aux atomes d’oxygène de deux chaînes tétraédriques à orientation opposée (Fig.3). Ensemble, elles forment une bande tétraédrique-octaédrique-tétraédrique (t-o-t). Une projection schématique de la structure du pyroxène perpendiculaire à l’axe c et la relation entre le clivage du pyroxène et les bandes t-o-t ou poutres en I est présentée à la Fig.3.
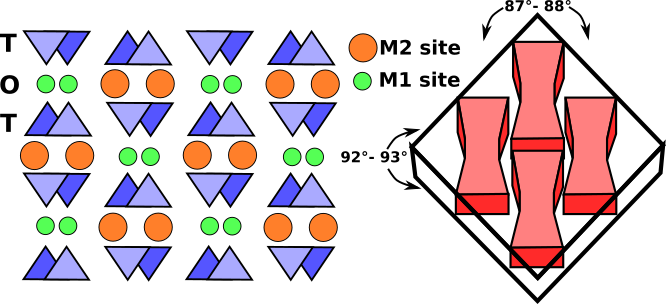
Fig.3 : Projection schématique de la structure monoclinique du pyroxène perpendiculaire à l’axe c. Les bandes T-O-T, appelées poutres en I, ont des liaisons très fortes qui résistent à la rupture et produisent le clivage typique à près de 90° des pyroxènes (lignes pointillées).
En coupes fines, les pyroxènes monocliniques se distinguent par deux directions de clivage à environ 87° et 93°, des sections transversales basales à huit côtés et une couleur brun clair ou verte. Les pyroxènes orthorhombiques diffèrent des pyroxènes monocliniques par leur extinction parallèle.
Bibliographie
– Cox et al. (1979) : The Interpretation of Igneous Rocks, George Allen and Unwin, London.
– Howie, R. A., Zussman, J., & Deer, W. (1992). Une introduction aux minéraux formant des roches (p. 696). Longman.
– Le Maitre, R. W., Streckeisen, A., Zanettin, B., Le Bas, M. J., Bonin, B., Bateman, P., & Lameyre, J. (2002). Les roches ignées. A classification and glossary of terms, 2. Cambridge University Press.
– Middlemost, E. A. (1986). Magmas et roches magmatiques : une introduction à la pétrologie ignée.
– Shelley, D. (1993). Les roches ignées et métamorphiques sous le microscope : classification, textures, microstructures et orientations préférentielles des minéraux.
– Vernon, R. H. & Clarke, G. L. (2008) : Principes de la pétrologie métamorphique. Cambridge University Press.