Celula din care iese ramura este celula piciorului conidioforului, care se distinge de alte celule vegetative prin faptul că are un perete secundar pigmentat maroniu care se îngroașă pe partea interioară a peretelui său original. Tulpina crește apical până când ajunge la o lungime de aproximativ 100 µm, când vârful se umflă pentru a forma vezicula conidioforului care are un diametru de aproximativ 10 µm. Un singur rând de numeroase sterigmate primare, numite metulae, răsar apoi din veziculă, iar sterigmate secundare, fialidele, răsar din apicele expuse ale metulae. Fialidele sunt celulele stem care ulterior suferă diviziuni asimetrice repetate pentru a forma lanțuri lungi de conidii enteroblastice cu un diametru de aproximativ 3 µm (Fig. 7).
Analiza genetică clasică, prin izolarea și analiza mutanților, a stabilit schema genetică de bază a conidierii Aspergillus. S-a estimat că între 300 și 1.000 de loci genetici sunt implicați în conidierea prin compararea frecvențelor de mutație la loci care afectează conidierea cu cele pentru alte funcții (Martinelli & Clutterbuck, 1971). Analiza speciilor de ARNm a indicat că aproximativ 6.000 au fost exprimate în miceliul vegetativ și încă 1.200 au fost găsite în culturile care au inclus conidiofori și conidii; 200 dintre aceste ARNm suplimentare au fost găsite în conidii. Doar aproximativ 2 % dintre mutanții de A. nidulans care nu aveau conidii prezentau defecte în etapele legate de creșterea și dezvoltarea conidioforilor, iar 85 % dintre mutanții de conidii prezentau, de asemenea, defecte în creșterea hifelor vegetative și în obținerea competenței.
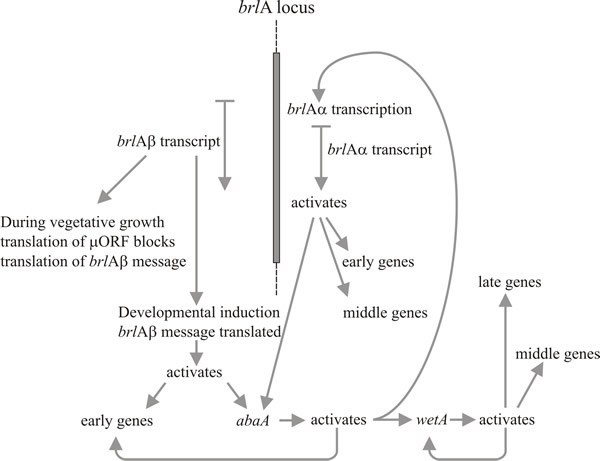
Două gene, în special, joacă un rol cheie în morfogeneza conidioforului: acestea sunt gena „bristle” (brlA), care are defecte în formarea veziculelor și a metulei, și „abacus” (abaA), în care conidiile sunt înlocuite de lungimi de hifă în formă de fagure, astfel încât se presupune că este defectă în înmugurirea conidiului din fiolă și în septarea finală. O a treia genă, wetA, este defectă într-o etapă timpurie a maturării sporilor. Conidiile mutanților wetA sunt lipsite de pigment și de hidrofobie; acestea se autolizează după câteva ore și nu reușesc să exprime o serie de ARNm specifici sporilor. Transcriptul genei wetA lipsește la mutanții brlA și abaA (adică brlA și abaA sunt epistatice față de wetA), iar studiile asupra mutanților dubli arată că aceste trei gene acționează în ordinea: brlA → abaA → wetA.
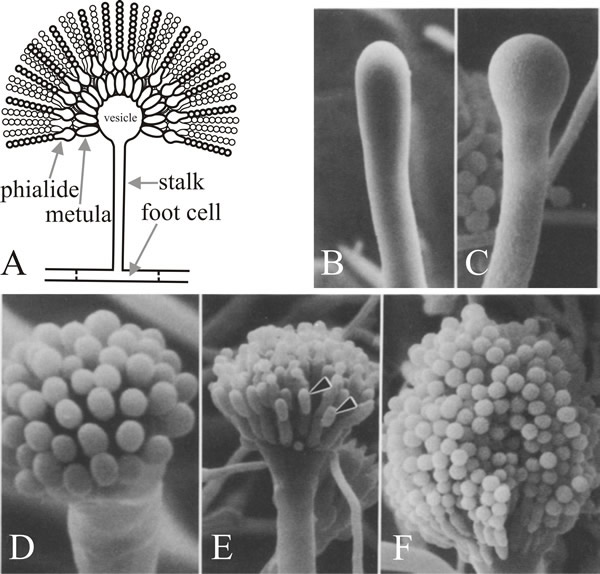
O caracteristică frapantă a analizei mutaționale a dezvoltării conidioforului la A. nidulans este că mutanții doar ai acestor trei gene cauzează defecte în morfogeneza conidioforului și a sporilor, în timp ce până la 1.000 de alți loci genetici cauzează absența conidierii atunci când sunt mutați. Acest lucru implică faptul că brlA, abaA și wetA sunt regulatori care integrează expresia altor gene care sunt necesare pentru conidiație, dar care nu sunt ele însele dedicate acesteia. Mulți dintre mutanții Aspergillus de conidiere au fost, de asemenea, defectuoși în ceea ce privește reproducerea sexuală, astfel încât o altă concluzie care poate fi trasă este că există o anumită economie de utilizare a genelor morfogenetice în diferite procese de dezvoltare. Se presupune că diferitele moduri de dezvoltare utilizează gene structurale care nu sunt exclusiv de dezvoltare, ci funcționează în numeroase căi, având specificitatea lor de dezvoltare conferită de regulatorii la care răspund. Acest lucru este întruchipat în ideea că cheia dezvoltării eucariote constă în capacitatea de a utiliza un număr relativ mic de gene de reglare pentru a integra activitățile multor altora.
Analiza moleculară susține interpretarea că brlA, abaA și wetA sunt regulatori; secvența brlA codifică o proteină cu deget de zinc, care este un activator de transcripție cu legare la ADN, specific secvenței, al genelor țintă reglementate de dezvoltare (Fig. 8). Totuși, aceasta nu este întreaga poveste, deoarece produsul brlA are afinități diferite pentru diferite gene țintă. Într-adevăr, locusul brlA constă din unități de transcripție suprapuse (Fig. 9), unitatea din aval fiind desemnată brlAα și unitatea din amonte brlAβ; între ele, produsele lor rezolvă două probleme clasice de dezvoltare, cum să răspundă la un semnal și cum să mențină acest răspuns atunci când semnalul s-a disipat.
Cele două unități de transcripție brlA împart același cadru de citire pe cea mai mare parte a lungimii lor, dar brlAβ are 23 de reziduuri de aminoacizi în plus la capătul amino-terminal al acelui cadru de citire, iar transcripția sa posedă, de asemenea, un cadru de citire separat de 41 de reziduuri de aminoacizi (numit µORF) în apropierea extremității sale 5′. Produsul µORF reprimă traducerea din cadrul de citire din aval (BrlA) și, chiar dacă transcrierea brlAβ poate fi detectată în hifele vegetative, peptida BrlA nu este produsă. Represiunea cauzată de µORF este depășită numai atunci când miceliul este competent, ceea ce este probabil semnalat ca o limitare a azotului (un semnal de mediu comun pentru inițierea sporulației la Ascomycota), care reduce rezervele de aminoacil-ARNt și perturbă reglarea translațională de către µORF. Atunci când efectul µORF este blocat, peptida BrlA poate fi tradusă din transcriptul existent.
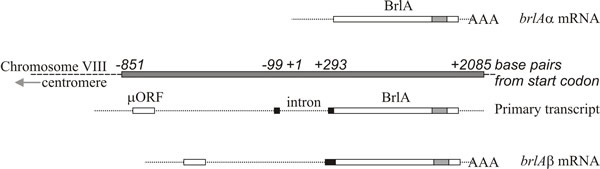
Descoperitorul acestui proces a descris activarea căii de conidiere ca „declanșare translațională” (Timberlake, 1993), sugerând că declanșarea translațională este o modalitate de a face diferențierea sensibilă la starea de nutriție a hifei. Astfel, hifă competentă este pregătită să se dezvolte conidiofori, dar activarea ireversibilă a căii de conidiere este împiedicată de o reprimare translațională care menține creșterea vegetativă până când condițiile de sporulare sunt ideale.
Activarea brlA este, prin urmare, văzută ca fiind primul pas în dezvoltarea conidioforului, iar produsul său, la rândul său, activează un panou de gene specifice conidierii, printre care se numără următorul regulator, abaA. Produsul abaA este, de asemenea, o proteină regulatoare transcripțională care se leagă de ADN și care sporește expresia genelor structurale induse de brlA. Genele brlA și abaA sunt activatori reciproci, deoarece abaA activează și brlA. Desigur, expresia brlA trebuie să aibă loc înainte ca abaA să poată fi exprimată, dar activarea abaA a brlA ca urmare a acesteia din urmă întărește expresia celei din urmă și face ca progresul căii să fie independent de evenimente exterioare. Produsul abaA activează, de asemenea, gene structurale suplimentare și gena reglatoare finală, wetA, care activează gene structurale specifice sporilor. Deoarece brlA și abaA nu sunt exprimate în conidiile în diferențiere, wetA este probabil implicată în inactivarea expresiei lor în spori (și poate și în fialidă; pe măsură ce nucleul actual al sporului atinge stadiul de maturare care are nevoie de genele reglate de wetA, nucleele fialidei trebuie să fie „întoarse” la starea de inițiere a conidiului pentru a începe formarea următorului spor). Expresia genei wetA este activată inițial în fialidă prin acțiunea secvențială a brlA și abaA, iar apoi este autoreglementată (produsul wetA activează transcripția wetA). Autoreglarea pozitivă a wetA menține ulterior expresia acesteia după ce conidiul a fost separat (fizic și citologic) de fialidă.
Timberlake (1993) a numit acest mecanism fixare prin feedback: activarea reciprocă, activarea prin feedback și autoreglarea secvențelor reglatoare de bază consolidează expresia întregii căi, făcând-o independentă de indicii de mediu externi care au inițiat-o și permițând sporului să continue maturarea chiar și după separarea de fialidă. Dezvoltarea conidioforului, ca multe alte procese morfogenetice, este împărțită în mod natural în etape secvențiale. Această rețea de reglementare arată modul în care declanșarea translațională poate lega o cale morfogenetică de dezvoltarea competenței, pe de o parte, și de inițierea ca răspuns la indicii de mediu, pe de altă parte. Ulterior inițierii, fixarea feedback-ului are ca rezultat determinarea dezvoltării în sensul embrionar clasic al continuării morfogenezei chiar și atunci când este îndepărtată de mediul de inițiere.
Am ales în mod deliberat în această secțiune să ne bazăm descrierea pe cercetările efectuate cu aproximativ 50 de ani în urmă, care au început cu izolarea unui număr mare de mutații cu fenotipuri de conidiere modificate și au continuat cu studii „clasice” ale segregării și completării genelor (Martinelli & Clutterbuck, 1971). Pe lângă faptul că arată modul în care s-a realizat înțelegerea noastră a sporulației, aceasta demonstrează valoarea utilizării acestor tehnici „de modă veche” pentru a investiga astfel de fenomene.
Nu putem însă ignora cercetările extinse care au fost finalizate în ceea ce privește mecanismele moleculare care stau la baza creșterii și dezvoltării lui Aspergillus. Aceste studii au confirmat faptul că evenimentul cheie în sporulație este activarea factorului de transcripție cu deget de zinc codificat de brlA și că genele abaA și wetA sunt regulatori necesari ai conidierii. Factorul de transcripție codificat de abaA este activat de brlA după diferențierea metulei și în timpul etapelor medii de dezvoltare a conidioforului; iar gena wetA, activată de abaA, funcționează în faza târzie a conidierii, dirijând sinteza componentelor esențiale ale peretelui celular și transformând metabolismul conidului în curs de maturare. La Aspergillus nidulans, aceste trei gene creează calea centrală de reglare, care, împreună cu alte gene, controlează expresia genelor specifice conidiației și secvența de activare a genelor implicate în dobândirea competenței de dezvoltare, dezvoltarea conidioforului și maturarea sporilor (Lee et al., 2016).
Multe aspecte ale acestor căi de dezvoltare au fost conservate la alți aspergili. Membrii genului Aspergillus se numără printre cele mai des întâlnite ciuperci și toți se reproduc asexuat prin formarea unor lanțuri lungi de conidii. Mai multe specii, inclusiv Aspergillus oryzae și Aspergillus niger, sunt utilizate în industrie pentru producția de enzime și pentru prelucrarea alimentelor; în timp ce Aspergillus flavus este responsabil pentru deteriorarea alimentelor prin producerea celor mai puternice substanțe cancerigene naturale cunoscute, aflatoxinele. O altă specie îngrijorătoare este agentul patogen oportunist pentru om Aspergillus fumigatus, care produce un număr masiv de conidii hidrofobe mici ca principal mijloc de dispersie și care a devenit un agent patogen fungic aeropurtat foarte răspândit în țările dezvoltate. La pacienții imunocompromiși, A. fumigatus provoacă o aspergiloză invazivă care are o rată mare de mortalitate. Calea de semnalizare a dezvoltării BrlA-AbaA-WetA a fost conservată în conidierea acestor specii de Aspergillus (Yu, 2010; Tao & Yu, 2011; Krijgsheld et al., 2013). Mai mult, studiile proteomice, transcriptomice și metabolomice au oferit o imagine detaliată a modificărilor dinamice care au loc în mai multe mii de gene, transcripte, enzime și reacții metabolice în timpul formării, maturizării, latenței și germinării conidiilor de Aspergillus (van Leeuwen et al., 2013; Novodvorska et al., 2016; Teertstra et al., 2017).
Updated July, 2019
(Actualizat în iulie 2019)