Energiile de ionizare ale elementelor din blocurile s și p
Energia de ionizare a elementelor din al treilea rând al tabelului periodic prezintă același model ca și cele ale elementelor \(Li\) și \(Be\) (Tabelul \(\PageIndex{2}\)): energiile de ionizare succesive cresc în mod constant pe măsură ce electronii sunt eliminați din orbitalii de valență (3s sau 3p, în acest caz), urmate de o creștere deosebit de mare a energiei de ionizare atunci când electronii sunt eliminați din nivelurile de nucleu pline, așa cum indică linia diagonală îngroșată din tabelul \(\PageIndex{2}\). Astfel, în al treilea rând al tabelului periodic, cea mai mare creștere a energiei de ionizare corespunde eliminării celui de-al patrulea electron din \(Al\), a celui de-al cincilea electron din Si și așa mai departe – adică eliminarea unui electron dintr-un ion care are configurația electronică de valență a gazului nobil precedent. Acest model explică de ce chimia elementelor implică în mod normal numai electroni de valență. Este nevoie de prea multă energie fie pentru a elimina, fie pentru a împărți electronii interiori.
| Element | \(I_1\) | \(I_2\) | \(I_3\) | \(I_3\) | \(I_4\) | \(I_5\) | \(I_6\) | \(I_7\) | ||
|---|---|---|---|---|---|---|---|---|---|---|
| *Inner-electron înveliș interior | ||||||||||
| Na | 495.8 | 4562,4* | – | – | – | – | – | – | – | |
| Mg | 737.7 | 1450.7 | 7732.7 | – | – | – | – | – | – | |
| Al | 577.4.4 | 1816.7 | 2744.8 | 11,577.4.4 | – | – | – | |||
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16,090.6 | – | – | |||
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – | |||
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4,3 | |||
| Cl | 1251,2 | 2297,7 | 3822 | 5158.6 | 6540 | 9362 | 11.018,2 | |||
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 | |||
Exemplu \(\PageIndex{1}\): Cea mai mare energie de ionizare a patra
Din poziția lor în tabelul periodic, preziceți care dintre aceste elemente are cea mai mare energie de ionizare a patra: B, C sau N.
Date: trei elemente
Se cere: elementul cu cea mai mare energie de ionizare a patra
Strategie:
- Enumerați configurația electronică a fiecărui element.
- Determinați dacă electronii sunt eliminați dintr-un înveliș de valență plin sau parțial plin. Precizați ce element are cea mai mare energie de ionizare a patra, recunoscând că cea mai mare energie corespunde eliminării de electroni dintr-un nucleu electronic plin.
Soluție:
A Aceste elemente se află toate în al doilea rând al tabelului periodic și au următoarele configurații electronice:
- B: 2s22p1
- C: 2s22p2
- N: 2s22p2
- N: 2s22p3
B A patra energie de ionizare a unui element (\(I_4\)) este definită ca fiind energia necesară pentru îndepărtarea celui de-al patrulea electron:
\
Pentru că carbonul și azotul au patru și, respectiv, cinci electroni de valență, a patra lor energie de ionizare corespunde îndepărtării unui electron dintr-un înveliș de valență parțial umplut. Cu toate acestea, a patra energie de ionizare pentru bor corespunde eliminării unui electron din subshell-ul 1s2 plin. Acest lucru ar trebui să necesite mult mai multă energie. Valorile reale sunt după cum urmează: B, 25,026 kJ/mol; C, 6223 kJ/mol; și N, 7475 kJ/mol.
Exercițiu \(\PageIndex{1}\): Cea mai mică energie de ionizare secundară
Din poziția lor în tabelul periodic, preziceți care dintre aceste elemente are cea mai mică energie de ionizare secundară: Sr, Rb sau Ar.
Răspuns
\(\ce{Sr}\)
Prima coloană de date din tabelul \(\PageIndex{2}\) arată că primele energii de ionizare tind să crească de-a lungul celui de-al treilea rând al tabelului periodic. Acest lucru se datorează faptului că electronii de valență nu se ecranează foarte bine între ei, permițând încărcăturii nucleare efective să crească în mod constant de-a lungul rândului. Prin urmare, electronii de valență sunt atrași mai puternic de nucleu, astfel încât dimensiunile atomice scad și energiile de ionizare cresc. Aceste efecte reprezintă două fețe ale aceleiași monede: interacțiunile electrostatice mai puternice dintre electroni și nucleu cresc și mai mult energia necesară pentru îndepărtarea electronilor.
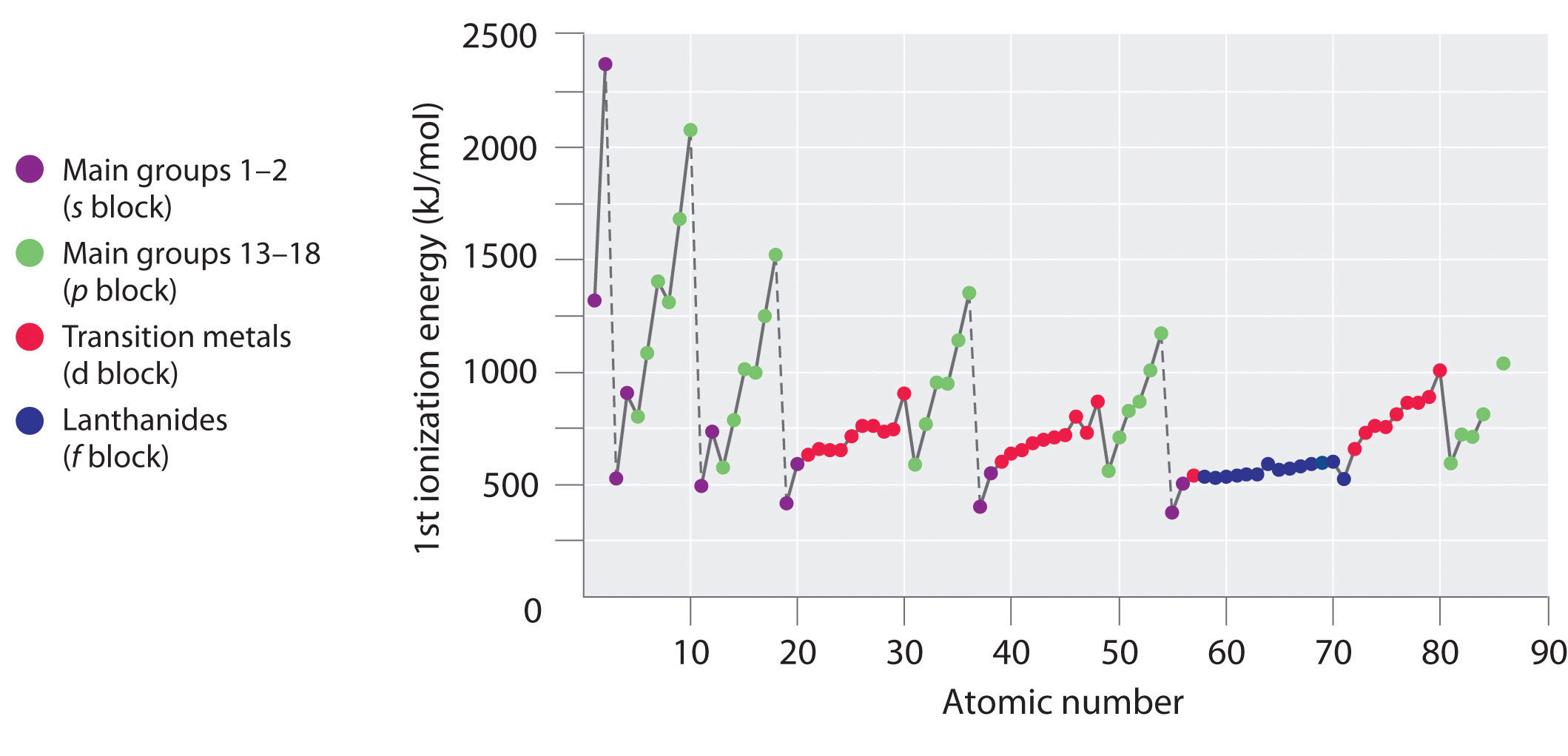
Cu toate acestea, prima energie de ionizare scade la Al (3s23p1) și la S (3s23p4). Configurațiile electronice ale acestor „excepții” oferă răspunsul de ce. Electronii din subshell-ul plin 3s2 al aluminiului sunt mai buni la ecranarea electronului 3p1 decât la ecranarea reciprocă față de sarcina nucleară, astfel încât electronii s pătrund mai aproape de nucleu decât electronul p, iar electronul p este mai ușor de îndepărtat. Diminuarea la S se produce deoarece cei doi electroni din același orbital p se resping reciproc. Acest lucru face ca atomul S să fie puțin mai puțin stabil decât ar fi de așteptat, așa cum este cazul tuturor elementelor din grupa 16.
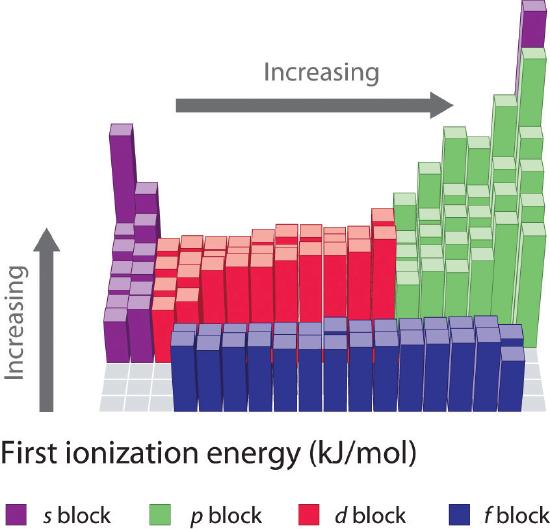
Primile energii de ionizare ale elementelor din primele șase rânduri ale tabelului periodic sunt reprezentate grafic în figura \(\PageIndex{1}\) și sunt prezentate numeric și grafic în figura \(\PageIndex{2}\). Aceste figuri ilustrează trei tendințe importante:
- Schimbările observate în al doilea (de la Li la Ne), al patrulea (de la K la Kr), al cincilea (de la Rb la Xe) și al șaselea rând (de la Cs la Rn) din blocurile s și p urmează un tipar similar cu cel descris pentru al treilea rând al tabelului periodic. Cu toate acestea, metalele de tranziție sunt incluse în al patrulea, al cincilea și al șaselea rând, iar lantanidele sunt incluse în al șaselea rând. Primele energii de ionizare ale metalelor de tranziție sunt oarecum similare între ele, la fel ca și cele ale lantanidelor. Energiile de ionizare cresc de la stânga la dreapta pe fiecare rând, cu discrepanțe care apar la ns2np1 (grupa 13), ns2np4 (grupa 16) și ns2(n – 1)d10 (grupa 12).
- Primele energii de ionizare scad, în general, în josul unei coloane. Deși numărul cuantic principal n crește în josul unei coloane, învelișurile interioare pline sunt eficiente în ecranarea electronilor de valență, astfel încât există o creștere relativ mică a sarcinii nucleare efective. În consecință, atomii devin mai mari pe măsură ce capătă electroni. Electronii de valență care sunt mai departe de nucleu sunt mai puțin strâns legați, ceea ce îi face mai ușor de îndepărtat, ceea ce face ca energiile de ionizare să scadă. O rază mai mare corespunde, de obicei, unei energii de ionizare mai mici.
- Din cauza primelor două tendințe, elementele care formează cel mai ușor ioni pozitivi (au cele mai mici energii de ionizare) se află în colțul din stânga jos al tabelului periodic, în timp ce cele care sunt cel mai greu de ionizat se află în colțul din dreapta sus al tabelului periodic. În consecință, energiile de ionizare cresc, în general, pe diagonală, din stânga jos (Cs) în dreapta sus (He).

În general, \(I_1\) crește pe diagonală din stânga jos a tabelului periodic spre dreapta sus.
Galiul (Ga), care este primul element care urmează primul rând de metale de tranziție, are următoarea configurație electronică: 4s23d104p1. Prima sa energie de ionizare este semnificativ mai mică decât cea a elementului imediat precedent, zincul, deoarece subshell-ul plin 3d10 al galiului se află în interiorul subshell-ului 4p, protejând electronul unic 4p de nucleu. Experimentele au dezvăluit un lucru și mai interesant: al doilea și al treilea electron care sunt eliminați atunci când galiul este ionizat provin din orbitalul 4s2, nu din subshell-ul 3d10. Chimia galiului este dominată de ionul Ga3+ rezultat, cu configurația sa electronică 3d10. Această configurație electronică și alte configurații electronice similare sunt deosebit de stabile și sunt des întâlnite în elementele mai grele din blocul p. Acestea sunt uneori denumite configurații de gaze pseudo-nobile. De fapt, pentru elementele care prezintă aceste configurații, nu se cunosc compuși chimici în care electronii să fie eliminați din subshell-ul umplut cu (n – 1)d10.
.