Particule subatomice
Toate elementele sunt compuse din particule extrem de mici de materie numite atomi. Putem defini un atom ca fiind cea mai simplă particulă a unui element care are proprietățile chimice ale acelui element. Proprietățile chimice includ starea fizică a elementului (gaz, lichid sau solid), tipurile de legături pe care le poate forma elementul, modul în care acesta reacționează cu alte elemente etc. Prin urmare, toți atomii care alcătuiesc elementul carbon au aceleași proprietăți chimice.
Fizicienii au reușit să spargă atomii în zeci de particule subatomice diferite, cu toate acestea, doar 3 dintre ele sunt stabile. Acestea sunt protonii, neutronii și electronii. Protonii sunt particule încărcate pozitiv, au masă și sunt localizați în centrul, sau nucleul atomului. Neutronii nu au sarcină, au masă și sunt, de asemenea, localizați în nucleul atomului. Neutronii se leagă de protoni într-un mod care ajută la stabilizarea nucleului. Prea mulți sau prea puțini neutroni pot avea ca rezultat un nucleu atomic care este instabil și care se poate dezintegra pentru a forma alte elemente. Ne referim la acești atomi ca fiind radioactivi. Deși masa neutronului este puțin mai mare decât cea a unui proton, le putem atribui amândurora masa relativă de 1 (1 unitate de masă atomică sau amu). Neutronii și protonii constituie aproape întreaga masă a unui atom. Al treilea tip de particulă stabilă este electronul. Electronii au o sarcină negativă, dar sunt extrem de mici și au o masă de numai 1/1850 din cea a unui proton sau neutron. Aceștia sunt atât de mici încât, în scopuri practice, nu contribuie la masa atomului. Electronii se deplasează în jurul nucleului la viteze extrem de mari, călătorind de fapt cu o viteză apropiată de cea a luminii. Deși deseori descriem electronii ca locuind pe orbite care înconjoară nucleul, precum planetele care orbitează în jurul soarelui, fizica modernă ne învață că acest model este incorect. Aceste „orbite” sunt de fapt zone din spațiul din jurul nucleului în care electronii se vor afla în cea mai mare parte a timpului. Această zonă este adesea denumită „nor” de electroni. Este adevărat, este încă o zonă specifică, dar este un pic mai amorfă decât o orbită sferică. Totuși, pentru simplitate, ne gândim adesea la acestea ca la niște orbitale circulare asemănătoare unor sateliți. Imaginea de mai jos reprezintă modelul nostru actual al unui atom de azot.
Nucleul de azot conține 7 protoni (portocaliu) și 7 neutroni (verde). Zonele umbrite din jurul nucleului reprezintă orbitalii electronilor (nori). Electronii (albastru) se vor găsi undeva în cadrul acestor orbitali. (Notă: imaginea nu este desenată la scară. S-a sugerat că, dacă nucleul ar avea dimensiunea unei mingi de baschet, electronii s-ar afla la o distanță de aproximativ șase kilometri sau 3¾ mile!)
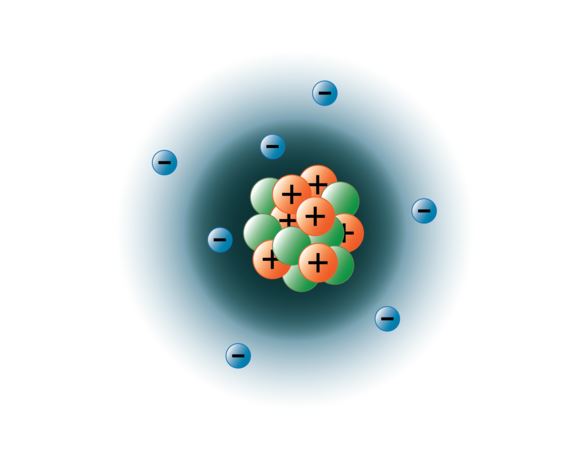
imagine creată de studenta BYU-I Hannah Crowder Toamna 2013
Numărul atomic
Uitați-vă din nou la tabelul periodic și observați numărul din partea de sus a fiecărei căsuțe. Acest număr este numărul atomic pentru elementul respectiv și este unic pentru fiecare element diferit. De exemplu, numărul atomic pentru hidrogen este 1. Niciun alt element nu are un număr atomic de 1. Pentru carbon, numărul atomic este 6 și, din nou, niciun alt element nu are un număr atomic de 6. Semnificația numărului atomic este că ne spune numărul de protoni din nucleul fiecărui element. Prin urmare, toți atomii de hidrogen au 1 proton și toți atomii de carbon au 6 protoni. În plus, deoarece atomii au o sarcină neutră, numărul atomic ne indică și numărul de electroni din atom. În notația chimică, numărul atomic al unui element este exprimat sub forma unui indice care precede simbolul elementului. De exemplu, carbonul ar fi exprimat ca 6C.
Numărul de masă (masa atomică)
Numărul de masă al unui atom, așa cum îi spune și numele, indică masa totală a atomului. Deoarece masa unui electron este extrem de mică (neglijabilă), aceasta nu este utilizată la calcularea numărului de masă. De asemenea, reamintim că masa fiecărui proton, precum și a fiecărui neutron este de 1 unitate de masă atomică. Prin urmare, numărul de masă este reprezentat de suma protonilor și neutronilor din atom. Deoarece numărul de masă este numărul de protoni plus numărul de neutroni, iar numărul atomic este numărul de protoni, puteți afla numărul de neutroni prin simpla scădere a numărului atomic din numărul de masă. Ca exemplu, să presupunem că avem un element cu un număr atomic de 8 și un număr de masă de 17. Din aceste informații puteți deduce că acest element are 8 protoni, 8 electroni și 9 neutroni (17-8=9). Acum dați-mi voie să vă arunc o minge curbă. După cum am menționat mai sus, toți atomii unui anumit element au același număr de protoni (număr atomic), însă diferiți atomi ai unui anumit element pot avea numere diferite de neutroni. Spunem că aceștia sunt izotopi diferiți ai elementului respectiv. De exemplu, există trei izotopi ai hidrogenului. Cel mai comun izotop, care cuprinde 99,98% din toți atomii de hidrogen, are un număr de masă de 1. Prin urmare, este compus din 1 proton, niciun neutron și un electron. Ceilalți izotopi mai puțin abundenți ai hidrogenului au numerele de masă 2 și, respectiv, 3. Acești izotopi diferă în ceea ce privește numărul de neutroni din nucleul lor, dar toți trei au câte un proton și un electron. În realitate, există izotopi naturali ai fiecărui element, fiecare având un număr de masă unic. În notația chimică, numărul de masă pentru un anumit izotop este exprimat sub forma unui superscript care precede simbolul elementului. Cei trei izotopi ai hidrogenului ar fi exprimați ca 1H, 2H și 3H. Deoarece fiecare element este compus din mai mulți izotopi, o întrebare care se pune este „care este masa reală a unui anumit element?”. Din nou, dacă vă uitați la tabelul periodic de mai sus, veți observa un număr în partea de jos a fiecărei căsuțe. Aceasta este greutatea atomică pentru elementul respectiv. De exemplu, greutatea atomică pentru hidrogen este de 1,00794 amu. Acest număr a fost obținut prin calcularea masei medii a celor 3 izotopi ai hidrogenului. De exemplu, să presupunem că avem 10 băieți în clasă. Dacă am dori să aflăm greutatea medie a băieților, am aduna greutățile individuale ale acestora și am împărți totalul la 10. Acest lucru ne-ar da greutatea lor medie. Acesta este, în esență, modul în care sunt determinate greutățile atomice. Deoarece 1H este cel mai abundent izotop al hidrogenului, este logic ca greutatea atomică pentru hidrogen să fie foarte apropiată de masa atomică a 1H.
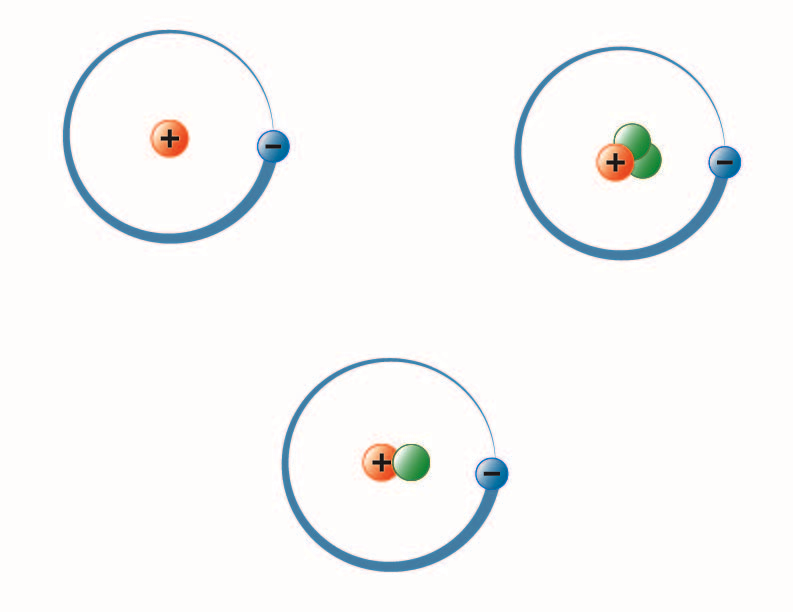
imagine creată de studenta BYU-I Hannah Crowder toamna 2013
Imaginea de mai sus reprezintă cei trei izotopi ai hidrogenului. Cel mai comun (stânga sus) are un proton și niciun neutron în nucleu. Deuteriul (jos) are un proton și un neutron, iar tritiul (dreapta sus) are un proton și doi neutroni.
**Puteți folosi butoanele de mai jos pentru a trece la lectura următoare sau anterioară din acest modul**

