În acest capitol sunt prezentate astfel de aspecte care vor permite studentului să înțeleagă metodele de analiză utilizate în examinarea tehnică a fierului și oțelului. Natura acestei lucrări împiedică o tratare detaliată a subiectului – o tratare care poate necesita o estimare a uneia sau mai multor substanțe dintre următoarele: – Carbon (liber și combinat), sulf, siliciu, fosfor, mangan, titan, cupru, nichel, cobalt, crom, aluminiu, arsenic, antimoniu, staniu, tungsten, vanadiu, azot, fier. În general, cele mai necesare estimări sunt cele ale carbonului, sulfului, siliciului și fosforului. Dintre celelalte elemente și compuși menționați, în cazul oțelurilor speciale sunt necesare determinări ale unuia sau mai multor elemente. Pentru informații cu privire la aceste determinări, studentul este îndrumat să consulte Chemical Analysis and Foundry Chemistry, de Crobaugh; The. Chemical Analysis of Iron, de Blair; „Carbon in Steel by Direct Combustion”, de Blount, în The Analyst, ianuarie 1902; „Sulphur in Wrought Iron and Steel”, de Auchy, în Jour. Amer. Chem. Soc., martie 1901, precum și alte articole în aceleași reviste. Studentul care dorește să meargă mai departe ar trebui, dacă este posibil, să obțină acces la lucrările și articolele lui Campbell, Drown și alții, publicate din când în când în diversele reviste de chimie și metalurgie.
Ca urmare a faptului că timpul studentului este limitat, el poate, deocamdată, să amâne estimarea siliciului și a fosforului, deși acestea sunt prezentate datorită importanței lor atât pentru metalurgist, cât și pentru turnător.
Pentru ca studentul să obțină o înțelegere mai temeinică a subiectului, nu vor fi de prisos câteva note 0n legătură cu compoziția și proprietățile substanțelor luate în considerare. În ceea ce privește influența diferitelor elemente asupra oțelului, consultați lucrarea The Manufacture and Properties of Structural Steel, de H. H. Campbell.
Carbonatul există în fier în trei stări – grafitică, dizolvată și combinată. În afară de acestea, alte forme au fost identificate la microscop.
Sulful există în fier în principal sub formă de sulfură FeS. care este solubilă în fierul topit.
Fosforul există sub formă de fosfură de fier, care este complet solubilă în fierul topit.
Siliciul formează siliciura de fier, care, de asemenea, este solubilă în fierul topit.
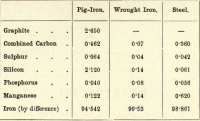
Dintre aceste patru elemente, deci, carbonul este singurul care poate exista în stare liberă. Variațiile în proporțiile diferitelor elemente prezente sunt aproape infinite, dar următoarea tabelare succintă oferă compoziția aproximativă a fontei, a fierului forjat și a oțelului, deși fiecare dintre acestea este supusă unor variații considerabile.
Studentul trebuie să estimeze următoarele:-
(1) Carbon,
(a) Total.
(b) Grafitic.
(c) Combinat.
(2) Sulf.
(3) Siliciu. (Dacă timpul permite.)
(4) Fosfor. (Dacă timpul permite.)
CARBON Total
În această estimare, carbonul este transformat în CO2 care este absorbit în potasa caustică. Din greutatea de CO2 astfel obținută se calculează carbonul.
La prima vedere s-ar părea că cel mai simplu procedeu ar fi să se aprindă alezajele de fier sau de oțel direct într-un curent de oxigen și să se absoarbă CO2 astfel format în KHO. Din nefericire, această metodă, până în prezent, fie s-a dovedit inexactă, fie, în cazul în care s-a obținut o ardere completă, aparatura necesară pentru a rezista la temperaturi ridicate sau la alte variații de tratament nu era potrivită pentru lucrări tehnice (vezi articolele lui Blount din The Analyst). Studentul va constata că metoda prezentată aici nu este nicidecum ideală, din punct de vedere tehnic, în ceea ce privește comoditatea și rapiditatea, și se pare că există probabilitatea ca ea să fie înlocuită în viitorul apropiat cu o altă metodă de oxidare directă mai rapidă.
Metoda adoptată. în urma consultării numeroaselor lucrări pe această temă, se va găsi o mare varietate de metode. Metoda prezentată aici va da, cu o atenție obișnuită, rezultate precise. Pe scurt, este următoarea:-
Fierul se dizolvă într-o soluție de clorură dublă de potasiu și cupru, acidă cu HCl. Cuprul metalic se precipită și se dizolvă din nou; fierul se dizolvă, carbonul fiind lăsat în suspensie. Apoi se colectează și se aprinde în cuptorul de combustie cu oxigen, iar CO2 emanat se cântărește.
Soluția fierului.-Se cântărește 1 gram de borhot de fontă. Se transferă într-un pahar de 300 c.c.. Se adaugă 100 c.cs. soluție de CuCl2,2KCl,2H2O, care se prepară după cum urmează. Se dizolvă în apă 149,1 părți de KCl și 170,3 părți de CuCl2,2H2O cristalizat. Se evaporă și se cristalizează clorura dublă. Se dizolvă 300 g de sare dublă în apă distilată. Se filtrează prin azbest aprins și se păstrează în sticle cu dop de sticlă.
La conținutul paharului se adaugă 7 c.cs. HCl pentru a face soluția acidă. Se agită intermitent până când se realizează dizolvarea fierului. Așezați paharul și conținutul spre sfârșitul soluției pe o baie de apă la o temperatură de aproximativ 60° C. Au loc următoarele reacții-Fe + CuCl2 = FeCl2 + Cu și Cu + CuCl2 = 2CuCl. KCl ajută pur și simplu la dizolvarea cuprului precipitat. În aproximativ 40 de minute de la adăugarea clorurilor duble, soluția ar trebui să fie aproape completă și cea mai mare parte a cuprului dizolvat. Se spală pereții paharului cu puțină clorură dublă acidulată. La soluție se adaugă puțin azbest aprins pentru a sedimenta materia carbonată și pentru a împiedica înfundarea filtrului (conform recomandării lui Barba).
Pentru filtrare, sunt foarte convenabile vasele speciale din platină, montate pe principiul creuzetului Gooch. Cu toate acestea, studentul poate filtra materia carbonată cu ajutorul unui creuzet Gooch ajutat de o aspirație artificială, materia carbonată fiind spălată cu un jet de apă după ce lichidul a trecut prin filtru. Se spală cu grijă carbonul de pe filtru cu apă caldă. Se usucă creuzetul și
conținutul în cuptorul cu aer la 100 C. Materia carbonică este acum pregătită pentru aprindere.
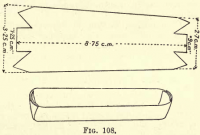
Oxidarea carbonului.
Pregătiți o barcă de platină tăind o bucată de folie de platină ca în fig. 108, îndoind laturile și capetele pentru a forma o cuvă. Transferați materia carbonică și azbestul din Gooch în barcă.
Furnalul de ardere, accesoriile și instalațiile trebuie puse în ordine. Se folosește din nou aparatul de purificare a oxigenului, dar de data aceasta este prevăzut cu un tub cu trei căi, cu robinete introduse între depozit și purificatoare. Acest lucru permite ca un curent de aer să fie aspirat prin aparat. Tubul de combustie poate fi din sticlă dură de Jena, din porțelan sau din platină. Se folosesc două tuburi U între cuptor și bulbii de potasă. Membrul primului tub, cel mai apropiat de cuptor, conține CuSO4 anhidru, iar celălalt membru conține CuCl anhidru. Al doilea tub în U conține CaCl2 uscat. Aceste două tuburi formează „trenul de purificare”. CuCl absoarbe orice Cl, iar celelalte substanțe orice H2O. Acest set va servi pentru multe determinări. Urmează bulbii de potasă și tuburile de protecție, iar un aspirator ar trebui să fie la îndemână pentru a trage un curent de aer prin aparat atunci când este necesar. Becurile de potasă sunt încărcate cu 8E. KHO, iar tubul de protecție cu CaCl2. Se testează cuptorul și bulbii așa cum a fost descris mai înainte (vezi cărbune și cocs), tubul fiind încărcat ca în schiță, vasul fiind deocamdată ținut în cuptorul cu aer la 100° C.
Când totul este gata, arzătoarele fiind stinse de ceva timp, se introduce vasul și conținutul. Arzătoarele sunt aprinse de la capătul din față, lucrează treptat spre înapoi, iar un curent lent de oxigen de aproximativ două bule pe secundă, după ce în prealabil a fost pornit până când tubul este plin de oxigen. Se reglează temperatura până când vasul ajunge la un roșu stins, iar dacă soluția din becuri dă semne că se întoarce în cuptor, se mărește curentul de oxigen la trei sau patru bule pe secundă.
Din momentul introducerii vasului sunt suficiente aproximativ cincizeci de minute pentru o ardere completă. Se oprește oxigenul și se trece un curent de aer timp de zece minute.
Bulbii de potasă și tubul de protecție se scot acum și se cântăresc, iar carbonul se calculează ca de obicei.
(b) Carbonul grafitic -Fierul este, de către unii, dizolvat în HCl, de către alții în HNO3 când carbonul grafitic rămâne ca reziduu. Pentru fonta brută ambele metode, cu atenție, dau rezultate bune, dar pentru oțelurile care conțin grafit Blair recomandă soluția în acid azotic. (Pentru această metodă consultați Blair.)
Cântăriți 5 g de borhot de fontă brută. Se dizolvă în 50 c.cs. SE. HCl cu ajutorul unei călduri ușoare. Se fierbe timp de câteva minute. Se diluează până la 100 c.cs. (aproape). Se filtrează printr-un creuzet Gooch. Se spală bine cu apă caldă și apoi cu E. KHO clocotită. (Aceasta dizolvă orice SiO2.) Se spală din nou cu apă fierbinte pentru a elimina KHO. Se usucă creuzetul și conținutul.
Se estimează carbonul ca mai înainte prin ardere și se calculează procentul ca de obicei.
(c) Carbonul combinat (prin diferență).
(c) Carbonul combinat (prin diferență).-După ce se cunosc carbonul total și carbonul grafitic, carbonul combinat se obține scăzând carbonul grafitic din carbonul total.
Pentru metodele directe de estimare consultați autoritățile menționate.
ESTIMAREA SULFULUI DIN FEROI & OȚEL
Există diferențe considerabile de opinie în ceea ce privește cea mai bună metodă de estimare a sulfului din fier și oțel. Vechea metodă a soluției de apă regală și a precipitării cu BaCl2 este recunoscută ca fiind foarte imprecisă; dar o soluție lentă în HNO3, cu foarte puțin sau deloc HCl prezent, urmată de o precipitare atentă cu BaCl2 în prezența unui exces definit de HCl și cu atenția cuvenită în ceea ce privește timpul și condițiile de precipitare, precum și precauțiile împotriva contaminării precipitatului cu fier – cu acestea și cu atenție se pot obține rezultate bune. Blair, pe de altă parte, recomandă dizolvarea în HCl, S fiind eliberat sub formă de H2S, care este absorbit într-o soluție (alcalină) de Pb(NO3)2 formând PbS, care este dizolvat în HCl + KClO3, iar S este precipitat sub formă de BaSO4. Pentru alte metode, a se vedea Blair, Stillman, Auchy, Crobaugh și Drown. O altă metodă folosită în mod curent este cea a evoluției S sub formă de H2S, urmată de absorbția în soluție de clorură de cadmiu. Sulfura de cadmiu precipitată se dizolvă în HCl, iar S este estimat prin titrare cu o soluție de iod, sau, mai frecvent, H2S este absorbit în apă Br. și apoi precipitat sub formă de BaSO4 sau este absorbit în NaOH și titrat cu iod; aceasta din urmă este metoda preferată. (A se vedea Blair.) În continuare este prezentată următoarea metodă: –
Oxidare prin HNO3 (așa-numita metodă Aqua Regia): Se cântăresc 5 g de borhot și se transferă într-un pahar adânc de 200 c.c.. Se adaugă cu grijă aproximativ 40 c.cs. 16E. HNO3, în loturi de aproximativ 10 c.cs. de fiecare dată, acoperind paharul cu un pahar mare de ceas și având grijă ca acțiunea să nu fie prea violentă. Când acțiunea încetează aparent, se observă dacă toate particulele sunt dizolvate (cu excepția carbonului). În caz contrar, se încălzește pe baia de nisip și se adaugă 3 sau 4 picături de 16E. HCl, și se încălzește până la dizolvare.
Când soluția este completă, se adaugă puțin Na2CO3 pentru a transforma orice H2SO4 în Na2SO4, care nu este volatil la evaporare.
Se îndepărtează din baia de nisip și se adaugă 5 c.cs. de HCl puternic în plus față de cel necesar pentru a dizolva doar compușii de fier precipitați de Na2CO3. Se filtrează SiO2 și C. Se spală bine. Se evaporă până la uscare pentru a face SiO2 insolubil. Se completează cu HCl și se evaporă până când Fe2Cl6 începe să cristalizeze. Apoi se adaugă 5 c.cs. HCl. și se filtrează în cazul în care există reziduuri. (Dacă nu se găsește niciun reziduu, înseamnă că nu a existat SiO2 în soluție, iar evaporarea ar fi putut fi omisă). Se filtrează și se spală cu grijă precipitatul în Gooch, aducând lichidul și spălările până la aproximativ 100 c.cs.
Se încălzește până la fierbere. Se adaugă 10 c.cs. soluție saturată de BaCl2. Se fierbe timp de 30 de minute. Se lasă să stea peste noapte. Se filtrează printr-un Gooch. Se spală cu puțin E. HCl. și apoi cu apă. Se usucă, se aprinde și se cântărește ca de obicei BaSO4, care trebuie să fie alb și să nu fie contaminat cu săruri de fier.
Calculează procentul de S în mod obișnuit. Deoarece unii dintre reactivii folosiți pot conține sulf, trebuie să se efectueze un blanc, folosind aceleași cantități ca la analiza propriu-zisă, iar orice sulf găsit trebuie dedus din rezultatul anterior.
ESTIMAREA SILICONULUI
Metoda prezentată aici este cea a lui Drown și este rapidă și exactă. Fierul se dizolvă în HNO3, urmat de H2SO4, cu evaporare până la uscăciune. Aceasta este urmată de dizolvare, lăsând siliciul în reziduu sub formă de SiO2.
Detalii: Se cântăresc 2 g de borhot și se transferă într-un vas de platină sau porțelan. Se adaugă 30 c.cs. 8E. HNO3 Când aparent acțiunea încetează, se adaugă 20 c.cs. 18E. H2SO4 și se evaporă. (Blair recomandă o ușoară suflare de aer cald care să joace pe suprafața lichidului. Aerul se încălzește prin trecerea lui printr-o mică spirală de țeavă de cupru încălzită deasupra unui bunsen. Evaporarea este astfel grăbită și spirala este împiedicată). Continuați evaporarea până când se degajă vapori copioși de SO3. Se răcește și se diluează cu precauție cu apă distilată până la 130 c.cs. Se încălzește până când se dizolvă tot FeSO4. Se filtrează și se spală mai întâi cu puțin E. HCl și apoi cu apă fierbinte. Această filtrare se realizează cel mai bine cu o hârtie de filtru fără cenușă de 7 cm (se verifică cenușa prin aprinderea a două sau trei hârtii). Se usucă; se transferă într-un creuzet de platină; se aprinde ca de obicei și se cântărește. În creuzet se adaugă 5 c.c. de H2SO4 puternic și 5 c.c. de HF puternic. Se evaporă cu grijă până la uscare, folosind un jet de aer fierbinte pentru a grăbi evaporarea. Se aprinde și se cântărește din nou. În cazul în care H2SO4 și HF sunt pure, diferența de greutate reprezintă SiO2. Se verifică H2SO4 și HF (în special acesta din urmă) prin evaporarea unui blanc. Orice reziduu găsit trebuie să fie luat în considerare.
ESTIMAREA FOSFORULUI
Aici, din nou, sunt prezentate numeroase metode de către diferite autorități, majoritatea dintre ele dând rezultate precise atunci când sunt urmate cu atenție. Cele două metode cele mai potrivite pentru analiza tehnică sunt metoda de reducere volumetrică pregătită de subcomitetul (domnii Barba, Blair, Drown, Dudley și Shimer) al Comitetului Internațional de Standardizare a Oțelului, S.U.A., și metoda de reducere modificată, așa cum este dată de domnii Dudley și Pease, Jour. Anal. Appl. chim., vii. 108. Prima metodă este discutată pe larg în Blair’s Analysis of Iron; cea de-a doua metodă este prezentată aici.
Fierul este dizolvat, iar P-ul este precipitat sub formă de fosfo-molibdat de amoniu. Acesta este dizolvat și, prin acțiunea Zn și H2SO4, MoO3 este redus, iar lichidul redus este apoi titrat cu K2Mn2O8 (soluție standard), iar din numărul de c.c. utilizate se poate calcula conținutul de P.
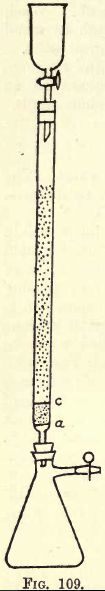
Detalii. -Dacă se lucrează mult, este necesar un aparat de agitare (a se vedea cataloagele de aprovizionare cu produse chimice). Cu toate acestea, studentul poate efectua agitarea necesară manual. Înainte de a trece la analiză, trebuie pregătit aparatul de reducere (o modificare a reductorului Jones) (vezi fig. 109).
La a se află un disc fin perforat din folie de platină robustă. Între a și c se află aproximativ ¾ inch de nisip alb curat, c este un alt disc de platină perforat.
Deasupra acestui disc, tubul este umplut cu zinc amalgamat fin granulat, preparat astfel: -Disolvați 5 gms. Hg în 25 c.cs. de HNO3 puternic, se diluează cu apă și se completează soluția până la 1 litru. În această soluție
se toarnă o jumătate de kilogram de zinc granulat care trece printr-o sită de 20, dar nu de 30. Se agită timp de unul sau două minute. Se toarnă soluția. Se spală și se usucă zincul, care este acum amalgamat. Pâlnia și balonul se montează pe aparat așa cum se arată.
Pregătiți următorii reactivi :-
(a) Soluția puternic oxidantă de K2Mn2O8. 12 gms. de K2Mn2O8 pur în 1 litru de apă. Se filtrează și se îmbuteliază.
(b) Soluția de molibdat.-Disolvați 50 gms. MoO3 în 200 c.cs, NH4HO (S.G. .96). Se filtrează, iar la filtrat se adaugă 500 c.cs. HNO3 (S.G. 1.2). Se lasă să stea cel puțin 24 de ore înainte de utilizare.
(c) Soluția acidă de sulfat de amnwniu.- La 500 c.cs. de apă distilată se adaugă 27,5 c.cs. NH4HO (S.G. 0,96), apoi 24 c.cs. de H2SO4 pur (S.G. 1,84) și se diluează până la 1000 c.cs.
(d) Soluția standard de K2Mn2O8.-Disolvați 2 g de K2Mn2O8 cristalizat în 1000 c.cs de apă distilată. Se standardizează soluția după cum urmează : Se cântăresc 3 loturi de 0,1 până la 0,3 gm. fiecare de sârmă de fier bine curățată, al cărei conținut de fier este cunoscut. Se transferă în flacoane Erlenmeyer de 100 c.c. și se adaugă la fiecare 40 c.cs. 8E. H2SO4. După dizolvare, se fierbe 5 minute; se diluează până la 150 c.c.cs., se trece prin reductor și se spală, aducând volumul la 200 c.c.cs., conform indicațiilor din analiză. Se titrează fiecare lot cu K2Mn2O8. Rezultatele trebuie să corespundă pentru fierul metalic la 1/100 de miligram. Se ia în considerare cantitatea necesară pentru impuritățile din firul prelevat. Să presupunem că 1 c.c. K2Mn2O8 = 0,0034923 gm, Fe, apoi înmulțim această valoare în Fe cu raportul dintre MoO3 și Fe, și anume 0,9076, iar produsul cu raportul dintre P
prezent și MoO3, și anume 0,019, avem
1 c.c. K2Mn2O8 = 0,0000602 gm. P
Analiză
Se cântăresc borhoturile de 1 gm. Se transferă într-un balon Erlenmeyer de 200 c.c.. Se adaugă 70 c.cs. 5E. HNO3. Când soluția este completă, se fierbe un minut și se adaugă 10 c.cs. din soluția „oxidantă” de K2Mn2O8. Se fierbe până când dispare culoarea roz și se separă MnO2. Se îndepărtează și se adaugă treptat, sub agitare, cristale de FeSO4 pur (fără fosfor) până la limpezirea conținutului. Se încălzește soluția la 80° C (dacă este prezent As, la 35° C). Se adaugă 75 c.cs. de soluție de molibdat la o temperatură de 27° C. Se închide balonul cu un dop de cauciuc și se agită timp de 5 minute. Se lasă să se odihnească timp de 5 minute. Se filtrează apoi printr-un filtru de 9 cm, se filtrează și se spală cu soluție acidă de sulfat de amoniu până când câteva picături din spălături nu mai dau culoare cu sulfură de amoniu.
Disolvați precipitatul de pe hârtie cu 5 c.cs. NH4HO (S.G. 0,90) și 25 c.cs. de apă, lăsând soluția să se scurgă înapoi în balonul inițial, dizolvând astfel orice precipitat care a aderat la pereții acestuia. Se spală până când filtratul și spălările ajung la 150 c.cs. Se adaugă 10 c.c. de H2SO4 puternic (S.G. 1,84) și se diluează până la 200 c.c. Soluția este acum gata pentru reducere.
Se toarnă în pâlnie 100 c.cs. H2SO4 ~E/2 cald. Conectați balonul la pompa de filtrare și deschideți clema, astfel încât soluția să curgă aproape, dar nu chiar, din pâlnie. Apoi, în pâlnie se adaugă următorul gol-5 c.cs. NH4HO (S.G. 0,90), 10 c.cs. H2SO4 (S.G. 1,84) și 50 c.c. de apă, amestecate împreună. Se deschide din nou clema, astfel încât acest amestec să curgă aproape în afara pâlniei. Adăugați acum 200 c.cs, E/2 H2SO4 în pâlnie, și aproape că se scurge prin ea.
Descoaceți balonul, închizând mai întâi robinetul de închidere a uleiului din pâlnie. Titrați conținutul balonului cu K2Mn2O8. În general, se consumă astfel aproximativ 0,1 c.cs. de permanganat și această cantitate trebuie dedusă din măsurătorile viitoare.
Transferați acum soluția care urmează să fie redusă în pâlnie. Atașați un balon curat. Conectați și porniți pompa de filtrare. Deschideți robinetul de închidere și clema, astfel încât să curgă aproape toată soluția. Spălați balonul care a conținut soluția cu 100 c.cs. E/2 H2SO4. Adăugați această soluție în pâlnie și tratați-o ca mai înainte.
În cele din urmă, adăugați și aproape treceți încă 100 c.c. de acid.
Soluția redusă din balonul cu filtru ar trebui să fie acum de un verde strălucitor.
Îndepărtați-o ca mai înainte și titrați-o cu soluția de permanganat. Verdele se transformă în maro-roz, apoi în galben-roz, apoi în incolor, iar în final se obține un roz permanent (după ce a stat în repaus un minut). Din citirea obținută se deduce citirea blancului și se calculează procentul de P prezent din datele prezentate mai sus.
În loc de această metodă volumetrică, unii chimiști preferă să cântărească direct precipitatul galben de fosfo-molibdat. Pentru detalii, a se vedea Blair’s Analysis of Iron, p. 108.
Nota: Studentul ar trebui, ori de câte ori este posibil, să profite de trimiterile la autorități speciale. Până în acest moment el ar trebui să fie capabil să consulte, să compare și, într-o oarecare măsură, să folosească în mod judicios astfel de materiale. Niciun manual nu poate oferi o tratare oricum cuprinzătoare a ”Fierului și Oțelurilor” sau, de altfel, a oricăruia dintre subiectele tratate în această secțiune; prin urmare, referințele oferite, împreună cu literatura curentă, trebuie să fie parcurse cu atenție de către analistul care dorește să exceleze în munca tehnică. A fost prezentată determinarea colorimetrică a carbonului combinat prin metoda Eggertz; manganul poate fi determinat oarecum în mod similar prin metoda colorimetrică Peter sau prin metoda acetatului (vezi Blair etc.).
.