Introducere
Metanul (CH4) este un gaz cu efect de seră major. Emisia sa din mediile naturale, cum ar fi zonele umede, oceanele și sedimentele, reprezintă peste 70% din metanul atmosferic la nivel global (IPCC, 2007). O evaluare a datelor publicate a evidențiat diferite rate de emisie de metan pentru zonele umede, lacuri, râuri, estuare și oceane (în ordine descrescătoare, Figura suplimentară S1). Numai zonele umede naturale reprezintă 62% din producția biogenă de CH4 (Kirschke et al., 2013; Nazaries et al., 2013), iar emisiile din zonele umede domină variabilitatea interanuală a surselor de metan (Bousquet et al., 2006). În schimb, suprafața vastă a ecosistemelor marine contribuie doar cu aproximativ 8 % la sursele naturale de CH4 (Nazaries et al., 2013). În cadrul emisiilor globale de metan la nivel oceanic, mai puțin de 10% este contribuția estuarelor (Bange et al., 1994).
Metanogeneza, formarea biologică a metanului, este realizată de archaea metanogenă care produce metan în principal din H2/CO2, grupări metil sau acetat în condiții anoxice (Thauer et al., 2008). Această reacție este catalizată de metil-coenzima M reductază (MCR). Gena mcrA care codifică o subunitate a acestei enzime este un marker genetic utilizat în mod obișnuit în studiile moleculare (Conrad, 2007; Bridgham et al., 2013). Avantajul markerului genic mcrA este acela de a capta atât semnăturile filogenetice, cât și cele funcționale ale metanogenilor, oferind o profunzime ridicată de secvențiere pentru această funcție specială (Luton et al., 2002; Borrel et al., 2013; Yang et al., 2014). Un număr mare de secvențe mcrA au fost recuperate dintr-o varietate de medii naturale. Setul public de date mcrA permite extragerea modelelor ecologice generale și investigarea modelării gradienților de mediu la scară globală și regională. În plus, este disponibilă o bază de date care rezumă proprietățile fiziologice a 152 de izolate metanogene1 (Jabłoński et al., 2015). Recent, clasificarea genomului a scos la iveală secvențe mcrA neobișnuite în noua clasă de Methanofastidiosa (Nobu et al., 2016) și în noile phyla de Bathyarchaeota (Evans et al., 2015) și Verstraetearchaeota (Vanwonterghem et al., 2016). Aceste noi descoperiri au extins cunoștințele noastre despre diversitatea potențialilor metanogeni, dar nu au întunecat aplicabilitatea genei mcrA ca marker molecular pentru marea majoritate a comunităților metanogene.
Până în prezent, comunitățile metanogene au fost detectate în zone umede, sedimente, zone de permafrost, orezării, digestori, izvoare geotermale și guri de aerisire hidrotermale (Conrad, 2007; Thauer et al., 2008; Wagner și Liebner, 2009). S-a constatat că structura comunității metanogene este asociată cu pH-ul mediului, temperatura, salinitatea, nivelul apei subterane și dinamica vegetației la diferite scări spațiale și temporale (Megonigal et al., 2005; Milferstedt et al., 2010; Frank-Fahle et al., 2014; McCalley et al., 2014; Cui et al., 2015; Liebner et al., 2015). De exemplu, metanogeneza acetoclastică este, în general, împiedicată de un pH scăzut, deoarece acesta reduce disocierea acetatului (Megonigal et al., 2005; Kotsyurbenko et al., 2007). Vegetația poate furniza carbon organic labil și de înaltă calitate pentru a alimenta metanogenii sub formă de exsudate de rădăcini sau detritus, astfel încât exsudatele vegetale favorizează în general metanogenii acetoclastici în principal în fânețe (Bridgham et al., 2013). Sulfatul din apa de mare inhibă producția de metan în zonele umede cu maree și, în consecință, salinitatea a fost utilizată ca un predictor general pentru emisiile de metan (Holm et al., 2016). Un studiu privind sedimentele lacurilor tibetane a arătat că creșterea salinității inhibă metanogenii hidrogenotrofi, dar sporește metanogeneza acetoclastică (Liu et al., 2016). Aceste studii au indicat factorii determinanți de mediu pentru comunitățile metanogene, dar s-au concentrat pe habitate unice sau pe scări spațiale limitate.
Înțelegerea adaptării metanogenilor la diferite schimbări de mediu necesită însă o explorare sistematică și globală a corelațiilor dintre compoziția comunităților microbiene și condițiile de mediu (Lozupone și Knight, 2007). În prezent, doar câteva studii abordează dispersia și filtrarea habitatelor comunităților metanogene (Auguet et al., 2010; Barreto et al., 2014). Noi emitem ipoteza că ansamblurile metanogene sunt influențate în principal de filtrarea habitatului și că aceasta este determinată de controalele globale ale mediului. Având în vedere că ratele de emisie de metan diferă în mare măsură între ecosistemele naturale, integrarea explicită a compoziției, diversității și biogeografiei ansamblurilor metanogene din aceste ecosisteme poate fi fundamentală pentru a determina răspunsul producției de metan la schimbările climatice actuale și viitoare. Acest meta-studiu este realizat pentru a umple lacunele asociate cu biogeografia metanogenică, diversitatea și controalele sale de mediu prin utilizarea datelor de secvență mcrA disponibile public și a literaturii de specialitate, completate prin date fiziologice ale izolatelor metanogene.
Materiale și metode
Colectarea datelor
Am recuperat secvențe mcrA disponibile în GenBank (ianuarie 2016)2. Pentru fiecare rezultat pozitiv, a fost verificată lucrarea originală, iar secvențele mcrA corespunzătoare au fost analizate de un script Perl personalizat. Întrucât ne-am concentrat asupra mediilor naturale, secvențele mcrA metanogene au fost obținute din habitate naturale și clasificate ca fiind sol, sedimente de lac, de estuar, marine și hidrotermale și noroi vulcanic. Cinci biblioteci din secvențierea de generație următoare (NGS) au fost incluse în plus față de secvențele din bibliotecile de clone. Secvențele au fost descărcate fără a se ține cont de abundența relativă din setul de date original. Deoarece secvențele din bibliotecile de clone acoperă în principal filotipurile abundente, în timp ce NGS poate capta o diversitate mult mai profundă, am făcut un compromis pentru a utiliza datele NGS, dar am atenuat o potențială eroare datorată rezoluției diferite a metodelor de secvențiere. Prin urmare, am ales doar secvențele reprezentative ale OTU-urilor abundente cu o abundență relativă mai mare de 1 %. Am respins, de asemenea, acele secvențe NGS care nu au reușit verificarea traducerii din secvențe de nucleotide în secvențe de proteine sau care aveau o calitate scăzută (secvențe < 250 bps). În cele din urmă, am construit un set de date care conține 4466 de secvențe mcrA unice din 94 de situri distribuite la nivel global (figura 1 și tabelele suplimentare S1, S2). În plus, nu am sustras din setul de date secvențele mcrA ale potențialelor metanotrofe arheale, care au fost inevitabil detectate în studiul genomic (Conrad, 2007). Această parte depășește obiectul acestui studiu.
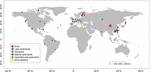
FIGURA 1. Localizarea siturilor utilizate pentru acest studiu. Siturile au fost grupate în șase categorii diferite în funcție de habitatele lor și au fost etichetate cu culori diferite. Un rezumat al celor șase habitate este prezentat în tabelele suplimentare S1, S2.
Coordonatele geografice și setările de mediu, inclusiv pH-ul, salinitatea, altitudinea, temperatura medie anuală a aerului (MAAT) și precipitațiile medii anuale (MAP) au fost extrase pentru fiecare sit de cercetare luat în considerare în acest studiu din publicațiile corespunzătoare, având în vedere că datele sunt disponibile (a se vedea tabelul suplimentar S1). Pentru a ține cont de parametrii de mediu lipsă în mai multe studii, am definit în mod calitativ unele variabile de mediu în funcție de descrierile siturilor din literatura de specialitate și apoi am convertit aceste date de categorie în valori numerice semimetrice, de exemplu, am definit sedimentele marine, sedimentele hidrotermale, noroiul vulcanic și probele de sedimente de lacuri de sodă ca fiind „saline”, probele de sol și de sedimente de lacuri de apă dulce ca fiind „nesaline”, iar probele de mangrove și de estuare ca probe „mixte”.
Procesarea secvențelor brute
Procesarea secvențelor a fost implementată cu platforma software Mothur (Schloss et al., 2009). Secvențele din diferite biblioteci au fost puse în comun înainte de procesare. Secvențele cu o lungime mai mică de 350 bp sau cu mai mult de 8 baze ambigue au fost eliminate. Ulterior, aceste secvențe au fost aliniate cu un subset prealiniat de secvențe mcrA, care au fost preluate din baza de date FunGene la http://fungene.cme.msu.edu/ (Fish et al., 2013). Secvențele chimerice au fost identificate cu ajutorul software-ului Mothur folosind metoda uchime (Edgar et al., 2011) cu setul de date propriu-zis ca referință. Apoi, secvențele de nucleotide valide ale genei mcrA au fost utilizate pentru a calcula distanțele perechi necorectate între secvențele de ADN aliniate și atribuite ulterior în unități taxonomice operaționale (OTU) la un prag de 84 %, care corespunde la 97 % pentru gena 16S rRNA (Yang et al., 2014). Abundența fiecărei OTU mcrA a fost contabilizată doar ca prezență sau absență. Am crescut acuratețea clasificării taxonomice a OTU-urilor prin luarea în considerare atât a secvențelor de nucleotide, cât și a celor de aminoacizi. La nivelul ADN, identitatea taxonomică a fost atribuită de platforma Mothur în conformitate cu o bază de date de referință (Yang et al., 2014). La nivel proteic, secvențele de proteine aliniate au fost utilizate pentru a construi un arbore în ARB, iar apoi atribuirea taxonomică s-a bazat pe baza bazei de date corespunzătoare. În cazul în care atribuirea unei OTU a fost inconsecventă, am efectuat manual blastarea atât a secvenței de nucleotide, cât și a secvenței de proteine în NCBI și am determinat identitatea taxonomică finală luând în considerare acoperirea interogării (>95%), identitatea (>84%) și valoarea e- (<1E-5). Pentru secvențele de proteine, cutoff-ul la nivel de gen s-a referit la pragul de 83,5 % (Hunger et al., 2011).
Analiză ecologică și statistică
Analiza statistică a fost realizată prin diverse pachete R. Ordonările analizei coordonatelor principale (PCoA) au fost generate pe baza matricelor de distanță Jaccard construite cu ajutorul pachetului vegan v2.2.0 (Oksanen et al., 2015). MANOVA permutațional (analiza multivariată a varianței) a fost efectuată pentru a evalua sursa de variație a matricei Jaccard (McArdle și Anderson, 2001) în vegan cu 104 permutări. Măsurile distanței Jaccard se bazează pe prezența/absența speciilor, ceea ce este mai potrivit pentru setul nostru de date, deoarece majoritatea studiilor au furnizat doar secvențele reprezentative, în timp ce informațiile privind abundența lipsesc. Frecvențele incidenței taxonomice între habitate au fost vizualizate prin diagrame cu bule cu ajutorul pachetului ggplot2 (v1.0.0) (Wickham, 2009). Analiza de grupare ierarhică a comunităților de soluri nesaline și sedimente lacustre a fost realizată cu ajutorul funcției R „hclust” (R Core Team, 2014). Clusterele de comunități obținute au fost descrise în funcție de regimul de pH și temperatură al probelor inițiale, deoarece, utilizând în prealabil PCoA, am identificat că ambii parametri, pH și temperatură, influențează compoziția comunităților metanogene în solurile nesaline și sedimentele lacustre. Asocierea fiecărui neam metanogen cu fiecare dintre aceste clustere a fost determinată utilizând analiza speciilor indicatoare bazată pe corelații (Dufrene și Legendre, 1997). Speciile indicatoare sunt definite aici ca fiind cele care sunt atât abundente într-un anumit tip de habitat (specificitate), cât și cele care se găsesc în mod predominant în acest tip de habitat (fidelitate). În acest studiu, taxonii indicatori, similar conceptului de specii indicatoare, pentru solurile nesaline și sedimentele lacustre au fost aleși în funcție de o valoare indicatoare (valoarea IndVal) de către pachetul R labdsv (Roberts, 2016) dacă probabilitatea de a obține o valoare indicatoare la fel de mare ca cea observată pe parcursul iterațiilor specificate este mai mică de 0,05. Indicii Chao2 au fost calculați pentru fiecare eșantion cu ajutorul pachetului vegan. Testul Wilcoxon rank sum al indicilor Chao2 între habitate a fost realizat cu ajutorul funcției R „wilcox.test” (R Core Team, 2014). Pentru a consolida impactul filtrării habitatelor asupra izolatelor de archaea metanogenă, caracteristicile fiziologice și biochimice ale culturilor metanogene descrise au fost preluate din3 „Methanogenic archaea database” (Jabłoński et al., 2015). Dintre acestea, izolatele cu informații privind cerința optimă de NaCl au fost filtrate, clasificate și reprezentate grafic în funcție de sursa lor de izolare.
Pentru a examina influența limitării dispersiei asupra structurii comunității metanogene, s-a efectuat o analiză de regresie liniară pe baza unei matrice de distanțe geografice și a matricei de distanțe Jaccard a comunității cu ajutorul funcției R „lm” (R Core Team, 2014). Am efectuat teste Mantel și teste Mantel parțiale pentru a evalua efectele limitării dispersiei în funcție de cele două matrici folosind din nou pachetul vegan din R (Oksanen et al., 2015). În continuare, analiza spațială multivariată (PCA spațială) a fost aplicată la 16 eșantioane europene de sol și sedimente de lac pe baza indicelui I al lui Moran pentru a explora structura spațială a metanogenilor prin intermediul funcției „multispati” din pachetul R ade4 (Dray și Dufour, 2007). În plus, gruparea cu varianță minimă a lui Ward, care s-a bazat pe matricea distanței Jaccard, a fost implementată pe aceste 16 probe cu ajutorul funcției R „hclust” (R Core Team, 2014) și am proiectat ulterior rezultatele grupării pe o hartă geografică. Fișierul shape european pentru cartografierea la nivel de stat este disponibil în baza de date GSHHG (v2.3.6)4. Harta a fost generată cu ajutorul QGIS v2.18.25.
Rezultate
Biogeografia arheilor metanogene în mediile naturale
Au fost recuperate secvențele genei mcrA din 94 de medii naturale distribuite la nivel mondial. Locația și tipul de ecosistem al fiecăruia dintre aceste 94 de situri sunt reprezentate în figura 1. Frecvențele de incidență (prezență/absență) ale liniilor metanogene au fost fuzionate în funcție de tipul de ecosistem și ilustrate în figura 2. Pe scurt, Methanoregula este taxonul cel mai frecvent observat în soluri, împreună cu Methanobacterium, Methanosaeta, Methanocella, Methanomassiliicoccus și Methanosarcina. În sedimentele din estuare, au fost detectate frecvent secvențe de Methanosaeta, Methanobacterium, Methanoregula și Methanoculleus. Mai mult decât atât, în sedimentele lacurilor, au apărut în principal Methanoregula și Methanosaeta. În sedimentele marine, Methanoculleus și Methanosaeta sunt cele mai frecvente linii genetice, urmate de Methanolinea.
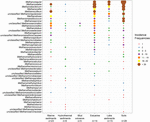
FIGURA 2. Graficul cu bule care prezintă frecvențele de incidență ale liniilor metanogene în diferite medii naturale. Ordinea de rang de-a lungul axei verticale corespunde frecvențelor de incidență totală descrescătoare ale liniilor. Taxonomia este indicată pentru nivelul genurilor. În cazul în care nu a fost posibilă o atribuire la nivel de gen, s-a utilizat următorul nivel taxonomic superior care poate fi atribuit. Numărul de eșantioane (n) este indicat pentru fiecare habitat.
Chiar dacă mulți taxoni au fost detectați în medii diferite, unii prezintă totuși preferințe de mediu. Methanoregula, taxonul care apare frecvent în mediile non-marine și de tranziție (soluri, sedimente lacustre și estuare), este absent din habitatele marine (sedimente marine, sedimente hidrotermale și noroi vulcanic). Methanobacterium și Methanocella, care predomină în mediile non-marine și de tranziție, sunt rar întâlnite în habitatele marine. În schimb, Methanococcoides, ca neam predominant în sedimentele marine, sedimentele hidrotermale și vulcanii noroioși, este abia observat în soluri și sedimente lacustre. Mai mult, Methanogenium și Methanolacinia sunt observate doar în estuare și sedimente marine, în timp ce Methanospirillum și Methanosphaerula se găsesc doar în mediile terestre. În plus, unii taxoni specifici se găsesc exclusiv în sedimentele hidrotermale, inclusiv Methanocaldococcus, Methanothermocococcus, Methanopyrus, Methanotorris și Methanocococcus. Deși unele neamuri, cum ar fi Methanosaeta, sunt prezente în majoritatea mediilor, niciun neam nu poate fi considerat omniprezent.
Cea mai mare bogăție de neamuri a avut loc în sedimentele de estuar care, de asemenea, adăpostesc frecvențe de incidență mai egale ale diferitelor neamuri. În schimb, vulcanii noroioși și ecosistemele hidrotermale prezintă o diversitate metanogenică relativ scăzută. Solurile și sedimentele lacustre similare cu cele din estuare sunt caracterizate de ansambluri metanogene diverse.
Alpha-Diversitatea comunităților metanogene în mediile naturale
Ricimea archaea metanogene conform indicelui Chao2 a variat în mare măsură între tipurile de ecosisteme (Figura 3). În scopul comparării directe a diversităților alfa și pentru a obține un compromis rezonabil între eșantioane, s-a efectuat o subeșantionare la 15 secvențe pentru fiecare sit. Indicele Chao2 arată că sedimentele de estuar cuprind cea mai mare bogăție de specii de metanogeni de-a lungul celor șase tipuri de ecosisteme (tabelul suplimentar S3), ceea ce subliniază rezultatele graficului cu bule (figura 2). Solurile și sedimentele lacustre, care prezintă o bogăție mai mică decât probele de estuar, au indici Chao2 semnificativ mai mari decât sedimentele marine și sedimentele hidrotermale și fără diferențe semnificative între sedimentele marine și sedimentele hidrotermale (tabelul suplimentar S3).
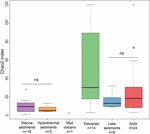
FIGURA 3. Graficul în cutie al indicilor Chao2 pentru diferitele tipuri de ecosisteme. Graficul se bazează pe seturi de date subeșantionate care conțin 15 secvențe pentru fiecare sit pentru a face comparația privind măsurile de diversitate alfa mai robustă. Numărul de eșantioane din fiecare habitat este indicat cu „n” sub eticheta habitatului. „ns” înseamnă că nu există semnificație statistică în testul Wilcoxon. Rezultatul statistic al diversității alfa la nivel de OTU este prezentat în tabelul suplimentar S3.
Controale globale asupra comunităților metanogene în mediile naturale
Cele 94 de comunități metanogene distribuite la nivel global au fost grupate într-un grafic de ordonare prin aplicarea PCoA pe baza matricei de distanțe Jaccard. Conform analizei PCoA, prima și a doua axă explică împreună 16,3% din varianța totală. Astfel, variațiile dintre probe pot fi explicate în mare măsură de salinitate (figura 4). Deoarece datele inițiale privind concentrațiile de sare nu au fost disponibile în unele cazuri, am atribuit calitativ aceste probe ca probe saline, mixte (intermediare) și nesaline, așa cum am descris mai sus. Probele saline și nesaline se separă efectiv de-a lungul primei axe. Probele mixte se grupează în general între probele saline și cele nesaline. MANOVA permutațională bazată pe matricea distanței Jaccard sugerează, de asemenea, că salinitatea este principalul factor abiotic care controlează distribuția comunităților metanogene globale (R2 = 0,099, P < 0,001) (tabelul 1).
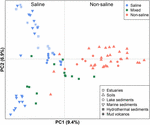
FIGURA 4. Ordonarea analizei coordonatelor principale (PCoA) bazată pe matricea distanței Jaccard a bibliotecilor de secvențe ale genei mcrA metanogenice comparând 94 de probe. PCoA este colorată în funcție de salinitate: Simbolurile roșii indică medii nesaline, cele albastre indică medii saline, iar cele verzi indică medii intermediare. Simboluri diferite descriu medii diferite. Procentul de variație explicat de coordonatele principale trasate este indicat pe axe.

TABEL 1. Analiza MANOVA permutațională pe matricea distanței Jaccard a tuturor probelor din cele șase habitate pentru a testa asocierea varianței comunității cu diferite variabile de mediu.
Aditional, am verificat o relație potențială între sursa de izolare a culturilor pure metanogene și concentrația optimă de NaCl pentru creștere. Concentrația optimă de NaCl a culturilor pure metanogene a demonstrat o scădere de la ecosistemele marine la cele din estuare, sedimentele lacustre și sol (figura suplimentară S2). Câteva izolate aberante provin din sedimente de lacuri de sodă sau soluri hipersaline.
Controale de mediu și taxoni indicatori metanogeni în solurile nesaline și sedimentele lacurilor
La scară globală, comunitățile metanogene din solurile nesaline și sedimentele lacurilor se grupează strâns (Figura 4), astfel încât am analizat în continuare controalele de mediu ale comunităților metanogene din aceste două habitate care reprezintă 33 de situri de studiu în total. Analiza clusterului bazată pe comunitate pentru aceste două tipuri de habitate a evidențiat patru clustere pe baza matricei de distanță Jaccard (Figura suplimentară S3). MANOVA permutațională sugerează că atât pH-ul (R2 = 0,099, P < 0,001), cât și temperatura (R2 = 0,069, P < 0,001) influențează β-diversitatea metanogenică din solurile nesaline și sedimentele lacustre (tabelul 2). În consecință, am atribuit cele patru clustere la pH-ul și MAAT-ul sitului inițial de prelevare a probelor și am obținut subgrupuri în mare măsură coerente cu gruparea comunității (figurile 5C,D). Combinația dintre caracteristicile de mediu și aceste patru clustere de comunități ne permite să definim aceste patru subgrupuri ca fiind neutru și rece grupul 1, acid și rece grupul 2, acid și moderat grupul 3 și neutru și cald grupul 4 (figura 5). Ordonarea ulterioară a PCoA pe baza matricei de disimilaritate Jaccard sugerează că, de-a lungul axei PC1, majoritatea eșantioanelor din grupul 2 și grupul 3 provin din soluri acide și sedimente lacustre, în timp ce grupul 1 și grupul 4 provin în principal din medii neutre (figura 5A). În plus, eșantioanele din siturile moderate (grupul 3) s-au separat de cele din siturile calde și reci de-a lungul axei PC2, în timp ce eșantioanele din mediile calde (grupul 4) s-au separat de celelalte eșantioane de-a lungul axei PC3 (figura 5B). Astfel, primele trei axe ale ordonării PCoA explică 38,8% din variația totală.

TABEL 2. MANOVA permutațională bazată pe o matrice de distanță Jaccard a probelor de sol nesalin și sedimente de lac pentru a testa asocierea varianței comunităților cu diferite variabile de mediu.
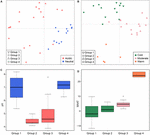
FIGURA 5. Graficul analizei coordonatelor principale bazat pe o matrice de distanță Jaccard pentru 33 de soluri nesaline și sedimente de lac. Subplot (A) prezintă PC1 și PC2 și simbolurile sunt colorate în funcție de pH, iar subplot (B) prezintă PC2 și PC3 și simbolurile sunt colorate în funcție de temperatură. Primele trei componente explică 17,1, 11,7 și 10% din varianță. Diagramele cu casete arată pH-ul (C) și MAAT (temperatura medie anuală a aerului) (D) a patru subgrupuri identificate. Culoarea casetei din figura C corespunde categoriei de pH din (A). Culorile boxploturilor arată semnificația statistică pe baza unui test Wilcoxon pe perechi (P < 0,05), unde eșantioanele cu aceeași culoare nu diferă semnificativ unul de celălalt. În mod similar, culoarea din (D) urmează gruparea temperaturii din (B). Subgrupurile se referă la analiza clusterului ierarhic al similitudinilor comunității.
Am examinat apariția liniilor metanogene în fiecare subgrup pe baza frecvențelor de incidență (Figura 6). Methanoregula predomină în toate tipurile de habitate nesaline. În plus față de Methanoregula, subgrupul neutru și rece (grupul 1) prezintă o abundență ridicată de Methanosaeta, Methanobacterium și Methanosarcina. Grupa 2 acidă și rece este reprezentată de Methanobacterium, Methanocella și Methanosarcina, în timp ce Methanosaeta este absentă aici. Methanocella și Methanosaeta sunt comune în grupa acidă și moderată 3. În grupa neutră și caldă 4, Methanolinea și Methanosaeta sunt membri importanți. Acest grup este singurul grup în care a fost identificat Methanoculleus.

FIGURA 6. Frecvențele de incidență ale liniilor metanogene în cadrul celor patru grupuri definite de comunități metanogene în soluri și sedimente lacustre. Axa verticală este aranjată în ordine alfabetică. Lungimea barei corespunde frecvențelor medii de incidență pentru fiecare neam în cadrul grupului corespunzător. Barele de eroare reprezintă abaterea standard a unui anumit taxon pe diferite eșantioane din grupul respectiv. Asteriscurile indică taxonii specialiști cu o valoare P < 0,05. Taxonomia este prezentată pentru nivelul genurilor. În cazul în care nu a fost posibilă o atribuire la nivel de gen, a fost utilizat nivelul taxonomic imediat superior care poate fi atribuit. Descrierea pentru cele patru grupe este prezentată în figura 5.
Pentru toate cele patru grupe, taxonii care au o incidență ridicată sunt Methanoregula, Methanobacterium, Methanosarcina, Methanosaeta, Methanomassiliicoccus și Methanocella. Taxonii specialiști, care sunt semnificativ mai mult reprezentați în majoritatea siturilor din cadrul unui anumit grup, au fost detectați în conformitate cu analiza speciilor indicatoare, așa cum a fost descrisă anterior. În total, șase din cei 31 de taxoni au prezentat o valoare indicatoare semnificativă (P < 0,05) (etichetați cu asterisc în figura 6). Grupul 1 (neutru și rece) a prezentat cel mai mare număr de specialiști cu linii de Methanosaeta, Methanolobus și Methanomethylovorans. Methanobacterium a servit ca taxon specialist în grupul 2 (rece și acid), în timp ce Methanolinea a fost identificat ca specialist în grupul 4 (neutru și cald), dar a fost observat cu greu în alte grupuri. În plus, Methanoregula este reprezentată în mare măsură în grupa 3 acidă și moderată.
Limitarea dispersiei
O analiză de regresie liniară (R2= 0,05, P < 0,001) a indicat o corelație slabă între distanța geografică și structura comunității metanogenice pe setul de date globale. În același timp, un test Mantel a arătat că variabilele de mediu au o corelație mai mare cu structura comunității decât distanțele geografice (a se vedea tabelul 3). Această tendință este, de asemenea, confirmată de un test Mantel parțial care controlează efectele autocorelației. Reprezentarea grafică a distanței geografice față de similaritatea Jaccard a comunității nu arată o tendință liniară clară, ci modele care rezultă în principal din distribuția globală a punctelor de eșantionare (a se vedea figura suplimentară S4).

TABEL 3. Analizele testului Mantel și testul Mantel parțial pentru determinarea influenței variabilelor de mediu și a distanței geografice asupra distribuției microbiene pentru setul de date global și un subeșantion de 16 eșantioane europene.
Pentru a analiza în continuare influența dispersiei, am limitat analiza noastră la Europa, care a fost eșantionată cel mai dens și mai uniform. Testele Mantel și testele Mantel parțiale pe acest subset au reprodus tendința conform căreia datele privind comunitățile sunt mai mult corelate cu variabilele de mediu decât cu distanțele geografice (a se vedea tabelul 3). Testul Mantel parțial care controlează variabilele de mediu nu a putut detecta nicio corelație semnificativă din punct de vedere statistic între comunitatea microbiană și distanța geografică. O analiză spațială PCA pe aceste 16 situri europene implică o structură spațială a comunității metanogene (23,7 % din varianța totală a fost explicată de această structură), ceea ce corespunde unei autocorelații spațiale pozitive a siturilor, după cum indică indicele Moran’s I (Moran’s I = 0,4018). Doar prima valoare proprie a fost stabilă și a corespuns unei separări a eșantioanelor între Europa Centrală și statele baltice (Figura suplimentară S5). Cu toate acestea, setul mic de date complică o atribuire robustă a acestei structuri spațiale observate la variabile geografice, de mediu sau la ambele. Prin urmare, am efectuat o analiză de grupare a comunităților metanogene, așa cum am descris mai sus, și am evidențiat trei grupuri (figura 7A) pe care le-am proiectat pe o hartă geografică (figura 7B). Gruparea nu a reprodus separarea din PCA spațială de-a lungul Mării Baltice. În consecință, unele situri care sunt foarte apropiate din punct de vedere geografic prezintă structuri diferite ale comunităților metanogene și se reunesc cu grupuri diferite. Pe de altă parte, unele situri foarte îndepărtate din punct de vedere geografic prezintă compoziții comunitare foarte asemănătoare și se grupează împreună (figura 7B). Dispersia regională a grupurilor din Europa nu pare să corespundă sau să fie limitată de o structură geografică.
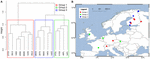
FIGURA 7. Analiza grupelor ierarhice a matricei distanței Jaccard între 16 probe europene de sol și sedimente lacustre. Metoda de clusterizare Ward a fost utilizată pentru analiză. Siturile au fost împărțite în trei grupuri colorate prin dreptunghiuri diferite în dendrograma de clusterizare (A) și au fost proiectate pe o hartă europeană (B).
Discuție
Identificarea și aplicarea conceptelor de biogeografie asupra comunităților microbiene este de interes major în ecologia microbiană. Se consideră că biogeografia microbiană este guvernată de interacțiunea evolutivă și ecologică a patru procese majore: filtrarea habitatului, dispersia, deriva și mutația (Hanson et al., 2012). Chiar dacă influența derivei și a mutației este dincolo de puterea de interpretare a acestui studiu, arătăm că există modele globale ale comunităților metanogene în mediile naturale. Acest studiu demonstrează un model biogeografic global al comunităților metanogene care este asociat mai mult cu filtrarea habitatelor decât cu dispersia geografică. Comunitățile metanogene din sedimentele lacurilor de sodă, de exemplu, se grupează îndeaproape cu eșantioane marine îndepărtate din punct de vedere geografic (figura 4), iar comunități metanogene foarte asemănătoare apar în sedimentele europene de sol și de lac, în ciuda faptului că sunt situate la distanțe mari între ele (figura 7). În general, încercările noastre de a dezvălui o potențială limitare a dispersiei au relevat o influență slabă a locației geografice asupra structurii comunităților metanogene, care contrastează cu o influență clară a condițiilor de mediu. O excludere concludentă a efectelor spațiale asupra comunităților microbiene nu este posibilă cu punctele de date disponibile. Punctele de eșantionare se concentrează pe anumite habitate și/sau zone, în timp ce numărul total de probe este scăzut. În cazul în care există un efect, presupunem că efectele spațiale apar doar la scară regională sau locală. Au fost raportate limitări locale ale dispersiei pentru archaea hipertermofilă cauzate de bariere geografice (Whitaker et al., 2003), pentru bacteriile care oxidează amoniacul la nivelul mlaștinilor sărate locale, dar nu la scară regională și continentală (Martiny et al., 2011), pentru microorganismele din sedimentele de mare adâncime împreună cu setările de mediu (Schauer et al., 2009), precum și pentru bacteriile dintr-un set mare de medii de zăpadă eterogene, cauzate în principal de disponibilitatea carbonului alohton (Lutz et al., 2016). O influență minoră a limitării dispersiei asupra metanogenilor în mediile naturale înseamnă că metanogenii se pot distribui aleatoriu în spațiu, sunt selectați cu succes de mediul local dacă cerințele lor fiziologice sunt îndeplinite și pot stabili comunități stabile (Martiny et al., 2006; von Mering et al., 2007).
Conceptul de filtrare a habitatului implică faptul că speciile cu cerințe ecologice similare ar trebui să se întâlnească împreună mai des decât se așteaptă din întâmplare (Weiher și Keddy, 2001; Cornwell et al., 2006; Ulrich et al., 2010). Rezultatul nostru arată că există diferențe mari în ceea ce privește compoziția comunităților metanogene între ecosistemele marine și cele din zonele umede și lacuri, în timp ce estuarele se grupează între ele. Modele biogeografice bazate pe un set de studii genetice pe probe de mediu au fost, de asemenea, raportate pentru bacteriile generale (Nemergut et al., 2011), microbiomul infiltrațiilor de metan (Ruff et al., 2015), archaea care oxidează amoniacul (Cao et al., 2013), bacteriile marine pelagice și bentonice (Zinger et al., 2011) și microorganismele care reciclează azotul (Church et al., 2008). Filtrarea habitatelor a fost raportată în mod specific pentru archaea necultivată (Auguet et al., 2010), pentru comunități întregi de bacterii în medii diverse (von Mering et al., 2007; Chaffron et al., 2010) sau în turbăriile sud-americane la scară regională (Oloo et al., 2016), precum și grupuri bacteriene specifice, cum ar fi bacteriile care oxidează metanul (Knief, 2015) și cele care fixează azotul (Nelson et al., 2016).
Rezultatele noastre indică faptul că, la scară globală, salinitatea reglează substanțial compoziția comunității metanogene și determină diferențe mari între ansamblurile metanogene marine și terestre. De asemenea, metanogenii din sedimentele lacurilor de sodă se grupează cu cei din sedimentele marine (Figura 4), subliniind influența globală a salinității. Acest rezultat este în concordanță cu alte studii bazate pe gena ARNr 16S, care dezvăluie faptul că salinitatea este un factor principal care modelează modelele globale ale comunităților bacteriene și arheologice globale (Lozupone și Knight, 2007; Auguet et al., 2010; Caporaso et al., 2011; Cao et al., 2013). O influență scăzută a separării geografice, dar un impact puternic al salinității asupra comunităților microbiene generale a fost, de asemenea, observată în studiile anterioare (Logares et al., 2013; Yang et al., 2016). În consecință, salinitatea determină în mare măsură ce linii genetice pot supraviețui. În diverse habitate, activitatea de producere a metanului a fost corelată negativ cu salinitatea (Bartlett et al., 1987; Potter et al., 2009; Poffenbarger et al., 2011). Astfel, se sugerează că inhibarea producției de metan prin salinitate coincide cu o dimensiune redusă a populației metanogene (Pattnaik et al., 2000). Efectul salinității asupra metanogenezei hidrogenotrofe, acetotrofe și metilotrofe depinde, astfel, de nivelul de salinitate și este diferit pentru diferitele căi de metanogeneză (Liu et al., 2016). În prezent, nu există un mecanism clar care să explice impactul salinității asupra structurii comunității, dar mai multe ipoteze pot servi drept posibile explicații. Din punct de vedere fiziologic, salinitatea influențează osmolaritatea externă și internă a celulelor. Celulele metanogene nesalinizate au dezvoltat adaptări fiziologice pentru a contracara presiunea turgescenței interne, în timp ce celulele adaptate la sare au pierdut această caracteristică (Zinder, 1993). În plus, creșterea salinității poate induce metanogenele să sintetizeze sau să absoarbă o proporție crescută de soluturi compatibili, cu un cost energetic și, prin urmare, metabolic semnificativ (McGenity, 2010). Trăsătura de toleranță la sare se manifestă chiar și în concentrația optimă de NaCl pentru creșterea culturilor pure de metanogene, deoarece am constatat că izolatele din sedimentele marine și sedimentele hidrotermale au o concentrație optimă de NaCl semnificativ mai mare decât cele din soluri (Figura suplimentară S2).
În ecosistemele terestre nesaline, în special în soluri și sedimente lacustre, compoziția comunității metanogene este controlată de combinația dintre temperatură și pH. În consecință, metanogenii din aceste medii ar putea fi clasificați în patru grupe (figura 6). Spre deosebire de ecosistemele marine, ecosistemele terestre nesaline prezintă o mare variabilitate naturală atât a pH-ului, cât și a temperaturii. Temperatura poate afecta nu numai calea metanogenică, ci și populațiile metanogene în sine (Conrad, 2007; Rooney-Varga et al., 2007). Producția de metan poate fi mult îmbunătățită dacă temperaturile cresc, ca o consecință a etapelor sensibile la temperatură din timpul fermentației și acetogenezei (Megonigal et al., 2005; Kotsyurbenko et al., 2007). În plus, un pH scăzut poate limita substanțial disponibilitatea acetatului prin împiedicarea disocierii acetatului și, astfel, poate afecta negativ metanogeneza acetoclastică (Fukuzaki et al., 1990; Bridgham et al., 2013). Acesta ar putea fi un posibil motiv pentru care Methanosaeta a fost absentă în grupul2, în timp ce Methanosarcina poate trece de la o sursă la alta și nu a fost influențată în mod substanțial. Mai mult, pH-ul poate regla eficiența producției de metan și a căilor metanogenetice de la turbăriile ombrotrofe la cele minerotrofe, prin inhibarea directă a ambelor căi de metanogeneză și indirect prin efectele sale asupra fermentației (Ye et al., 2012). Prin urmare, atât temperatura, cât și pH-ul pot regla direct sau indirect etapele metabolice asociate cu metanogeneza și fermentația din amonte, care furnizează substrat pentru metanogeni.
Methanoregula este omniprezentă și foarte abundentă în toate cele patru grupe de habitate terestre (Figura 6), dar practic absentă din sistemul marin și, prin urmare, se poate dovedi a fi un proxy pentru influența apei dulci în domeniul marin. Relevanța sa globală a fost raportată recent în altă parte (Yang et al., 2017). În ciuda distribuției sale omniprezente în soluri și sedimente lacustre, Methanoregula apare ca un neam indicator în habitatele acide cu temperaturi moderate. Mai mult, (1) Methanolinea pare să se fi adaptat în special la mediile terestre calde și neutre, (2) Methanobacterium la mediile reci și acide, iar (3) Methanosaeta la mediile cu pH neutru, ceea ce este în concordanță cu alte studii (Rosenberg et al., 2014) și subliniază robustețea abordării noastre. În general, condițiile geochimice care înconjoară comunitățile metanogene vor conduce la diferențierea nișei. Deoarece sortarea nișei tinde să lase specialiștii adaptativi (Langenheder și Székely, 2011), selecția progresivă a mediului pe termen lung a generat o varietate de nișe care au fost ocupate de o serie de specialiști endemici ai habitatului, care pot fi mai puțin reprezentați sau absenți în alte condiții de mediu diferite. Comunitatea este, de asemenea, modelată de factori biotici, cum ar fi interacțiunile ecologice, dinamica, concurența și simbioza. În ciuda acestor factori biologici, von Mering et al. (2007) au constatat că preferințele de habitat sunt adesea remarcabil de stabile în timp, iar compoziția taxonomică distinctivă a comunităților de mediu, la rândul său, poate fi un indicator important al ecologiei și funcției acestora.
În concordanță cu preferința de habitat a archaea metanogene, se pare că tulpinile metanogene strâns înrudite au fost adesea izolate din medii comparabile. De exemplu, Methanoregulaceae pare să fie destul de diversă în mediile naturale (Yang et al., 2017), iar tulpinile neutre pot rezista până acum la cultivare. Tulpinile de Methanoregula descrise în prezent sunt ambele obținute din medii ușor acidofile, în timp ce cei doi reprezentanți ai Methanolinea provin din habitate relativ calde, cum ar fi nămolul de digestie și, respectiv, solul câmpurilor de orez (Rosenberg et al., 2014). Deși tulpinile de Methanobacterium au fost izolate din medii diferite, aproximativ jumătate dintre izolatele existente ale acestui gen prezintă valori optime ale pH-ului ușor mai mici de 7. Acest lucru înseamnă că liniile indicatoare, care au fost identificate pe baza secvențelor de mediu, ar putea reflecta diferențierile de fiziologie și surse ale culturilor metanogene existente. De exemplu, salinitatea habitatului, ca o proprietate generală a habitatului, poate expune progresiv organismele la o selecție puternică a mediului și poate filtra asamblarea unui nou set de specii care sunt cele mai potrivite pentru salinitatea ambientală (Logares et al., 2013).
Conservarea și gestionarea biodiversității reprezintă o provocare principală a societății noastre actuale. Aici arătăm că archaea metanogenă din mediile naturale este cea mai diversă în sedimentele de estuar. Estuarele sunt zone de tranziție între ecosistemele marine și cele terestre. Acest lucru permite existența a două procese majore care pot contribui la bogăția speciilor. În primul rând, microbii din mare și de pe uscat se amestecă în estuare și, în cele din urmă, cuprind o diversitate generală ridicată (McLusky și Elliott, 2004). De exemplu, a fost observată o mare diversitate de bacterii, archaea, ciuperci și chiar bacterii specifice care îndeplinesc funcții unice în estuare (Cunliffe et al., 2008; Mosier și Francis, 2008; Crump et al., 2012). Un alt aspect este nivelul ridicat de nutrienți datorat aporturilor terestre, provenite din maree, cu care se hrănesc organismele din estuar (McLusky și Elliott, 2004; Statham, 2012). În acest context, mediile estuariene sunt importante în recuperarea noutăților generice pentru metanogeni. Până în prezent, efectele diversității speciilor asupra proceselor ecosistemice au atras eforturi de cercetare substanțiale. Legătura dintre biodiversitate și funcția ecosistemică este încă în dezbatere și rămâne evazivă pentru comunitățile microbiene (Loreau et al., 2001; Tilman et al., 2014). Chiar dacă solurile și sedimentele lacustre sunt surse primare de metan și, de asemenea, habitate cu o diversitate metanogenică ridicată, propunem că bogăția speciilor nu este un indicator adecvat al potențialului de producție de metan și al emisiilor de metan din ecosisteme; mai degrabă pare să reflecte eterogenitatea și istoria mediului. Clasificarea mediilor în funcție de bogăția de specii nu înseamnă neapărat potențialul ratelor de emisie de metan, care sunt cele mai ridicate din soluri și lacuri și comparabil mai mici din estuare (Figura 3 și Figura suplimentară S1).
În cele din urmă, este posibil ca lipsa informațiilor de mediu din bazele de date publice să fi împiedicat o interpretare completă privind factorii de mediu observați aici. Chiar dacă în literatura de specialitate și în bazele de date publice există din ce în ce mai multe date de secvențiere despre metanogeni, variabilele abiotice aferente furnizate sunt adesea incoerente și rare. Cantitatea limitată de informații consistente pentru variabilele de mediu constrânge aplicarea analizelor statistice cu mai multe variabile. Amintirea faptului că factorii abiotici din acest studiu pot explica doar o fracțiune limitată din variațiile comunității sugerează că lipsesc alte variabile explicative. De o importanță deosebită ar putea fi concentrațiile și disponibilitatea substraturilor metanogene, cum ar fi acetatul, hidrogenul și metilaminele. Cu toate acestea, este posibil ca parametrii abiotici să nu fie niciodată suficienți pentru a explica pe deplin ceea ce structurează ansamblurile metanogene, din simplul motiv că habitatele au istorii diferite și pot fi studiate doar la nivel local. De asemenea, printre datele mcrA disponibile, zonele vaste din Subarctica și Arctica rusă și canadiană sunt slab reprezentate. O mai bună acoperire geografică și o distribuție uniformă a setului de date privind genele mcrA ar îmbunătăți o evaluare a comunităților metanogene la scară globală.
Contribuții ale autorilor
SL și XW au conceput studiul. XW și SY au colectat și analizat datele. XW, SY și FH au efectuat analiza statistică. XW, MW și SY au efectuat corecția filogenetică. XW, SY, FH, MW, DW și SL au interpretat rezultatele și au redactat lucrarea. Toți autorii au contribuit la discuții și au revizuit manuscrisul.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Sprijinul financiar acordat lui XW (grantul nr. 201408620031 pentru XW) oferit de China Scholarship Council (CSC) este recunoscut cu recunoștință. Acest studiu a fost sprijinit de Helmholtz Gemeinschaft (HGF) prin finanțarea Helmholtz Young Investigators Group of SL (VH-NG-919).
Supplementary Material
Materialul suplimentar pentru acest articol poate fi găsit online la adresa: Helmholtz Young Investigators Group of SL (VH-NG-919): https://www.frontiersin.org/article/10.3389/fmicb.2017.01339/full#supplementary-material
Notele de subsol
- ^ http://metanogen.biotech.uni.wroc.pl/
- ^ http://www.ncbi.nlm.nih.gov/
- ^ http://metanogen.biotech.uni.wroc.pl/
- ^ https://www.ngdc.noaa.gov/mgg/shorelines/gshhs.html
- ^ http://qgis.osgeo.org
Auguet, J. C., Barberan, A., și Casamayor, E. O. (2010). Modele ecologice globale în Archaea necultivată. ISME J. 4, 182-190. doi: 10.1038/ismej.2009.109
PubMed Abstract | Full CrossRef Text | Google Scholar
Bange, H. W., Bartell, U. H., Rapsomanikis, S., și Andreae, M. O. (1994). Methane in the Baltic and North Seas and a reassessment of the marine emissions of methane (Metan în Marea Baltică și Marea Nordului și o reevaluare a emisiilor marine de metan). Glob. Biogeochem. Cycles 8, 465-480. doi: 10.1029/94GB02181
CrossRef Full Text | Google Scholar
Barreto, D. P., Conrad, R., Klose, M., Claus, P., și Enrich-Prast, A. (2014). Relații de decădere a distanței și relații taxon-suprafață pentru bacterii, archaea și archaea metanogenă într-un sediment de lac tropical. PLoS ONE 9:e110128. doi: 10.1371/journal.pone.0110128
PubMed Abstract | Reflect Full Text | Google Scholar
Bartlett, K. B., Bartlett, D. S., Harriss, R. C., and Sebacher, D. I. (1987). Emisiile de metan de-a lungul unui gradient de salinitate a mlaștinilor sărate. Biogeochemistry 4, 183-202. doi: 10.1007/BF02187365
CrossRef Full Text | Google Scholar
Borrel, G., O’Toole, P. W., Harris, H. M. B., Peyret, P., Brugere, J. F., și Gribaldo, S. (2013). Datele filogenomice susțin un al șaptelea ordin de metanogeni metilotrofi și oferă informații despre evoluția metanogenezei. Genome Biol. Evol. 5, 1769-1780. doi: 10.1093/Gbe/Evt128
PubMed Abstract | CrossRef Full Text | Google Scholar
Bousquet, P., Ciais, P., Miller, J., Dlugokencky, E., Hauglustaine, D., Prigent, C., et al. (2006). Contribuția surselor antropice și naturale la variabilitatea metanului atmosferic. Nature 443, 439-443. doi: 10.1038/nature05132
PubMed Abstract | Ref. Full Text | Google Scholar
Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., și Zhuang, Q. (2013). Emisiile de metan din zonele umede: perspective biogeochimice, microbiene și de modelare de la scară locală la scară globală. Glob. Chang. Biol. 19, 1325-1346. doi: 10.1111/gcb.12131
PubMed Abstract | Full CrossRef Text | Google Scholar
Cao, Hao, H., Auguet, J.-C., și Gu, J.-D. (2013). Modelul ecologic global al archaea care oxidează amoniacul. PLoS ONE 8:e52853. doi: 10.1371/journal.pone.0052853
PubMed Abstract | CrossRef Full Text | Google Scholar
Caporaso, J. G., Lauber, C. L., Walters, W. A., Berg-Lyons, D., Lozupone, C. A., Turnbaugh, P. J., et al. (2011). Modele globale de diversitate a ARNr 16S la o adâncime de milioane de secvențe pe eșantion. Proc. Natl. acad. Sci. U.S.A. 108, 4516-4522. doi: 10.1073/pnas.1000080107
PubMed Abstract | CrossRef Full Text | Google Scholar
Chaffron, S., Rehrauer, H., Pernthaler, J., și von Mering, C. (2010). O rețea globală de microbi coexistenți din datele de mediu și din datele de secvență a întregului genom. Genome Res. 20, 947-959. doi: 10.1101/gr.104521.109
PubMed Abstract | Refef Full Text | Google Scholar
Church, M. J., Bjorkman, K. M. M., Karl, D. M., Saito, M. A. și Zehr, J. P. (2008). Distribuția regională a bacteriilor fixatoare de azot în Oceanul Pacific. Limnol. Oceanogr. 53, 63-77. doi: 10.4319/lo.2008.53.1.0063
CrossRef Full Text | Google Scholar
Conrad, R. (2007). „Microbial ecology of methanogens and methanotrophs”, în Advances in Agronomy, Ed. L. S. Donald (Cambridge, MA: Academic Press), 1-63.
Google Scholar
Cornwell, W. K., Schwilk, D. W., și Ackerly, D. D. D. (2006). Un test bazat pe trăsături pentru filtrarea habitatului: volumul convex hull. Ecology 87, 1465-1471. doi: 10.1890/0012-9658(2006)872.0.CO;2
PubMed Abstract | CrossRef Full Text | Google Scholar
Crump, B. C., Amaral-Zettler, L. A. și Kling, G. W. (2012). Diversitatea microbiană în apele dulci arctice este structurată prin inocularea de microbi din soluri. ISME J. 6, 1629-1639. doi: 10.1038/ismej.2012.9
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, M., Ma, A., Qi, H., Zhuang, X., Zhuang, G., și Zhao, G. (2015). Temperatura mai caldă accelerează emisiile de metan din zona umedă Zoige de pe platoul tibetan fără a schimba compoziția comunității metanogene. Sci. Rep. 5:11616. doi: 10.1038/srep11616
PubMed Abstract | Full Text | Google Scholar
Cunliffe, M., Schafer, H., Harrison, E., Cleave, S., Upstill-Goddard, R., și Murrell, J. C. (2008). Phylogenetic and functional gene analysis of the bacterial and archaeal communities associated with the surface microlayer of an estuary. ISME J. 2, 776-789. doi: 10.1038/ismej.2008.28
PubMed Abstract | Ref Full Text | Google Scholar
Dray, S., and Dufour, A. B. (2007). Pachetul ade4: implementarea diagramei de dualitate pentru ecologiști. J. Stat. Softw. 22, 1-20. doi: 10.18637/jss.v022.i04
CrossRef Full Text | Google Scholar
Dufrene, M., și Legendre, P. (1997). Ansambluri de specii și specii indicatoare: necesitatea unei abordări asimetrice flexibile. Ecol. Monogr. 67, 345-366. doi: 10.2307/2963459
CrossRef Full Text | Google Scholar
Edgar, R. C., Haas, B. J., Clemente, J. C., Quince, C., și Knight, R. (2011). UCHIME îmbunătățește sensibilitatea și viteza de detectare a chimera. Bioinformatics 27, 2194-2200. doi: 10.1093/bioinformatics/btr381
PubMed Abstract | Reflect Full Text | Google Scholar
Evans, P. N., Parks, D. H., Chadwick, G. L., Robbins, S. J., Orphan, V. J., Golding, S. D., et al. (2015). Metabolismul metanului în phylum-ul arheal Bathyarchaeota dezvăluit de metagenomica genom-centrică. Science 350, 434-438. doi: 10.1126/science.aac7745
PubMed Abstract | Text integral | Google Scholar
Fish, J. A., Chai, B., Wang, Q., Sun, Y., Brown, C. T., Tiedje, J. M., et al. (2013). FunGene: the functional gene pipeline and repository. Front. Microbiol. 4:291. doi: 10.3389/fmicb.2013.00291
PubMed Abstract | Ref Full Text | Google Scholar
Frank-Fahle, B. A., Yergeau, E., Greer, C. W., Lantuit, H., și Wagner, D. (2014). Potențialul funcțional microbian și compoziția comunității în solurile afectate de permafrost din nord-vestul Arcticii canadiene. PLoS ONE 9:e84761. doi: 10.1371/journal.pone.0084761.g001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fukuzaki, S., Nishio, N., și Nagai, S. (1990). Cinetica fermentării metanogene a acetatului. Appl. Environ. Microbiol. 56, 3158-3163.
Google Scholar
Hanson, C. A., Fuhrman, J. A., Horner-Devine, M. C., și Martiny, J. B. (2012). Dincolo de modelele biogeografice: procese care modelează peisajul microbian. Nat. Rev. Microbiol. 10, 497-506. doi: 10.1038/Nrmicro2795
PubMed Abstract | Full CrossRef Text | Google Scholar
Holm, G. O., Perez, B. C., McWhorter, D. E., Krauss, K. W., Johnson, D. J., Raynie, R. C., et al. (2016). Fluxurile de metan la nivel de ecosistem din mlaștinile de apă dulce și salmastră cu maree din Delta râului Mississippi: implicații pentru proiectele de carbon din zonele umede de coastă. Wetlands 36, 401-413. doi: 10.1007/s13157-016-0746-7
CrossRef Full Text | Google Scholar
Hunger, S., Schmidt, O., Hilgarth, M., Horn, M. A., Kolb, S., Conrad, R., et al. (2011). Competing formate- and carbon dioxide-utilizing prokaryotes in an anoxic methane-emitting fen soil. Appl. Environ. Microbiol. 77, 3773-3785. doi: 10.1128/AEM.00282-11
PubMed Abstract | Full Text | Google Scholar
IPCC (2007). „Climate Change 2007: the Physical Science Basis”, în Proceedings of the Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change, eds D. Qin, S. Solomon, M. Manning, Z. Chen, M. Marquis, K. B. Averyt, et al. (Cambridge: Cambridge University Press).
Google Scholar
Jabłoński, S., Rodowicz, P., și Łukaszewicz, M. (2015). Methanogenic archaea database containing physiological and biochemical characteristics. Int. J. Syst. Evol. microbiol. microbiol. 65, 1360-1368. doi: 10.1099/ijs.0.000065
PubMed Abstract | CrossRef Full Text | Google Scholar
Kirschke, S., Bousquet, P., Ciais, P., Saunois, M., Canadell, J. G., Dlugokencky, E. J., et al. (2013). Trei decenii de surse și puțuri de metan la nivel mondial. Nat. Geosci. 6, 813-823. doi: 10.1038/Ngeo1955
CrossRef Full Text | Google Scholar
Knief, C. (2015). Diversitatea și preferințele de habitat ale bacteriilor metanotrofe aerobe cultivate și necultivate evaluate pe baza pmoA ca marker molecular. Front. Microbiol. 6:1346. doi: 10.3389/fmicb.2015.01346
PubMed Abstract | CrossRef Full Text | Google Scholar
Kotsyurbenko, O., Friedrich, M., Simankova, M., Nozhevnikova, A., Golyshin, P., Timmis, K., et al. (2007). Trecerea de la metanogeneza acetoclastică la metanogeneza dependentă de H2 într-o turbărie din Siberia de Vest la valori scăzute ale pH-ului și izolarea unei tulpini acidofile de Methanobacterium. Appl. Environ. Microbiol. 73, 2344-2348. doi: 10.1128/AEM.02413-06
PubMed Abstract | Text integral | Google Scholar
Langenheder, S., și Székely, A. J. (2011). Sortarea speciilor și procesele neutre sunt ambele importante în timpul asamblării inițiale a comunităților bacteriene. ISME J. 5, 1086-1094. doi: 10.1038/ismej.2010.207
PubMed Abstract | CrossRef Full Text | Google Scholar
Liebner, S., Ganzert, L., Kiss, A., Yang, S., Wagner, D., și Svenning, M. M. (2015). Shifts in methanogenic community composition and methane fluxes along the degradation of discontinuous permafrost. Front. Microbiol. 6:356. doi: 10.3389/fmicb.2015.00356
PubMed Abstract | Full CrossRef Text | Google Scholar
Liu, Y. Q., Priscu, J. C., Xiong, J. B., Conrad, R., Vick-Majors, T., Chu, H. Y., et al. (2016). Salinitatea conduce modelele de distribuție arheală în sedimentele lacurilor de mare altitudine de pe platoul tibetan. FEMS Microbiol. Ecol. 92:fiw033. doi: 10.1093/femsec/fiw033
PubMed Abstract | Full CrossRef Text | Google Scholar
Logares, R., Lindstrom, E. S., Langenheder, S., Logue, J. B., Paterson, H., Laybourn-Parry, J., et al. (2013). Biogeografia comunităților bacteriene expuse la schimbări progresive de mediu pe termen lung. ISME J. 7, 937-948. doi: 10.1038/ismej.2012.168
PubMed Abstract | CrossRef Full Text | Google Scholar
Loreau, M., Naeem, S., Inchausti, P., Bengtsson, J., Grime, J. P., Hector, A., et al. (2001). Biodiversitatea și funcționarea ecosistemelor: cunoștințe actuale și provocări viitoare. Science 294, 804-808. doi: 10.1126/science.1064088
PubMed Abstract | Full CrossRef Text | Google Scholar
Lozupone, C. A., și Knight, R. (2007). Modele globale în diversitatea bacteriană. Proc. Natl. acad. Sci. U.S.A. 104, 11436-11440. doi: 10.1073/pnas.0611525104
PubMed Abstract | CrossRef Full Text | Google Scholar
Luton, P. E., Wayne, J. M., Sharp, R. J., și Riley, P. W. (2002). The mcrA gene as an alternative to 16S rRNA in the phylogenetic analysis of methanogen populations in landfill. Microbiology 148, 3521-3530. doi: 10.1099/00221287-148-11-3521
PubMed Abstract | Refef Full Text | Google Scholar
Lutz, S., Anesio, A. M., Raiswell, R., Edwards, A., Newton, R. J., Gill, F., et al. (2016). Biogeografia microbiomilor de zăpadă roșie și rolul lor în topirea ghețarilor arctici. Nat. Commun. 7:11968. doi: 10.1038/ncomms11968
PubMed Abstract |Ref Full Text | Google Scholar
Martiny, J. B. H., Bohannan, B. J. M., Brown, J. H., Colwell, R. K., Fuhrman, J. A., Green, J. L., et al. (2006). Microbial biogeography: putting microorganisms on the map. Nat. Rev. Microbiol. 4, 102-112. doi: 10.1038/Nrmicro1341
PubMed Abstract | Refef Full Text | Google Scholar
Martiny, J. B. H., Eisen, J. A., Penn, K., Allison, S. D., și Horner-Devine, M. C. (2011). Factorii determinanți ai diversității beta bacteriene depind de scara spațială. Proc. Natl. acad. Sci. U.S.A. 108, 7850-7854. doi: 10.1073/pnas.1016308108
PubMed Abstract | CrossRef Full Text | Google Scholar
McArdle, B. H., și Anderson, M. J. (2001). Ajustarea modelelor multivariate la datele comunitare: un comentariu privind analiza redundanței bazate pe distanță. Ecology 82, 290-297. doi: 10.1890/0012-9658(2001)0822.0.CO;2
CrossRef Full Text | Google Scholar
McCalley, C. K., Woodcroft, B. J., Hodgkins, S. B., Wehr, R. A., Kim, E.-H., Mondav, R., et al. (2014). Dinamica metanului reglementată de răspunsul comunității microbiene la dezghețul permafrostului. Nature 514, 478-481. doi: 10.1038/nature13798
PubMed Abstract | Publicitate integrală | Google Scholar
McGenity, T. J. (2010). „Methanogens and Methanogenesis in Hypersaline Environments”, în Handbook of Hydrocarbon and Lipid Microbiology, Ed. K. N. Timmis (Berlin: Springer), 665-680. doi: 10.1007/978-3-540-77587-4_53
CrossRef Full Text | Google Scholar
McLusky, D. S., și Elliott, M. (2004). The Estuarine Ecosystem: Ecology, Threats and Management (Ecologie, amenințări și management). New York, NY: Oxford University Press. doi: 10.1093/acprof:oso/9780198525080.001.0001.0001
CrossRef Full Text | Google Scholar
Megonigal, J. P., Mines, M. E., și Visscher, P. T. (2005). „Anaerobic metabolism: linkages to trace gases and aerobic processes”, în Biogeochemistry, ed. W. H. Schlesinger (Oxford: Elsevier), 350-362.
Google Scholar
Milferstedt, K., Youngblut, N. D., și Whitaker, R. J. (2010). Structura spațială și persistența populațiilor de metanogene în lacurile umice de mlaștină. ISME J. 4, 764-776. doi: 10.1038/Ismej.2010.7
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosier, A. C., și Francis, C. A. (2008). Abundența relativă și diversitatea archaea și bacteriile care oxidează amoniacul în estuarul Golfului San Francisco. Environ. Microbiol. 10, 3002-3016. doi: 10.1111/j.1462-2920.2008.01764.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Nazaries, L., Murrell, J. C., Millard, P., Baggs, L., și Singh, B. K. (2013). Metan, microbi și modele: înțelegerea fundamentală a ciclului metanului din sol pentru predicții viitoare. Environ. Microbiol. 15, 2395-2417. doi: 10.1111/1462-2920.12149
PubMed Abstract | Full Text | Google Scholar
Nelson, M. B., Martiny, A. C., și Martiny, J. B. H. (2016). Biogeografia globală a trăsăturilor microbiene de reciclare a azotului în sol. Proc. Natl. acad. Sci. U.S.A. 113, 8033-8040. doi: 10.1073/pnas.1601070113
PubMed Abstract | CrossRef Full Text | Google Scholar
Nemergut, D. R., Costello, E. K., Hamady, M., Lozupone, C., Jiang, L., Schmidt, S. K., et al. (2011). Modele globale în biogeografia taxonului bacterian. Environ. Microbiol. 13, 135-144. doi: 10.1111/j.1462-2920.2010.02315.x
PubMed Abstract | Reflect Full Text | Google Scholar
Nobu, M. K., Narihiro, T., Kuroda, K., Mei, R., și Liu, W. T. (2016). Chasing the elusive Euryarchaeota class WSA2: genomes reveal a uniquely fastidious methyl-reducing methanogen. ISME J. 10, 2478-2487. doi: 10.1038/ismej.2016.33
PubMed Abstract | Refef Full Text | Google Scholar
Oksanen, J., Blanchet, F. G., Kindt, R., Legendre, P., Minchin, P. R., O’Hara, R. B., et al. (2015). vegan: Community Ecology Package (Pachet de ecologie comunitară). R Package Version 2.2.0. Disponibil la: https://CRAN.R-project.org/package=vegan
Google Scholar
Oloo, F., Valverde, A., Quiroga, M. V., Vikram, S., Cowan, D., și Mataloni, G. (2016). Heterogenitatea habitatelor și conectivitatea modelează comunitățile microbiene în turbăriile din America de Sud. Sci. Rep. 6:25712. doi: 10.1038/srep25712
PubMed Abstract | Full CrossRef Text | Google Scholar
Pattnaik, P., Mishra, S. R., Bharati, K., Mohanty, S. R., Sethunathan, N. și Adhya, T. K. (2000). Influența salinității asupra metanogenezei și a microflorei asociate în solurile tropicale de orez. Microbiol. Res. 155, 215-220. doi: 10.1016/S0944-5013(00)80035-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Poffenbarger, H. J., Needelman, B. A., și Megonigal, J. P. (2011). Influența salinității asupra emisiilor de metan din mlaștinile cu maree. Wetlands 31, 831-842. doi: 10.1007/s13157-011-0197-0
PubMed Abstract | Text integral | Google Scholar
Potter, E. G., Bebout, B. M., și Kelley, C. A. (2009). Compoziția izotopică a metanului și a substraturilor metanogene deduse de-a lungul unui gradient de salinitate într-un sistem de covor microbian hipersalin. Astrobiology 9, 383-390. doi: 10.1089/ast.2008.0260
PubMed Abstract | Textul integral | Google Scholar
R Core Team (2014). R: A Language and Environment for Statistical Computing (Versiunea 3.0.3). Viena: R Foundation for Statistical Computing.
Google Scholar
Roberts, D. (2016). labdsv: Ordonare și analiză multivariată pentru ecologie. R Package Version 1.8-0. Disponibil la: https://CRAN.R-project.org/package=labdsv
Google Scholar
Rooney-Varga, J. N., Giewat, M. W., Duddleston, K. N., Chanton, J. P., și Hines, M. E. (2007). Legături între structura comunității arheologice, tipul de vegetație și calea metanogenică în turbăriile din Alaska. FEMS Microbiol. Ecol. 60, 240-251. doi: 10.1111/j.1574-6941.2007.00278.x
PubMed Abstract | Cross Full Text | Google Scholar
Rosenberg, E., DeLong, E. F., Lory, S., Stackebrandt, E., și Thompson, F. (2014). The Prokaryotes: Other Major Lineages of Bacteria and the Archaea. Berlin: Springer.
Google Scholar
Ruff, S. E., Biddle, J. F., Teske, A. P., Knittel, K., Boetius, A., și Ramette, A. (2015). Dispersia globală și diversificarea locală a microbiomului infiltrațiilor de metan. Proc. Natl. acad. Sci. U.S.A. 112, 4015-4020. doi: 10.1073/pnas.1421865112
PubMed Abstract | CrossRef Full Text | Google Scholar
Schauer, R., Bienhold, C., Ramette, A., și Harder, J. (2009). Bacterial diversity and biogeography in deep-sea surface sediments of the South Atlantic Ocean. ISME J. 4, 159-170. doi: 10.1038/ismej.2009.106
PubMed Abstract | Full CrossRef Text | Google Scholar
Schloss, P. D., Westcott, S. L., Ryabin, T., Hall, J. R., Hartmann, M., Hollister, E. B., et al. (2009). Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities. Appl. Environ. Microbiol. 75, 7537-7541. doi: 10.1128/Aem.01541-09
PubMed Abstract | Full CrossRef Text | Google Scholar
Statham, P. J. (2012). Nutrienți în estuare – o prezentare generală și impactul potențial al schimbărilor climatice. Sci. Total Environ. 434, 213-227. doi: 10.1016/j.scitotenv.2011.09.088
PubMed Abstract | CrossRef Full Text | Google Scholar
Thauer, R. K., Kaster, A.-K., Seedorf, H., Buckel, W., și Hedderich, R. (2008). Archaea metanogenă: diferențe relevante din punct de vedere ecologic în conservarea energiei. Nat. Rev. Microbiol. 6, 579-591. doi: 10.1038/Nrmicro1931
PubMed Abstract | Full CrossRef Text | Google Scholar
Tilman, D., Isbell, F. și Cowles, J. M. (2014). Biodiversitatea și funcționarea ecosistemelor. Annu. Rev. Ecol. Evol. sist. sist. 45, 471-493. doi: 10.1146/annurev-ecolsys-120213-091917
CrossRef Full Text | Google Scholar
Ulrich, W., Hajdamowicz, I., Zalewski, M., Stañska, M., Ciurzycki, W., și Tykarski, P. (2010). Sortimentul de specii sau filtrarea habitatului: un studiu de caz al comunităților de păianjeni de pe insulele lacurilor. Ecol. Res. 25, 375-381. doi: 10.1007/s11284-009-0661-y
CrossRef Full Text | Google Scholar
Vanwonterghem, I., Evans, P. N., Parks, D. H., Jensen, P. D., Woodcroft, B. J., Hugenholtz, P., et al. (2016). Metanogeneza metiltrofică descoperită în phylum arheal Verstraetearchaeota. Nat. Microbiol. 1:16170. doi: 10.1038/nmicrobiol.2016.170
PubMed Abstract | CrossRef Full Text | Google Scholar
von Mering, C., Hugenholtz, P., Raes, J., Tringe, S. G., Doerks, T., Jensen, L. J., et al. (2007). Evaluarea filogenetică cantitativă a comunităților microbiene în diverse medii. Science 315, 1126-1130. doi: 10.1126/science.1133420
PubMed Abstract | Full CrossRef Text | Google Scholar
Wagner, D., și Liebner, S. (2009). „Global warming and carbon dynamics in permafrost soils: methane production and oxidation”, în Permafrost Soils, Ed. R. Margesin (Berlin: Springer), 219-236.
Google Scholar
Weiher, E., și Keddy, P. (2001). Reguli de asamblare ecologică: Perspectives, Advances, Retreats (Perspective, progrese, retrageri). Cambridge: Cambridge University Press.
Google Scholar
Whitaker, R. J., Grogan, D. W., și Taylor, J. W. (2003). Barierele geografice izolează populațiile endemice de archaea hipertermofilă. Science 301, 976-978. doi: 10.1126/science.1086909
PubMed Abstract | Full CrossRef Text | Google Scholar
Wickham, H. (2009). ggplot2: Elegant Graphics for Data Analysis (Grafică elegantă pentru analiza datelor). New York, NY: Springer-Verlag. doi: 10.1007/978-0-387-98141-3
CrossRef Full Text | Google Scholar
Yang, J., Ma, L. A., Jiang, H., Wu, G., și Dong, H. (2016). Salinitatea modelează diversitatea microbiană și structura comunității în sedimentele de suprafață ale lacurilor Qinghai-Tibetan. Sci. Rep. 6:25078. doi: 10.1038/srep25078
PubMed Abstract | Full CrossRef Text | Google Scholar
Yang, S., Liebner, S., Alawi, M., Ebenhöh, O. și Wagner, D. (2014). Baza de date taxonomice și valoarea cut-off pentru procesarea datelor de pirozecvenție a genei mcrA 454 de către MOTHUR. J. Microbiol. Methods 103, 3-5. doi: 10.1016/j.mimet.2014.05.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, S., Liebner, S., Winkel, M., Alawi, M., Horn, F., Dörfer, C., et al. (2017). Analiza în profunzime a comunităților metanogenice de bază din zonele umede afectate de permafrost de mare altitudine. Soil Biol. Biochem. 111, 66-77. doi: 10.1016/j.soilbio.2017.03.007
CrossRef Full Text | Google Scholar
Ye, R. Z., Jin, Q. S., Bohannan, B., Keller, J. K., McAllister, S. A., și Bridgham, S. D. (2012). pH controls over anaerobic carbon mineralization, the efficiency of methane production, and methanogenic pathways in peatlands across an ombrotrophic-minerotrophic gradient. Soil Biol. Biochem. 54, 36-47. doi: 10.1016/j.soilbio.2012.05.015
CrossRef Full Text | Google Scholar
Zinder, S. H. (1993). „Physiological ecology of methanogens”, în Methanogenesis: Ecology, Physiology, Biochemistry & Genetics, Ed. J. G. Ferry (Boston, MA: Springer), 128-206.
Google Scholar
Zinger, L., Amaral-Zettler, L. A., Fuhrman, J. A., Horner-Devine, M. C., Huse, S. M., Welch, D. B. M., et al. (2011). Global patterns of bacterial beta-diversity in seafloor and seawater ecosystems (Modele globale de beta-diversitate bacteriană în ecosistemele de pe fundul mării și din apa de mare). PLoS ONE 6:e24570. doi: 10.1371/journal.pone.0024570
PubMed Abstract | CrossRef Full Text | Google Scholar
.