În această postare prezentăm carbamații ca o grupare protectoare utilă pentru amine, în special în contextul fabricării peptidelor.
Iată un rezumat rapid a ceea ce vom aborda în această postare, cu mai multe detalii mai jos.
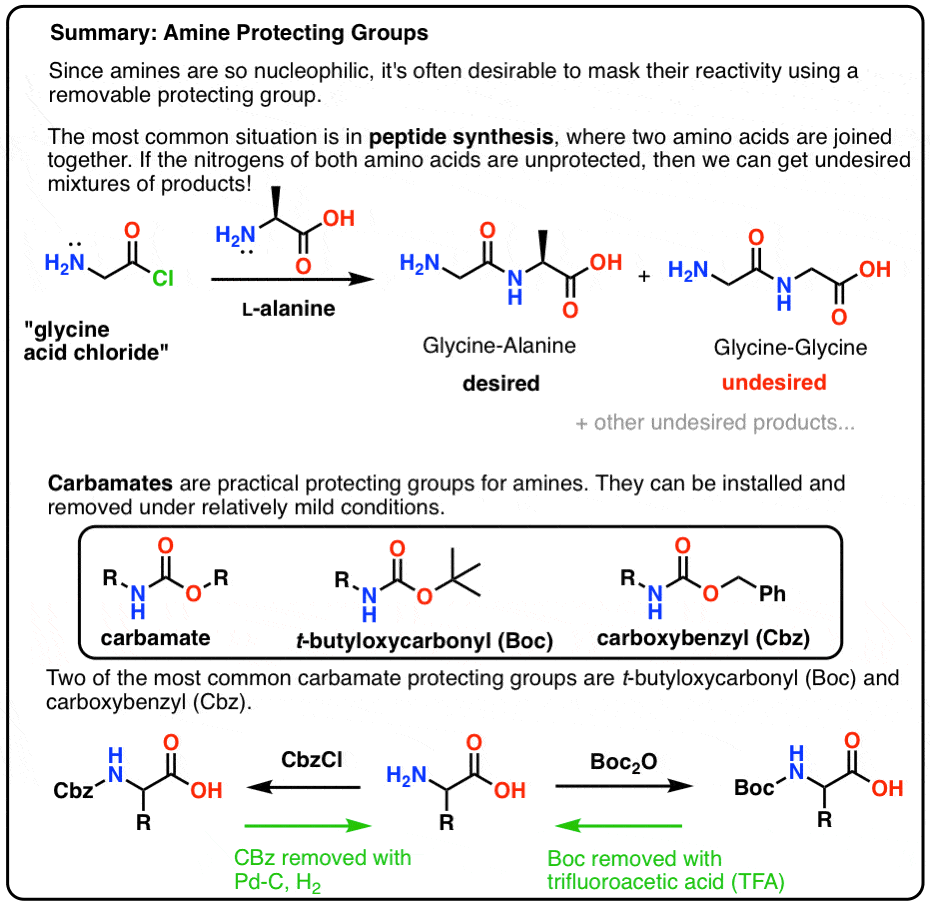
Tabelă de materii
- O introducere în sinteza peptidelor simple
- Să amestecăm un lot de Gly-Ala
- Un plan inițial foarte prost
- „Hark! What Crap Is This?”
- A Protective Hat For NH2
- Mate! Folosește un carbamat, amice!
- Boc și CBz sunt genunchii albinelor
- Instalarea și îndepărtarea grupării protectoare „Boc”
- Instalarea și îndepărtarea grupării protectoare de carbamat CBz (sau „Z”)
- O sinteză peptidică simplă folosind grupări protectoare de carbamat
- Și continuă…
- Note
- (Avansat) Referințe și lecturi suplimentare
An Introduction To Simple Peptide Synthesis
Într-o postare recentă am trecut în revistă 3 modalități obișnuite de obținere a amidelor:
- Adăugarea de amine la halogenuri de acil / anhidride
- Hidroliza parțială a nitrililor
- Cuplarea acizilor carboxilici cu amine folosind un agent de deshidratare precum DCC (N,N’-diciclohexilcarbodiimida).
Ceea ce a lipsit din această postare a fost orice mențiune despre sintetizarea străbunicului celor mai utile legături amidice cunoscute de omenire, și prin aceasta mă refer la peptide.
O legătură peptidică este numele pe care îl dăm legăturii amidice care unește doi aminoacizi.
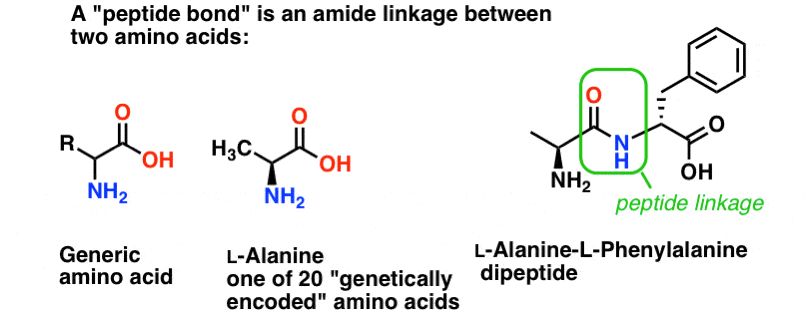
Și aminoacizii sunt importanți pentru că… așteptați. Știți deja de ce sunt importanți aminoacizii, nu? Dacă nu știți acest lucru acum, reveniți după ce citiți asta.
Să amestecăm un lot de Gly-Ala
Să încercăm să aplicăm o parte din noile noastre abilități de sinteză a amidelor pentru a încerca să construim o dipeptidă foarte simplă, glicina-alanină. Dacă reușim să construim acum o dipeptidă simplă, putem folosi ceea ce am învățat pentru a arăta cum se fabrică peptide și mai complexe într-o postare ulterioară. Știați că Bruce Merrifield, laureat al Premiului Nobel, a sintetizat insulina prin alăturarea unui aminoacid la un loc? Da, chiar așa.
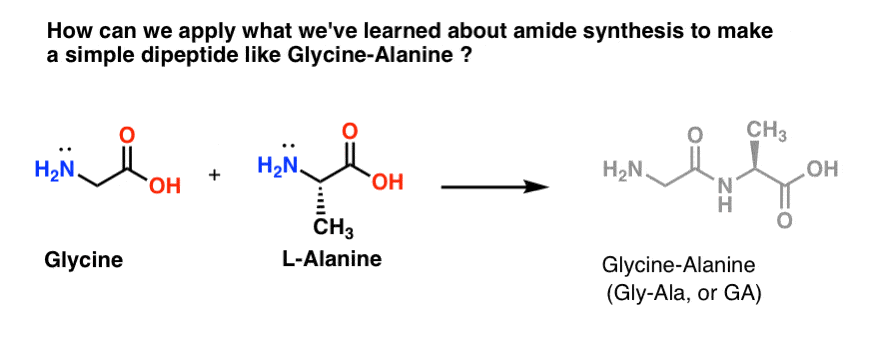
Dintre cele trei metode pe care le-am enumerat pentru fabricarea amidelor, doar două sunt potențial utile pentru a forma legături peptidice: 1) metoda clorurii de acid sau 2) sinteza prin intermediul unui agent de cuplare precum DCC. .
3. Un plan inițial foarte prost
Prima noastră încercare de sinteză peptidică va implica să ne avântăm cu un plan de atac foarte naiv și să sperăm că totul va funcționa în cele din urmă. Țineți-vă bine, oameni buni, pentru că va fi dezastruos.
Vom începe prin a propune metoda clorurii de acid pentru sinteza Gly-Ala.
Plecând de la dipeptida Gly-Ala, planul nostru ne-ar face să sintetizăm legătura peptidică prin reacția alaninei cu clorura de acid derivată din glicină:
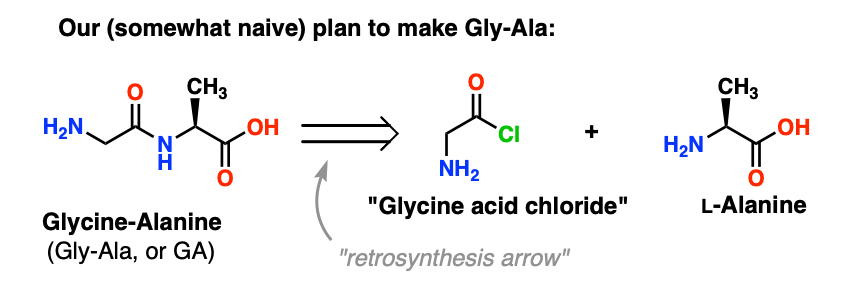
Există o mică problemă cu acest plan. S-ar putea să fie puțin greu de observat la început.
Să presupunem că am obținut clorura acidă din glicină* , și că avem „clorura acidă de glicină” și alanina împreună în același balon, împreună cu un exces de bază pentru a grăbi lucrurile.
Vom desena reacția în sensul înainte:
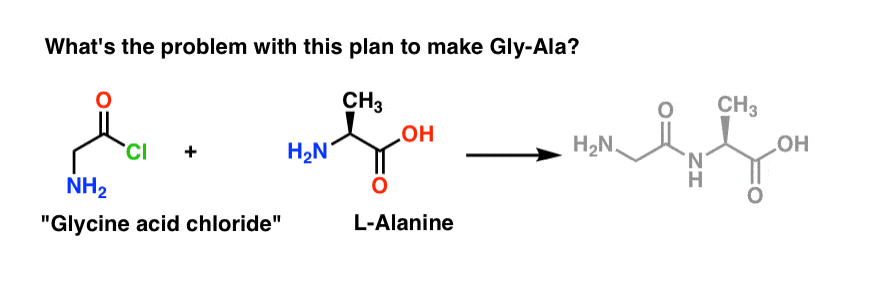
Ce ar putea merge prost?
„Hark! Ce porcărie este asta? „
Planul nostru este să facem o soluție de clorură acidă de glicină (1 echivalent molar), apoi să o lăsăm să aștepte răbdătoare în balon până când adăugăm un echivalent molar de alanină, după care să reacționeze cu grupa nucleofilă NH2 a alaninei.
Problema cu planul nostru este că nu avem de-a face cu o singură moleculă de „clorură acidă de glicină” – avem de-a face cu ceva în jur de un mol (6,02 x 1023 molecule) din aceasta. Iar clorura acidă de glicină are deja o grupare nucleofilă NH2!
„Clorura acidă de glicină”, așa cum este desenată, nu este o moleculă stabilă, deoarece poate reacționa cu ea însăși.
Aceasta înseamnă că o soluție de clorură acidă de glicină lăsată de capul ei ar forma un polimer de glicină, cu structura Gly-Gly-Gly-Gly-Gly…
Inclusiv o soluție de clorură acidă de glicină în prezența alaninei ar forma nu numai Gly-Ala dorit, ci și Gly-Gly (cu o halogenură de aciil atașată) care poate continua să facă și mai multe năzbâtii cu un alt nucleofil, fie el Gly sau Ala:
(și nu, nu există prea multe elemente care să distingă NH2 din „clorura de acid glicinic” de NH2 din alanină. Ele sunt aproximativ la fel de reactive.)
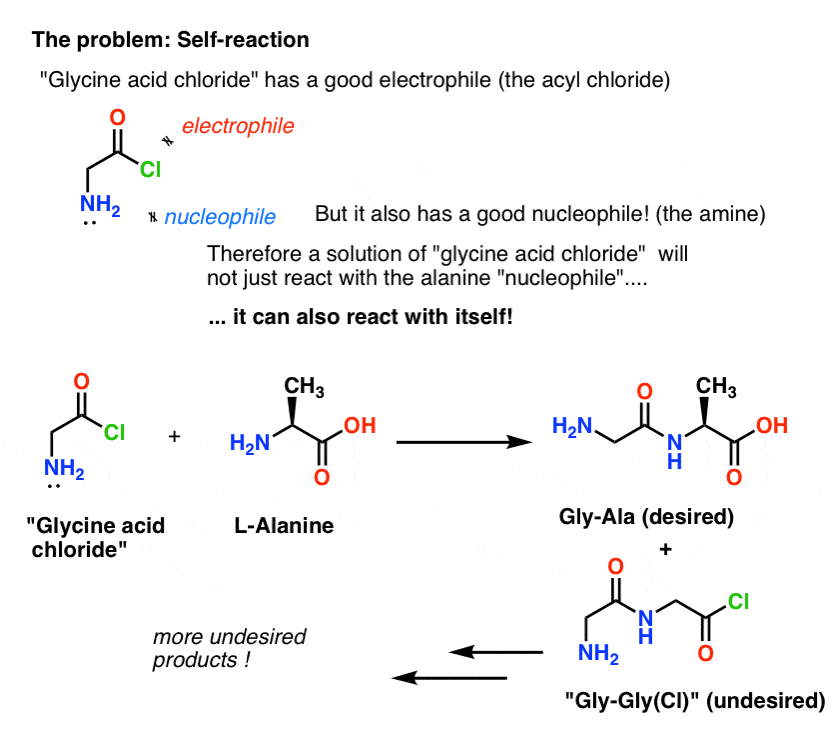
Lecția de aici este că atunci când aveți o soluție a unei molecule care conține atât un nucleofil, cât și un electrofil, aceasta poate reacționa de la sine. Există un nume pentru acest proces care s-ar putea să vă sune familiar: polimerizare.
Atunci cum oprim ca acest lucru să se întâmple?
O pălărie protectoare pentru NH2
Cel mai bun mod este să „acoperiți” azotul cumva cu o grupare protectoare (PG) care face ca grupa NH2 să fie nenucleofilă. Aceasta ar trebui să aibă, de asemenea, următoarele proprietăți:
- instalare ușoară și selectivă
- inerentă la condițiile de reacție dorite (de ex. SOCl2 pentru a obține clorura de acid din acidul carboxilic)
- ușor și selectiv îndepărtat fără a afecta produsul final
Am mai văzut strategii de grupare protectoare, în special cu alcooli și utilizarea reactivilor Grignard.
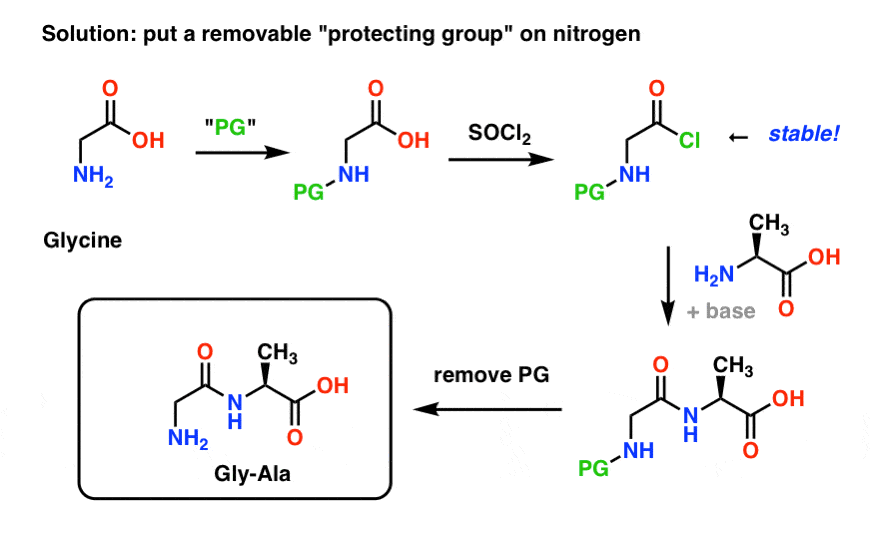
Iată cum ar putea arăta o strategie de grupare protectoare pentru sinteza noastră de „Gly-Gly”. Instalăm o grupare protectoare („PG”) pe glicină, apoi facem clorura de acid. PG ar trebui să fie aleasă astfel încât să facă azotul nenucleofil (adică nu va reacționa cu clorura de acid).
Apoi putem forma legătura noastră peptidică cu alanina neprotejată și apoi să îndepărtăm PG-ul în condiții blânde.
O strategie de grupare protectoare pentru azot pe care am explorat-o deja este sinteza Gabriel, care folosește ftalimida (vă puteți gândi la o ftalimidă ca la un azot protejat). Aceasta a fost folosită de fapt pentru a sintetiza Gly-Gly („glicilglicină”) ! Cu toate acestea, una dintre probleme este că sunt necesare condiții relativ dure (căldură amplă) atât pentru a instala cât și pentru a îndepărta gruparea ftalimidă, iar acesta nu este un mediu foarte sănătos pentru supraviețuirea aminoacizilor sensibili, chirali, care se pot racemiza cu ușurință.
O altă alegere potențială este protejarea azotului sub formă de amidă, dar amidele de clivaj pot necesita și ele condiții dure. În plus, deoarece oricum încercăm să forjăm aici o legătură amidică (peptidă), am putea avea probleme de selectivitate cu îndepărtarea acesteia – distrugând satul pentru a-l salva.
Împreună! Folosește un carbamat, amice!
Cea mai populară alegere de grupare protectoare pentru azotul aminei este grupa funcțională carbamat. Un carbamat arată ca un copil bastard al unui ester și al unei amide, cu N și O flancând un carbonil.
Azotul unui carbamat este relativ nenucleofilic și, în plus, carbamații sunt:
- ușor de instalat pe azot
- inerte la o mare varietate de condiții de reacție
- ușor de îndepărtat fără a afecta grupările amidă existente
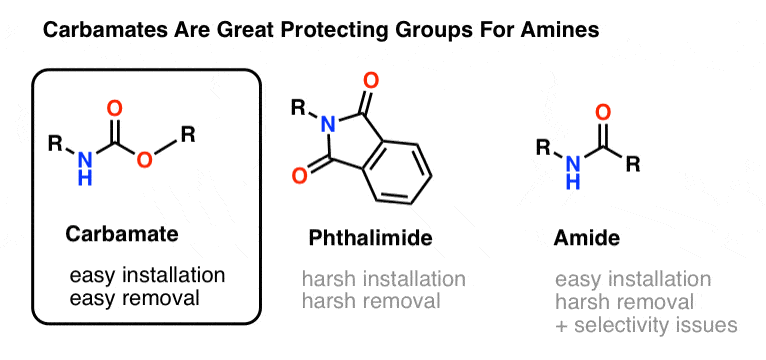
Acesta îi face perfecți pentru scopurile noastre.
Boc și CBz sunt genunchii albinelor
Două grupări protectoare populare ale carbamaților sunt Boc (t-Butiloxicarbonil) și CBz (carboxibenzil).
Pentru scopurile noastre, aceste două grupări protectoare pot fi considerate mai mult sau mai puțin echivalente, deoarece oricare dintre ele poate fi folosită în mod eficient pentru sinteza peptidelor.
Diferența cheie constă de fapt în modul în care acestea sunt îndepărtate (adică etapa de „deprotecție”). Alegerea între una sau alta devine crucială odată ce aveți o moleculă complexă cu mai multe grupe protectoare; acest lucru intră în categoria „strategie sintetică avansată”, care este mai degrabă un subiect pentru Org 3.
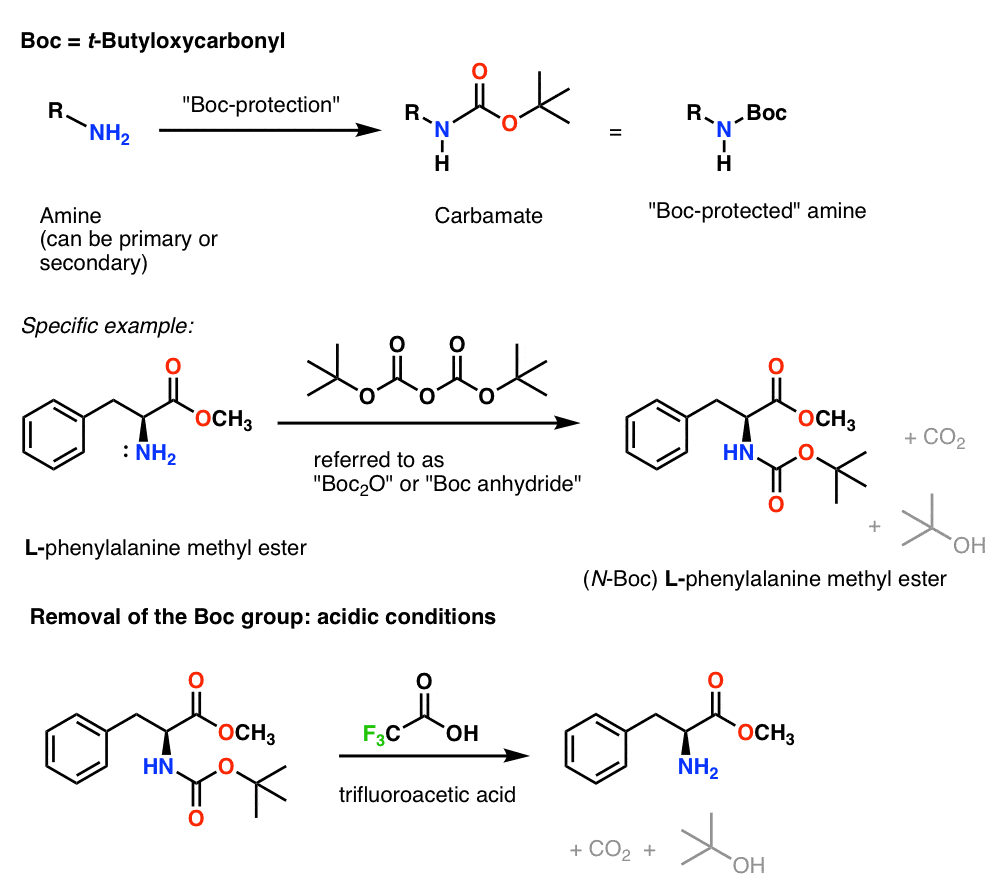
Instalarea și îndepărtarea grupării protectoare „Boc”
Grupul Boc se instalează de obicei cu „Boc2O” (denumit uneori „anhidridă Boc”) și se îndepărtează cu acid. Alegerea obișnuită este acidul trifluoroacetic (TFA) „pur” (adică nediluat), care desprinde foarte curat grupele Boc, eliberând CO2 și alcool t-butilic.
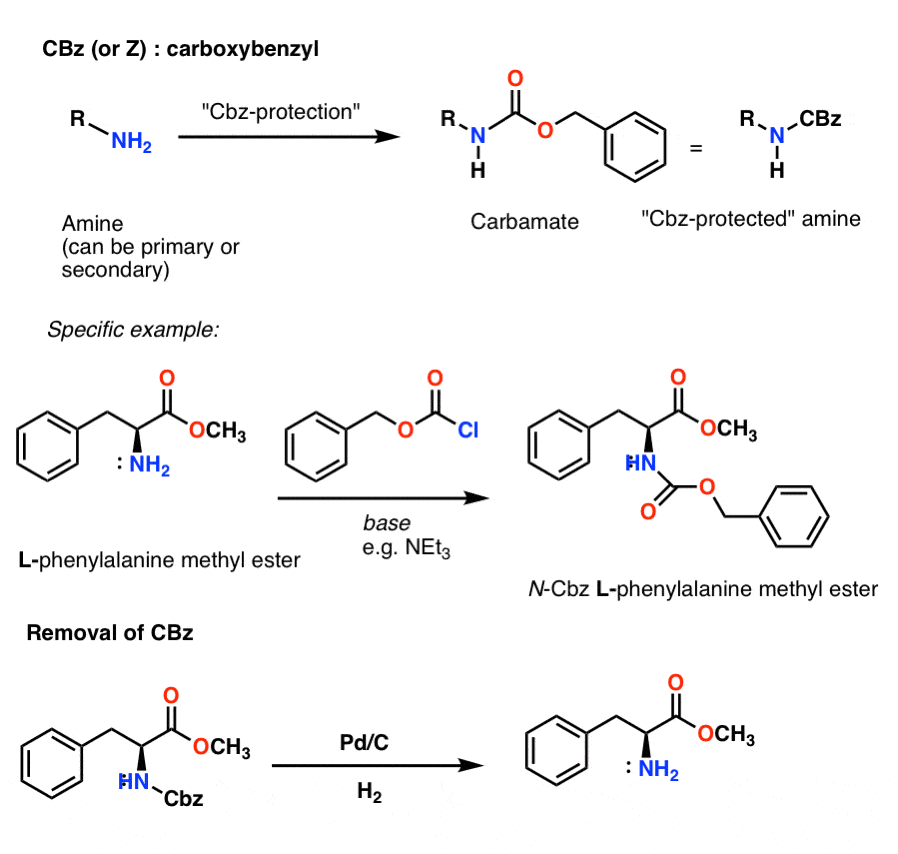
Instalarea și îndepărtarea grupării protectoare CBz (sau „Z”) carbamat
Grupul Cbz (uneori abreviat în continuare ca „Z”) poate fi instalat cu CbzCl și o bază ușoară și, de obicei, este îndepărtat prin hidrogenare catalitică (Pd-C/H2). Aceasta este extrem de blândă și are avantajul de a avea loc la pH neutru, lăsând singure grupele funcționale sensibile la acizi sau baze.
O sinteză peptidică simplă folosind grupări protectoare de carbamat
Să ne întoarcem la sinteza peptidelor și să aplicăm această strategie a grupării protectoare pentru a obține Gly-Ala.
Începem cu un aminoacid precum L-alanina. Tratând alanina cu Boc2O, obținem L-alanina protejată cu N-Boc. Următorul pas este de a forma o clorură acidă prin utilizarea SOCl2. Odată formată, adăugăm apoi amina noastră (de exemplu, L-valina) în prezența unui exces de bază, formând legătura noastră cheie de amidă. Pasul final pentru a obține dipeptida este deprotejarea aminei protejate de Boc cu acid trifluoroacetic (TFA), și iată! avem dipeptida noastră.
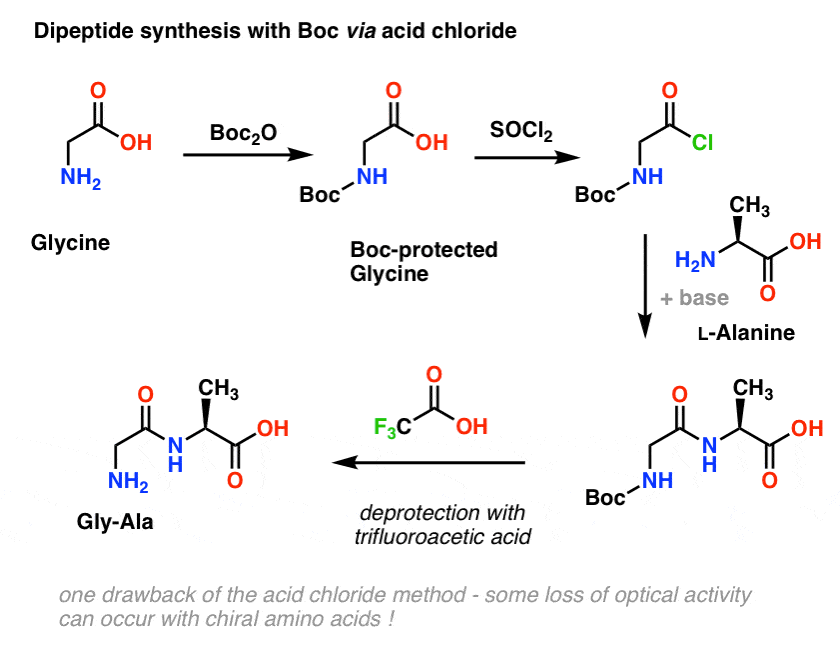
Deși această metodă poate fi bună pe hârtie, o problemă a utilizării clorurilor de acid în practică este că aminoacizii chirali își pierd adesea puritatea optică prin această metodă, un proces denumit uneori „racemizare”, dar mai corect numit „epimerizare” (mai corect din punct de vedere tehnic, deoarece un hidrogen de pe un centru chiral este inversat)
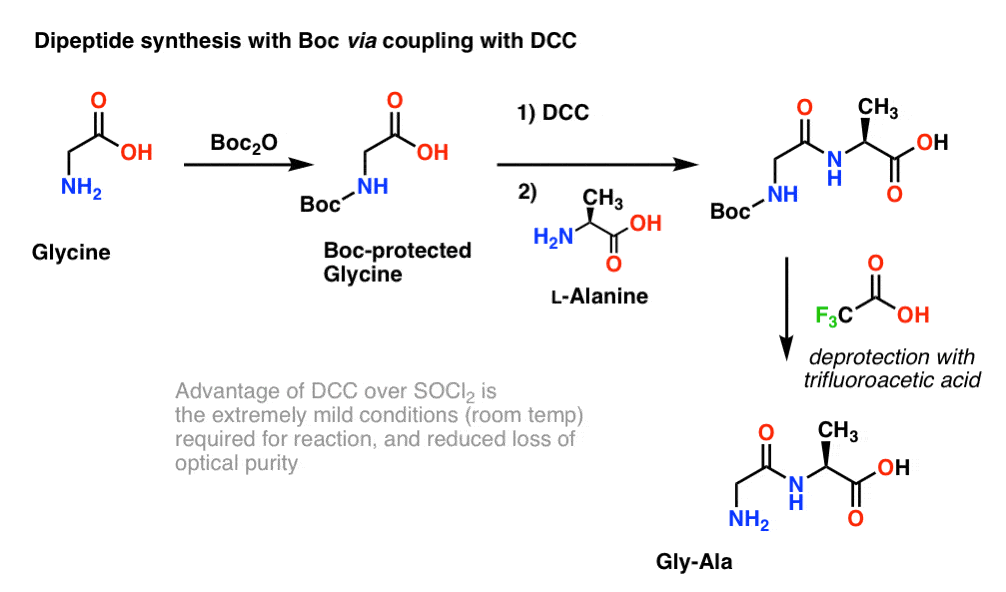
Din moment ce chiralitatea aminoacizilor este esențială pentru funcția lor biologică, se folosește în general un protocol puțin mai blând care utilizează DCC sau un reactiv de cuplare similar.
În cazul de față, tratăm glicina protejată de Boc cu DCC pentru a activa acidul carboxilic. Apoi adăugăm nucleofilul nostru aminoacid (L-alanină) care formează dipeptida. Dacă dorim să izolăm dipeptida Gly-Ala în acest punct, putem elimina apoi gruparea Boc cu TFA.
(notă despre această schemă)
Se continuă…
Rețineți că, dacă am dori să facem o tripeptidă, putem continua să efectuăm cicluri de adăugare de DCC (pentru a activa acidul carboxilic) urmate de adăugarea de noi aminoacizi, construind peptida unitate cu unitate!
Există o metodă deosebit de eficientă pentru construirea peptidelor mai lungi, inițiată de Bruce Merrifield (și aplicată în sinteza insulinei, printre altele) numită sinteza peptidelor în fază solidă, pe care o vom aborda data viitoare când vom aborda acest subiect.
Note
Nota 1. Similar cu vechea glumă despre economistul care propune un plan pentru a pleca de pe o insulă pustie:
„Să presupunem că avem o barcă”.
Glicina (ca toți aminoacizii) este ea însăși un zwitterion. Tratarea glicinei cu SOCl2 ar trebui să dea clorura acidă cu o amină protonată. Aceasta ar trebui să fie relativ stabilă în soluție atâta timp cât nu se adaugă o bază.
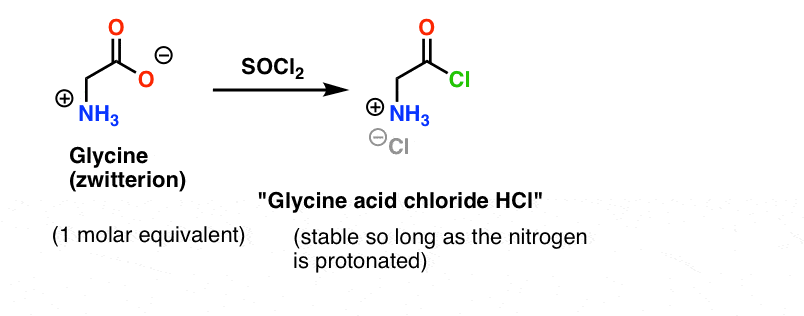
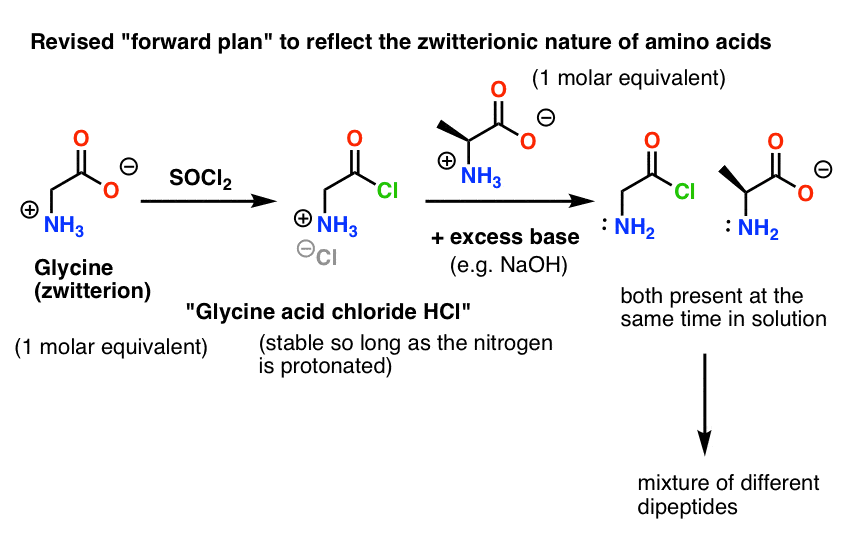
Iată care este problema. Deoarece nucleofilul nostru aminoacid (alanina) este, de asemenea, zwitterionic, nu poate avea loc nicio reacție până când nu se adaugă un exces de bază pentru a elibera o pereche solitară pe azotul alaninei. După adăugarea bazei, avem „clorura de acid glicinic” și alanina împreună în soluție. Nu există nicio diferență apreciabilă de nucleofilicitate între nitrogenii acestor două specii și fiecare dintre ele va concura pentru a reacționa cu nucleofilul clorură de acid, conducând la un amestec de Gly-Ala și Gly-GlyCl, iar Gly-GlyCl poate reacționa apoi în continuare cu diferiți nucleofili prestabiliți în soluție pentru a da tri-, tetra- și peptide superioare.
Nota 2. John Sheehan, pe care l-am întâlnit mai devreme ca inventator al DCC în drum spre primul care a sintetizat penicilina, a realizat, de asemenea, Gly-Gly ftalil-protejat printr-o sinteză Gabriel:
Referință aici (JACS, 1949, 71, 1856)
Nota 3. O altă problemă legată de utilizarea grupărilor protectoare amidice este formarea de azlactonă, care poate duce la epimerizarea aminoacizilor chirali. A se vedea, de asemenea, acest set de probleme.
Nota 4. „Grupuri protectoare ortogonale”. În planificarea sintetică este adesea de o importanță crucială să aveți grupări protectoare care pot fi îndepărtate în condiții distinct diferite. Această proprietate este adesea denumită „ortogonalitate”
De exemplu, în următoarea dipeptidă avem două grupe protectoare diferite pe azot – una Boc și una CBz. Prin selectarea grupărilor protectoare „ortogonale”, fiecare azot este adresabil – putem alege ce grupare protectoare să eliminăm, iar sinteza noastră poate continua de acolo. Astfel evităm să ajungem în situația în care avem două amine neprotejate și trebuie să ne bazăm pe faptul că una este mai reactivă decât cealaltă. Aceste abordări funcționează foarte rar!
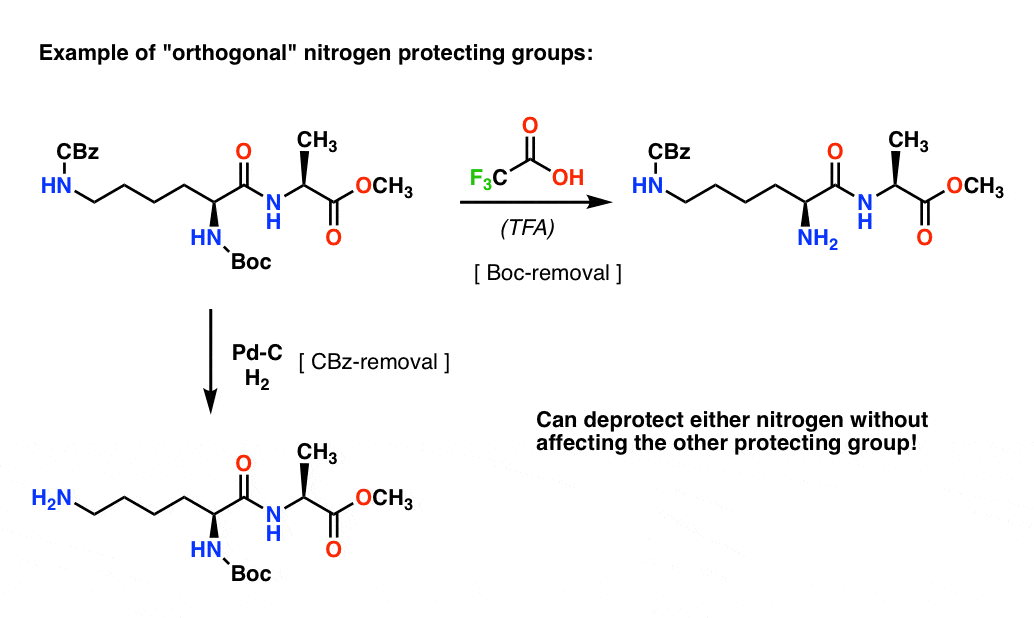
O notă – pentru simplitate, aici alanina este reprezentată cu un acid carboxilic liber, dar o abordare puțin mai bună ar fi să se folosească esterul metilic al alaninei pentru a evita orice auto-cuplare între amina liberă a alaninei și acidul carboxilic liber.
Mate…
(Avansat) Referințe și lecturi suplimentare
Carbamații sunt utili ca grupe protectoare pentru amine, iar cele mai frecvent utilizate sunt -Boc, -Cbz și -Fmoc.
- Über ein allgemeines Verfahren der Peptid-Synthese
Max Bergmann și Leonidas Zervas
Ber. 1932, 65 (7), 1192-1201
DOI: 10.1002/cber.19320650722
Grupul protector -Cbz (carboxibenzil) a fost folosit pentru prima dată de Max Bergmann și Leonidas Zervas în 1932 pentru sinteza peptidelor și este uneori abreviat „-Z” în onoarea lui Zervas. - ELIMINAREA GRUPURILOR DE PROTECȚIE t-BUTYL ȘI t-BUTOXYCARBONYL CU ACID TRIFLUOROACETIC
Mecanisme, formarea de biproduse și evaluarea scavengerilor
Behrend F. Lundt, Nils L. Johansen, Aage Vølund, and Jan Markussen
J. Pept. Prot. Res. 1978, 12 (5), 258-268
DOI: 10.1111/j.1399-3011.1978.tb02896.x
În practică, la deprotecție se adaugă de obicei la cocktailul de acizi (TFA) agenți nucleofili (de exemplu, tioli), deoarece deprotecția lui Boc va da specii electrofile de t-butil (de exemplu, trifluoroacetat de t-butil) care pot reacționa cu reziduuri sensibile (de exemplu, Trp sau Cys). - O metodă de sinteză a lanțurilor peptidice lungi folosind o sinteză a oxitocinei ca exemplu
Miklos Bodanszky și Vincent du Vigneaud
Journal of the American Chemical Society 1959, 81 (21), 5688-5691
DOI: 1021/ja01530a040
În prima jumătate a secolului XX, sinteza peptidelor a fost realizată folosind tehnici standard de chimie organică în fază de soluție. Acest lucru este cunoscut în prezent sub denumirea de LPPS (sinteza peptidelor în fază lichidă). du Vigneaud a primit Premiul Nobel pentru chimie în 1955 pentru activitatea sa care a demonstrat că sinteza peptidelor poate fi realizată, utilizând alegerea corectă a grupărilor protectoare și a strategiilor de sinteză. - FORMAREA TEMPORARĂ A ANELULUI AZLACTONĂ ÎN RACEMIZAREA DERIVAȚILOR ACILICI AI AMINOACIDEI CU ANHIDRAZĂ ACETICĂ
Vincent du Vigneaud și Curtis E. Meyer
Biol. Chem. 1932, 99:143-151
http://www.jbc.org/content/99/1/143.citation
O altă problemă legată de utilizarea grupărilor protectoare amidice este formarea de azlactonă, care poate duce la epimerizarea aminoacizilor chirali. - O nouă cale sintetică pentru peptide
John C. Sheehan și Victor S. Frank
Journal of the American Chemical Society 1949, 71 (5), 1856-1861
DOI: 10.1021/ja01173a095
John Sheehan, inventatorul DCC în drumul spre prima sinteză a penicilinei, a realizat, de asemenea, Gly-Gly ftalil-protejat printr-o sinteză Gabriel. - O nouă metodă de formare a legăturilor peptidice
John C. Sheehan și George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
Articol original privind sinteza legăturilor peptidice/legături de amidă folosind DCC. - Funcția 9-fluorenilmetoxicarbonil, o nouă grupare protectoare de amino sensibilă la baze
Louis A. Carpino și Grace Y. Han
Journal of the American Chemical Society 1970, 92 (19), 5748-5749
DOI: 10.1021/ja00722a043 - 9-Fluorenilmetoxicarbonil grup de protecție a aminei
Louis A. Carpino și Grace Y. Han
The Journal of Organic Chemistry 1972 37 (22), 3404-3409
DOI: 10.1021/jo00795a005
Descoperirea și dezvoltarea grupului de protecție -Fmoc pentru amine adaugă un alt strat de ortogonalitate la strategiile de protecție/deprotecție a aminei. Gruparea -Fmoc este labilă la baze și, în sinteza peptidelor, este de obicei eliminată cu 20% piperidină în DMF. Cbz se îndepărtează prin hidrogenare, -Boc se îndepărtează cu un acid, iar -Fmoc cu o bază.