Denumire generică: clorhidrat de naftifină
Forma de dozare: cremă
Revizuit medical de Drugs.com. Ultima actualizare la 1 ianuarie 2021.
- Vizualizare
- Efecte secundare
- Dosare
- Profesional
- Prezență
- Mai mult
Indicații și mod de utilizare pentru Naftifina cremă
Clorhidrat de naftifină cremă este indicat pentru tratamentul tinea pedis interdigitală, tinea cruris și tinea corporis cauzate de organismul Trichophyton rubrum.
Naftifină cremă Doze și mod de administrare
Dozaj și mod de administrare
Dozaj și mod de administrare: Numai pentru uz topic. Clorhidratul de clorhidrat de naftifină în cremă nu este destinat utilizării oftalmice, orale sau intravaginale. Aplicați un strat subțire de clorhidrat de naftifină în cremă o dată pe zi pe zonele afectate plus o marjă de ½ inch de piele sănătoasă din jur, timp de 2 săptămâni.
Forme farmaceutice și concentrații
Care gram conține 20 mg de clorhidrat de naftifină (2%) într-o bază albă până la alb-deschis.
Contraindicații
Niciuna
Atenționări și precauții
Reacții adverse locale
Întrerupeți tratamentul dacă apare iritație sau sensibilitate la utilizarea clorhidratului de naftifină în cremă. Indicați pacienților să își contacteze medicul dacă aceste afecțiuni apar în urma utilizării clorhidratului de naftifină cremă.
Reacții adverse
Experiența studiilor clinice
Pentru că studiile clinice se desfășoară în condiții foarte variate, ratele reacțiilor adverse observate în studiile clinice ale unui medicament nu pot fi comparate direct cu ratele din studiile clinice ale unui alt medicament și este posibil să nu reflecte ratele observate în practica clinică.
În timpul studiilor clinice, 903 subiecți au fost expuși la formulările de naftifină 1% și 2% cremă. Un total de 564 de subiecți cu tinea pedis interdigitală, tinea cruris sau tinea corporis au fost tratați cu clorhidrat de naftifină în cremă.
În două studii randomizate, controlate cu vehicul (400 de subiecți au fost tratați cu clorhidrat de naftifină în cremă). Populația avea vârste cuprinse între 12 și 88 de ani, preponderent de sex masculin (79%), 48% caucazieni, 36% negri sau afro-americani, 40% hispanici sau latino-americani și prezentau fie tinea pedis interdigital predominant, fie tinea cruris. Majoritatea subiecților au primit doze o dată pe zi, local, timp de 2 săptămâni, pentru a acoperi zonele de piele afectate plus o margine de ½ inch de piele sănătoasă din jur. În cele două studii controlate cu vehicul, 17,5% dintre subiecții tratați cu clorhidrat de naftifină cremă au prezentat o reacție adversă, comparativ cu 19,3% dintre subiecții cu vehicul. Cea mai frecventă reacție adversă (mai mare sau egală cu 1%) este pruritul. Majoritatea reacțiilor adverse au fost de severitate ușoară. Incidența reacțiilor adverse la populația tratată cu clorhidrat de naftifină în cremă nu a fost semnificativ diferită față de populația tratată cu vehicul.
Într-un al treilea studiu randomizat, controlat cu vehicul, 116 subiecți pediatrici cu tinea corporis au fost tratați cu clorhidrat de naftifină în cremă. Populația a avut vârsta cuprinsă între 2 ani sau mai mare și mai puțin de 18 ani (vârsta medie de 9 ani), predominant de sex masculin (61%), 47% de culoare albă, 51% de culoare sau afro-americani, 92% hispanici sau latino-americani și infectați cu tinea corporis. Crema cu clorhidrat de naftifină a fost aplicată local o dată pe zi, timp de 2 săptămâni, pe toate suprafețele corporale afectate de tinea corporis, plus o margine de ½ inch de piele sănătoasă în jurul leziunilor afectate. Incidența reacțiilor adverse la populația tratată cu clorhidrat de naftifină în cremă nu a fost semnificativ diferită față de populația tratată cu vehicul.
În două studii deschise de farmacocinetică și siguranță pediatrică, 49 de subiecți pediatrici cu vârsta cuprinsă între 2 și mai puțin de 18 ani cu tinea pedis interdigitală, tinea cruris și tinea corporis au primit clorhidrat de naftifină în cremă. Incidența reacțiilor adverse la populația pediatrică a fost similară cu cea observată la populația adultă.
Experiență postcomercializare
Au fost identificate următoarele reacții adverse în timpul utilizării post-aprobare a clorhidratului de naftifină: roșeață/iritare, inflamație, macerație, umflături, arsuri, vezicule, drenaj seros, cruste, cefalee, amețeli, leucopenie, agranulocitoză.
Pentru că aceste reacții sunt raportate în mod voluntar de la o populație de mărime incertă, nu este întotdeauna posibil să se estimeze în mod fiabil frecvența lor sau să se stabilească o relație de cauzalitate cu expunerea la medicament.
UTILIZARE ÎN POPULAȚII SPECIFICE
Femeie
Rezumat al riscului
Nu există date disponibile cu clorhidrat de naftifină cremă la femeile gravide care să informeze cu privire la riscul asociat medicamentului pentru malformații congenitale majore și avort spontan. În studiile de reproducere la animale, nu au fost observate efecte adverse asupra dezvoltării embrio-fetale la doze orale administrate în perioada de organogeneză de până la de 18 ori doza maximă recomandată la om (MRHD) la șobolanii gravide sau la doze subcutanate administrate în perioada de organogeneză de până la de 2 ori MRHD la șobolanii gravide sau de 4 ori MRHD la iepurii gravide.
Riscul de fond estimat de malformații congenitale majore și avort spontan pentru populația indicată este necunoscut. Toate sarcinile au un risc de fond de malformații congenitale, pierderi sau alte rezultate adverse. În populația generală din S.U.A., riscul de fond estimat al malformațiilor congenitale majore și al avortului spontan în cazul sarcinilor recunoscute clinic este de 2% până la 4% și, respectiv, de 15% până la 20%.
Date
Date la animale
Studii sistemice de dezvoltare embrio-fetală au fost efectuate la șobolani și iepuri. Pentru compararea dozelor la animale cu cele la om, pe baza comparării suprafeței corporale (mg/m2), MRHD este stabilită la 8 g de cremă 2% pe zi (2,67 mg/kg/zi pentru un individ de 60 kg).
Doze orale de 30, 100 și 300 mg/kg/zi de clorhidrat de naftifină au fost administrate în timpul perioadei de organogeneză la șobolani femele gestante. Nu au fost observate efecte legate de tratament asupra dezvoltării embrio-fetale la doze de până la 300 mg/kg/zi (de 18 ori MRHD). Doze subcutanate de 10 și 30 mg/kg/zi de clorhidrat de naftifină au fost administrate în timpul perioadei de organogeneză la șobolani femele gestante. Nu s-au observat efecte legate de tratament asupra dezvoltării embrio-fetale la 30 mg/kg/zi (de 2 ori MRHD). Doze subcutanate de 3, 10 și 30 mg/kg/zi de clorhidrat de naftifină au fost administrate în timpul perioadei de organogeneză la iepuroaice gestante. Nu au fost observate efecte legate de tratament asupra dezvoltării embrio-fetale la 30 mg/kg/zi (de 4 ori MRHD).
S-a efectuat un studiu de dezvoltare peri- și postnatală la șobolani. Doze orale de 30, 100 și 300 mg/kg/zi de clorhidrat de naftifină au fost administrate la șobolani femele din ziua 14 de gestație până în ziua 21 de lactație. La doza de 300 mg/kg/zi (de 18 ori mai mare decât MRHD) s-a observat o creștere redusă a greutății corporale a femelelor în timpul gestației și a descendenților în timpul alăptării. Nu s-a observat nicio toxicitate pentru dezvoltare la 100 mg/kg/zi (de 6 ori MRHD).
Lactație
Rezumat al riscurilor
Nu există informații disponibile privind prezența clorhidratului de naftifină cremă în laptele uman, efectele medicamentului asupra sugarului alăptat sau efectele medicamentului asupra producției de lapte. Lipsa datelor clinice în timpul alăptării împiedică o determinare clară a riscului reprezentat de clorhidrat de naftifină cremă pentru un sugar în timpul alăptării; prin urmare, trebuie luate în considerare dezvoltarea și beneficiile pentru sănătate ale alăptării, împreună cu nevoia clinică a mamei de clorhidrat de naftifină cremă și orice efecte adverse potențiale ale clorhidratului de naftifină cremă sau ale afecțiunii subiacente a mamei asupra sugarului alăptat la sân.
Utilizare pediatrică
Siguranța și eficacitatea clorhidratului de naftifină cremă au fost stabilite la pacienții pediatrici cu vârsta de 12 ani și peste cu tinea pedis interdigitală și tinea cruris și cu vârsta de 2 ani și peste cu tinea corporis .
Utilizarea clorhidratului de naftifină în cremă la aceste grupe de vârstă este susținută de dovezile din studii adecvate și bine controlate la adulți și copii, cu date suplimentare privind siguranța și proprietățile farmacocinetice din două studii deschise efectuate la 49 de subiecți pediatrici expuși la clorhidrat de naftifină în cremă .
Siguranța și eficacitatea clorhidratului de naftifină în tratamentul tinea cruris și tinea pedis interdigitală la pacienții pediatrici cu vârsta mai mică de 12 ani nu au fost stabilite. Siguranța și eficacitatea clorhidratului de naftifină cremă în tratamentul tinea corporis la pacienții pediatrici cu vârsta mai mică de 2 ani nu au fost stabilite.
Utilizarea în geriatrie
Studiile clinice cu clorhidrat de naftifină cremă nu au inclus un număr suficient de subiecți cu vârsta de 65 de ani și peste pentru a determina dacă aceștia răspund diferit față de subiecții mai tineri.
Descrierea naftifinei cremă
Clorhidrat de naftifină cremă, USP este o cremă de culoare albă până la alb-deschis, numai pentru uz topic. Fiecare gram conține 20 mg de clorhidrat de naftifină, USP, (2%), un compus antifungic sintetic alilaminic.
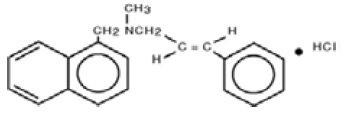
Chimic, naftifina HCl este clorhidrat de (E)-N-Cinnamil-N-metil-1-naftalenemetilamină.
Formula moleculară este C21H21N-HCl cu o greutate moleculară de 323,86.
Formula structurală a clorhidratului de naftifină, USP este:
Crema de clorhidrat de naftifină, USP conține următoarele ingrediente inactive: alcool benzilic, alcool cetilic, ceară de esteri cetilici, miristat de izopropil, polisorbat 60, apă purificată, hidroxid de sodiu, monostearat de sorbitan și alcool stearilic. Se poate adăuga acid clorhidric pentru ajustarea pH-ului.
Naftifină cremă – Farmacologie clinică
Mecanism de acțiune
Clorhidrat de naftifină cremă este un medicament antifungic topic .
Farmacodinamică
Farmacodinamica clorhidratului de naftifină cremă nu a fost stabilită.
Farmacocinetică
Studiile de biodisponibilitate in vitro și in vivo au demonstrat că naftifina pătrunde în stratul cornos în concentrație suficientă pentru a inhiba dezvoltarea dermatofitelor.
Farmacocinetica clorhidratului de naftifină cremă a fost evaluată după aplicarea topică o dată pe zi, timp de 2 săptămâni, la 21 de subiecți adulți, atât bărbați cât și femei, cu tinea pedis și tinea cruris. Cantitatea totală mediană de cremă aplicată a fost de 6,4 g (intervalul 5,3 g până la 7,5 g) pe zi. Rezultatele au arătat că expunerea sistemică (adică concentrația maximă (Cmax) și aria sub curba de la timpul 0 la 24 de ore (AUC0-24) la naftifină a crescut pe parcursul perioadei de tratament de 2 săptămâni la toți cei 21 de subiecți. Media geometrică (coeficientul de variație sau CV%) AUC0-24 a fost de 117 (41,2) ng*hr/mL în ziua 1 și de 204 (28,5) ng*hr/mL în ziua 14. Media geometrică (CV %) Cmax a fost de 7 ng/mL (55,6) în ziua 1 și de 11 ng/mL (29,3) în ziua 14. Timpul mediu până la Cmax (Tmax) a fost de 8 ore (interval de la 4 la 24 de ore) în ziua 1 și de 6 ore (interval de la 0 la 16 ore) în ziua 14. Acumularea după 14 zile de aplicare locală a fost de mai puțin de două ori mai mică. Concentrațiile minime au crescut, în general, pe parcursul perioadei de studiu de 14 zile. Naftifina a continuat să fie detectată în plasmă la 13/21 (62%) subiecți în ziua 28, concentrațiile plasmatice medii (deviație standard sau DS) au fost de 1,6 ± 0,5 ng/mL (interval sub limita de cuantificare (BLQ) până la 3 ng/mL). În același studiu farmacocinetic efectuat la pacienți cu tinea pedis și tinea cruris, fracția mediană a dozei excretată în urină în timpul perioadei de tratament a fost de 0,0016% în ziua 1 față de 0,0020% în ziua 14.
Într-un al doilea studiu care a inclus 22 de subiecți, farmacocinetica clorhidratului de naftifină cremă a fost evaluată la 20 de subiecți pediatrici cu vârsta cuprinsă între 13 și mai puțin de 18 ani cu tinea pedis și tinea cruris. Subiecții au fost tratați cu o doză mediană de 8,1 g (intervalul 6,6 g până la 10,1 g) aplicată pe zonele afectate o dată pe zi, timp de 2 săptămâni. Rezultatele au arătat că expunerea sistemică a crescut pe parcursul perioadei de tratament. Media geometrică (CV%) AUC0-24 a fost de 138 (50,2) ng*hr/mL în ziua 1 și de 192 (74,9) ng*hr/mL în ziua 14. Media geometrică (CV %) Cmax a fost de 9,21 ng/mL (48,4) în Ziua 1 și de 12,7 ng/mL (67,2) în Ziua 14. Fracția mediană a dozei excretată în urină în timpul perioadei de tratament a fost de 0,0030% în ziua 1 și de 0,0033% în ziua 14.
Un al treilea studiu a evaluat farmacocinetica clorhidratului de naftifină în cremă la 27 de subiecți pediatrici cu vârsta cuprinsă între 2 și mai puțin de 12 ani cu tinea corporis cel puțin moderat. Subiecții au fost împărțiți în grupuri mai mici (cu vârsta cuprinsă între 2 și mai puțin de 6 ani, 17 subiecți) și mai mari (cu vârsta cuprinsă între 6 și mai puțin de 12 ani, 10 subiecți). Doze mediane de 1,3 g (interval de la 1 g la 3,1 g) și 2,3 g (interval de la 2,2 g la 4,2 g) au fost aplicate o dată pe zi, timp de 2 săptămâni, în grupurile de tineri și, respectiv, de vârstnici, pe zona afectată plus o margine de ½ inch. Evaluările farmacocinetice în plasmă și urină au fost efectuate în ziua 1 doar în grupul mai în vârstă și în ziua 14 în ambele grupuri. Toți subiecții au prezentat niveluri măsurabile de naftifină în plasmă după aplicarea topică a clorhidratului de naftifină în cremă. În urma administrării unei doze unice în Ziua 1 la subiecții cu vârsta cuprinsă între 6 și mai puțin de 12 ani, valorile medii geometrice (CV%) ale Cmax și AUC0-24 au fost de 3,60 (76,6) ng/mL și, respectiv, 49,8 (64,4) ng*h/mL. În ziua 14 în acest grup, valorile Cmax și AUC0-24 au fost de 3,31 (51,2) ng/mL și, respectiv, 52,4 (49,2) ng*h/mL. La subiecții cu vârsta cuprinsă între 2 și mai puțin de 6 ani, în Ziua 14, Cmax și AUC0-24 au fost de 3,98 (186) ng/mL și, respectiv, 54,8 (150) ng*h/mL. La grupul mai în vârstă de subiecți cu vârsta cuprinsă între 6 și 12 ani, expunerile sistemice (atât Cmax, cât și AUC0-24) în zilele 1 și 14 au fost comparabile. Fracția mediană a dozei excretată în urină în decurs de 24 de ore după aplicarea medicamentului în Ziua 1 și Ziua 14 a fost de 0,0029% și, respectiv, 0,0014%.
Microbiologie
Deși nu se cunoaște exact mecanismul de acțiune împotriva ciupercilor, clorhidratul de naftifină pare să interfereze cu biosinteza sterolilor prin inhibarea enzimei squalene2, 3-epoxidaza.Această inhibare a activității enzimei are ca rezultat scăderea cantității de steroli,în special ergosterol, și o acumulare corespunzătoare de squalene în celule.
Mecanism de rezistență
Până în prezent, nu a fost identificat un mecanism de rezistență la naftifină.
Naftifina s-a dovedit a fi activă împotriva majorității izolatelor următoarelor ciuperci, atât in vitro, cât și în infecții clinice, așa cum este descris în secțiunea INDICAȚII ȘI UTILIZARE:
Trichophyton rubrum
Toxicologie nonclinică
Carcinogeneză, mutageneză, afectarea fertilității
Într-un studiu de carcinogenitate cutanată de 2 ani, clorhidrat de naftifină în cremă a fost administrată la șobolani Sprague-Dawley în doze topice de 1%, 2% și 3% (10, 20 și 30 mg/kg/zi de clorhidrat de naftifină). În acest studiu nu au fost observate tumori legate de medicament până la cea mai mare doză evaluată în acest studiu, de 30 mg/kg/zi (de 12 ori MRHD pe baza comparației ASC).
Clorhidratul de naftifină nu a evidențiat nici o dovadă de potențial mutagen sau clastogen pe baza rezultatelor a două teste de genotoxicitate in vitro (testul Ames și testul de aberații cromozomiale în celule de ovar de hamster chinezesc) și a unui test de genotoxicitate in vivo (testul de micronucleu în măduva osoasă de șoarece).
Administrarea orală de clorhidrat de naftifină la șobolani, pe parcursul împerecherii, gestației, fătării și alăptării, nu a demonstrat efecte asupra creșterii, fertilității sau reproducerii, la doze de până la 100 mg/kg/zi (de 6 ori MRHD).
Studii clinice
Tinea cruris
Clorhidrat de naftifină în cremă a fost investigată pentru siguranță și eficacitate într-un studiu multicentric randomizat, dublu-orb, controlat cu vehicul, la 146 de subiecți cu tinea cruris simptomatic și cu culturi de dermatofiți pozitive. Subiecții au fost randomizați să primească clorhidrat de naftifină în cremă sau vehicul. Subiecții au aplicat crema de clorhidrat de naftifină sau vehiculul pe zona afectată plus o margine de ½ inch de piele sănătoasă din jurul zonei afectate, o dată pe zi, timp de 2 săptămâni. Au fost evaluate semnele și simptomele de tinea cruris (prezența sau absența eritemului, pruritului și descuamării), iar examinarea KOH și cultura de dermatofiți au fost efectuate la punctul final primar de eficacitate în săptămâna 4.
Vârsta medie a populației studiului a fost de 47 de ani, iar 87% au fost bărbați și 43% au fost de culoare albă. La momentul inițial, subiecților li s-a confirmat prezența semnelor și simptomelor de tinea cruris, examenul KOH pozitiv și prezența confirmată a dermatofitelor pe baza rezultatelor culturii de la un laborator central de micologie. Analiza populației cu intenție de tratament a constat în compararea proporțiilor de subiecți cu o vindecare completă la vizita din săptămâna 4 (a se vedea tabelul 1). Vindecarea completă a fost definită atât ca vindecare clinică (absența eritemului, a pruritului și a descuamării), cât și ca vindecare micologică (KOH și cultură de dermatofiți negative).
Procentul de subiecți care au prezentat vindecare clinică și procentul de subiecți care au prezentat vindecare micologică la săptămâna 4 sunt prezentate individual în tabelul 1 de mai jos.
|
Endpoint |
Naftifină clorhidrat cremă, 2% |
Vehicul |
|
|
N=75 |
N=71 |
N=71 |
|
|
Complet Curea |
19 (25%) |
2 (3%) |
|
|
Tratament eficientb |
45 (60%) |
7 (10%) |
|
|
Curecție micologică |
54 (72%) |
11 (16%) |
|
|
a. Vindecarea completă este un criteriu final compus atât din vindecarea micologică, cât și din vindecarea clinică. Cura clinică este definită ca absența eritemului, a pruritului și a descuamării (grad 0). |
|||
|
b. Tratamentul eficient este un preparat KOH negativ și o cultură de dermatofiți negativă, eritem, descuamare și prurit de gradele 0 sau 1 (absent sau aproape absent). |
|||
|
c. Vindecarea micologică este definită ca fiind KOH și cultura de dermatofiți negative. |
|||
Tinea pedis interdigitală
Clorhidratul de naftifină cremă a fost investigat pentru eficacitate într-un studiu multicentric, randomizat, dublu-orb, controlat cu vehicul, la 217 subiecți cu tinea pedis interdigitală simptomatică și cultură de dermatofiți pozitivă. Subiecții au fost randomizați să primească clorhidrat de naftifină în cremă sau vehicul. Subiecții au aplicat crema de clorhidrat de naftifină sau vehiculul pe zona afectată a piciorului, plus o margine de ½ inch de piele sănătoasă din jurul zonei afectate, o dată pe zi, timp de 2 săptămâni. Semnele și simptomele de tinea pedis interdigital (prezența sau absența eritemului, pruritului și descuamării) au fost evaluate, iar examinarea KOH și cultura de dermatofiți au fost efectuate la punctul final primar de eficacitate în săptămâna 6.
Vârsta medie a populației participante la studiu a fost de 42 de ani, iar 71% au fost bărbați și 57% au fost de culoare albă. La momentul inițial, subiecții au fost confirmați ca având semne și simptome de tinea pedis interdigitală, examen KOH pozitiv și cultură de dermatofiți confirmată. Criteriul principal de evaluare a eficacității a fost reprezentat de proporțiile de subiecți cu o vindecare completă la vizita din săptămâna 6 (a se vedea tabelul 2). Vindecarea completă a fost definită atât ca o vindecare clinică (absența eritemului, a pruritului și a descuamării), cât și ca o vindecare micologică (KOH și cultură de dermatofiți negativă).
Rezultatele eficacității la săptămâna 6, la patru săptămâni de la terminarea tratamentului, sunt prezentate în tabelul 2 de mai jos. Clorhidratul de clorhidrat de naftifină în cremă a demonstrat o vindecare completă la subiecții cu tinea pedis interdigitală, dar nu a fost demonstrată o vindecare completă la subiecții care prezentau doar tinea pedis de tip mocasin.
|
Endpoint |
Crema de clorhidrat de naftifină, 2% |
Vehicul |
|
|
N=147 |
N=70 |
N=70 |
|
|
Complet Curea |
26 (18%) |
5 (7%) |
|
|
Tratament eficientb |
83 (57%) |
14 (20%) |
|
|
Curecție micologică |
99 (67%) |
15 (21%) |
|
|
a. Vindecarea completă este un criteriu de evaluare compus atât din vindecarea micologică, cât și din vindecarea clinică. |
|||
|
b. Tratamentul eficient este un preparat KOH negativ și o cultură de dermatofiți negativă, eritem, descuamare și prurit de gradele 0 sau 1 (absent sau aproape absent). |
|||
|
c. Vindecarea micologică este definită ca fiind KOH și cultura de dermatofiți negative. |
|||
Tinea corporis
Clorhidratul de naftifină în cremă a fost investigat pentru siguranță și eficacitate într-un studiu multicentric, randomizat, dublu-orb, controlat cu vehicul, la 184 de subiecți cu tinea corporis simptomatic și cultură de dermatofiți pozitivă. Subiecții au fost randomizați să primească clorhidrat de naftifină în cremă sau vehicul. Subiecții au aplicat agentul de studiu pe toate suprafețele corporale afectate de tinea corporis, plus o margine de ½ inch de piele sănătoasă în jurul leziunilor afectate, timp de două săptămâni. Au fost evaluate semnele și simptomele tinea corporis (prezența sau absența eritemului, indurației și pruritului) și au fost efectuate examinarea KOH și cultura de dermatofiți pentru evaluarea criteriului principal de evaluare a eficacității în ziua 21.
Populația studiului a fost pediatrică (cu vârsta cuprinsă între 2 ani sau mai mare și mai puțin de 18 ani), cu o vârstă mediană de 9 ani (cremă de clorhidrat de naftifină) sau 8 ani (vehicul); 61% dintre subiecți au fost de sex masculin și 45% de culoare albă. La momentul inițial, subiecților li s-a confirmat prezența semnelor și simptomelor de tinea corporis, un examen KOH pozitiv și o cultură de dermatofiți confirmată. Criteriul principal de evaluare a eficacității a fost reprezentat de proporțiile de subiecți cu o vindecare completă la vizita din ziua 21. Vindecarea completă a fost definită atât ca o vindecare clinică (absența eritemului, a indurației și a pruritului pe toate leziunile prezente la momentul inițial), cât și ca o vindecare micologică (KOH și cultură de dermatofiți negative).
Rezultatele privind eficacitatea la Ziua 21, la o săptămână de la terminarea tratamentului, sunt prezentate în Tabelul 3 de mai jos.
|
Naftifină clorhidrat cremă, 2% |
Vehicul |
||
|
Endpoint |
N=91 |
N=93 |
|
|
Complet Curea |
42 (46%) |
26 (28%) |
. |
|
Tratament eficientb |
53 (58%) |
32 (34%) |
|
|
Curecție micologică |
57 (63%) |
36 (39%) |
|
|
a. Vindecarea completă este un criteriu de evaluare compus atât din vindecarea micologică, cât și din vindecarea clinică. |
|||
|
b. Tratamentul eficient este un preparat KOH negativ și o cultură de dermatofiți negativă, eritem, indurație și prurit de gradele 0 sau 1 (absente sau ușoare). |
|||
|
c. Vindecarea micologică este definită ca fiind KOH și cultura de dermatofiți negative. |
|||
CUM SE FURNIZEAZĂ/STOCARE ȘI MANIPULARE
Clorhidrat de naftifină cremă, USP 2%, este o cremă de culoare albă până la alb-deschis, furnizată în următorul format:
Tuburi de 45 de grame – NDC 70700-161-18
Tuburi de 60 de grame – NDC 70700-161-17
Depozitați crema de clorhidrat de naftifină la 25°C (77°F); sunt permise excursii până la 15° până la 30°C (59° până la 86°F) .
Informații privind consilierea pacienților
- Informați pacienții că crema de clorhidrat de naftifină este destinată exclusiv utilizării topice. Clorhidratul de naftifină cremă nu este destinat utilizării pe cale orală, intravaginală sau oftalmică.
- Dacă apare iritație sau sensibilitate la utilizarea clorhidratului de naftifină cremă, tratamentul trebuie întrerupt și trebuie instituit un tratament adecvat. Pacienții trebuie îndrumați să își contacteze medicul dacă aceste afecțiuni apar în urma utilizării clorhidratului de naftifină cremă.
Distribuit de:
Xiromed, LLC,
Florham Park, NJ 07932
Rev. 09/2020
PI-161-00
Eticheta ambalajului SECȚIUNEA PRINCIPALĂ A PANOULUI DE PREZENTARE – Tub de 45g

NDC 70700-161-18
Naftifina cremă, 2%
Xiromed, LLC
Pentru uz topic numai
Nu pentru uz oftalmic, Orală sau intravaginală
45 g
Doar pentru prescripție medicală
SECȚIUNEA PRINCIPALĂ DE ETICHETĂ A AMBALAJULUI – Tub de 60 g

NDC 70700-161-17
Naftifine Cream, 2%
Xiromed, LLC
Pentru uz topic numai
Nu pentru uz oftalmologic, Orală sau intravaginală
60 g
Doar pentru prescripție medicală
| NAFTIFINE HYDROCHLORIDE Clorhidrat de naftifină în cremă |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Eticheta – Xiromed, LLC (080228637)
Titularul înregistrării – Xiromed Pharma España, S.L. (468835741)
Mai multe despre naftifine topical
- Efecte secundare
- În timpul sarcinii sau alăptării
- Informații despre dozaj
- Prețuri & Cupoane
- En Español
- 7 Recenzii
- Clasa de medicament: Antifungice topice
Resurse pentru consumatori
- Informații pentru pacienți
- Naftifine Topical (lectură avansată)
Resurse pentru profesioniști
- Informații de prescriere
- Naftifine (Sfaturi profesionale pentru pacienți)
- Naftifine Gel (FDA)
Alte mărci Naftin
Ghiduri de tratament conexe
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Denunțare medicală
.