Figura 1. Calea de semnalizare a receptorului Toll-like
Ce este receptorul Toll-like?
Receptorii de tip Toll (TLR) sunt o clasă de proteine care joacă un rol cheie în imunitatea înnăscută. Aceștia sunt receptori trans-membranari cu un singur domeniu care aparțin receptorilor de recunoaștere a tiparelor (PRR) care se exprimă de obicei în celulele santinelă, cum ar fi macrofagele, celulele dendritice și multe alte celule neimunitare, cum ar fi fibroblastele și celulele epiteliale. Aceștia recunosc moleculele conservate din punct de vedere structural provenite de la microbi, denumite modele moleculare asociate agenților patogeni (PAMP), sau moleculele derivate din celulele deteriorate, denumite modele moleculare asociate deteriorării (DAMP). PAMP-urile includ diverse componente ale peretelui celular bacterian, cum ar fi lipopolizaharida (LPS), peptidoglicanul (PGN) și lipopeptidele, precum și flagelina, ADN-ul bacterian și ARN-ul dublu catenar viral. DAMP-urile includ proteine intracelulare, cum ar fi proteinele de șoc termic, precum și fragmente de proteine din matricea extracelulară. PRR-urile activează căile de semnalizare din aval care conduc la inducerea răspunsurilor imune înnăscute prin producerea de citokine inflamatorii, interferon de tip I (IFN) și alți mediatori. Aceste procese nu numai că declanșează răspunsuri defensive imediate ale gazdei, cum ar fi inflamația, dar, de asemenea, pregătesc și orchestrează răspunsurile imune adaptative specifice antigenului. Aceste răspunsuri sunt esențiale pentru eliminarea microbilor infectanți, precum și cruciale pentru instruirea consecventă a răspunsurilor imune adaptative specifice antigenului.
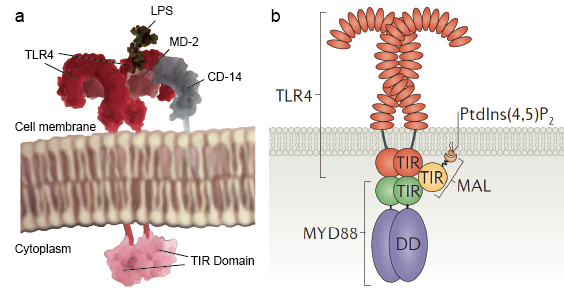
Figura 2. Diagrama schematică a structurii moleculare a TLRs.
Familia receptorilor de tip TLR
Familia TLR cuprinde 10 membri (TLR1-TLR10) la om și 12 (TLR1-TLR9, TLR11-TLR13) la șoarece. TLRs se localizează la suprafața celulară sau în compartimente intracelulare, cum ar fi ER, endosomul și lizozomul. TLR-urile de la suprafața celulară includ TLR1, TLR2, TLR4, TLR5, TLR6 și TLR10, în timp ce TLR-urile intracelulare sunt localizate în endosom și includ TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 și TLR13 (figura 1). TLR-urile de la suprafața celulară recunosc în principal componentele membranei microbiene, cum ar fi lipidele, lipoproteinele și proteinele. TLR intracelulare recunosc acizii nucleici derivați din bacterii și viruși și, de asemenea, recunosc acizii auto-nucleici în condiții de boală, cum ar fi autoimunitatea.
Funcția receptorilor Toll-like se bazează de obicei pe un proces de dimerizare a două molecule TLR, dar nu întotdeauna. De exemplu, TLR-1 și TLR-2 se vor lega unul de celălalt pentru a forma un dimer atunci când recunosc moleculele PAMPs care includ în principal lipoproteine, peptidoglicani, acizi lipoteici (LTA, Gram-), zymosan, manan și tGPI-mucină. TLR-2 poate, de asemenea, să formeze un dimer cu TLR-6 atunci când recunosc aceleași PAMP-uri enumerate mai sus. TLR-4 poate recunoaște lipopolizaharida (LPS, Gram+) și poate forma un homodimer cu o altă moleculă TLR-4. TLR-5 poate recunoaște flagelina bacteriană, dar nu formează un dimmer. TLR-11 este funcțional la șoareci și recunoaște în principal bacteriile uropatogene. TLR-3, 7, 8, 8, 9, 13 sunt exprimate pe suprafața endosomului în citoplasmă. TLR3 recunoaște ARN dublu catenar viral (dsRNA), ARN-uri mici de interferență și ARN-uri proprii derivate din celule deteriorate. TLR-7 este exprimat predominant în DC plasmacitoide (pDC) și recunoaște ARN monocatenar (ss) provenit de la viruși. Recunoaște, de asemenea, ARN din bacteriile streptococului B în DC convenționale (cDC). TLR8 răspunde la ARN viral și bacterian. TLR-9 recunoaște ADN-ul bacterian și viral care este bogat în motive CpG-ADN nemetilate. TLR13 recunoaște ARNr 23S bacterian și componente necunoscute ale virusului stomatitei veziculare.
Deși există atât de multe tipuri de molecule TLR care recunosc o gamă largă de liganzi, toate aceste TLR-uri au un cadru structural comun în domeniile lor extracelulare de legare a liganzilor. Aceste domenii adoptă toate structuri în formă de potcoavă construite din motive repetate bogate în leucină. În mod obișnuit, la legarea ligandului, două domenii extracelulare formează un dimer în formă de ”m”, care ia în sandwich molecula de ligand, aducând domeniile transmembranar și citoplasmatic în imediata apropiere și declanșând o cascadă de semnalizare în aval (Figura 2).
Calea de semnalizare a receptorilor de tip TLR
1. Cascada de semnalizare a receptorilor Toll-like
Receptorii Toll-like permit celulelor santinelă, cum ar fi macrofagele, să detecteze microbii prin intermediul PAMP-urilor, cum ar fi LPS. LPS este o componentă a peretelui celular bacterian. Mecanismul de recunoaștere a lipopolizaharidelor de către receptorii Toll-like este complex și necesită mai multe proteine accesorii. O proteină serică, proteina de legare a LPS, se leagă de monomerii LPS și o transferă la o proteină numită CD14. CD14 poate fi solubilă sau se poate lega de suprafața celulară prin intermediul unei ancore de glicozilfosfatidilinositol. CD14 livrează și încarcă LPS la domeniul extracelular al receptorilor Toll-like. TLR-urile sunt capabile să detecteze LPS cu ajutorul unei proteine de accesoriu numită MD-2. Apoi, homodimerizarea TLR-urilor este indusă atunci când LPS se leagă de complexul TLR-CD14-MD2. Schimbarea conformațională a domeniilor extracelulare inițiază dimerizarea domeniului citoplasmatic al receptorului Toll IL-1 (TIR). Schimbarea conformațională a TIR oferă o nouă schelă care permite recrutarea proteinelor adaptoare pentru a forma un complex de semnalizare post-receptor. TIR-ul care conține o proteină adaptoare proteina 88 de răspuns primar la diferențierea mieloidă (MyD88).
MyD88 funcționează ca un adaptor care leagă TLRs/IL-1Rs de moleculele de semnalizare din aval care au DDs. Recunoaște modificarea conformațională în domeniul TIR al TLR-urilor, se leagă de noul complex de receptori și transferă semnalizarea prin interacțiunea domeniului de moarte (DD) amino (N)-terminal cu kinazele asociate IL-1R (IRAKs). Din aceste rezultate rezultă o cascadă complexă cu invente de semnalizare care avertizează celula de invazia agentului patogen. Există 4 IRAK-uri (IRAK 1, 2, 4, M). Acestea conțin un DD N-terminal și un domeniu central de serină/treonină-kinază. IRAK1 și IRAK4 au activitate kinazică intrinsecă, în timp ce IRAK2 și IRAK-M nu au activitate kinazică detectabilă. IRAK4 este activată de MyD88 și continuă să activeze IRAK1. IRAK1 activează apoi TRAF6 din aval. TRAF6 este un membru al familiei de factori asociați cu receptorul factorului de necroză tumorală (TNFR) care mediază căile de semnalizare a citokinelor. La stimulare, TRAF6 este recrutat în complexul receptor și activat de IRAK-1 care se leagă de domeniul TRAF al TRAF6. Apoi, complexul IRAK-1/TRAF6 se disociază de receptor și se asociază cu kinaza 1 activată de TGF-beta (TAK1) și cu proteinele de legare a TAK1, TAB1 și TAB2. Complexul format din TRAF6, TAK1, TAB1 și TAB2 se deplasează în citoplasmă, unde formează un complex mare cu alte proteine, cum ar fi ligazele E2 Ubc13 și Uev1A. S-a demonstrat că complexul Ubc13 și Uev1A catalizează sinteza unui lanț de polisubiquitină legat de Lys 63 al TRAF6 și, astfel, induce activarea TAK1 mediată de TRAF6 și, în final, a NF-kB. Aceste căi de semnalizare descrise mai sus se numesc căi dependente de MyD88, deoarece semnalul pornește de la molecula MyD88. Există, de asemenea, o altă cale numită cale MyD88-independentă, în care semnalizarea nu pornește de la MyD88. În schimb, semnalul pornește de la proteina TRIF. TRIF interacționează cu TRAF6 și TRAF3.TRAF6 recrutează kinaza RIP-1, care, la rândul ei, interacționează cu complexul TAK1 și îl activează, ceea ce duce la activarea NF-kB și a MAPK-urilor și la inducerea citokinelor inflamatorii. În schimb, TRAF3 recrutează kinazele legate de IKKTBK1 și IKKi împreună cu NEMO pentru fosforilarea și activarea IRF3. IRF3 formează un dimer și se translocă în nucleu din citoplasmă, induce expresia IFN de tip I.
2. Semnalizarea în aval
TLR-urile semnalează de fapt în principal prin recrutarea unor molecule adaptoare specifice, conducând la activarea factorilor de transcripție NF-kB și IRF, care dictează rezultatul răspunsurilor imune înnăscute. Așadar, această cale de semnalizare în aval constă în activarea factorului de transcripție IRFs, a căii de semnalizare NF-kB și a căii MAKP. Puteți găsi mai multe informații detaliate despre calea NF-kB și MAKP din:
Calea de semnalizare NF-kB, calea de semnalizare P38 și calea de semnalizare MAKP.
3. Reglarea căii
Deoarece există o anumită reglementare negativă de către o serie de molecule prin diverse mecanisme pentru a preveni sau a pune capăt răspunsurilor imune excesive care duc la consecințe dăunătoare asociate cu autoimunitatea și bolile inflamatorii. Activarea căii MyD88-dependente este suprimată de ST2825, SOCS1 și Cbl-b, iar activarea căii TRIF-dependente este suprimată de SARM și TAG. Aceste molecule se asociază cu MyD88 sau TRIF pentru a le împiedica să se lege la TLR-uri sau la moleculele din aval. Activarea TRAF3 este reglată negativ de SOCS3 și DUBA. TRAF6 este vizat de o serie de molecule inhibitoare, cum ar fi A20, USP4, CYLD, TANK, TRIM38 și SHP. Activarea TAK1 este inhibată de TRIM30a și A20.
4. Relația cu bolile
Deoarece TLR este implicat în detectarea LPS și ar putea avea un rol în sepsis, direcționarea TLR-urilor este importantă pentru tratamentul mai multor boli. Pe lângă interferarea răspunsurilor TLR pentru tratarea infecțiilor cu agenți patogeni, o aplicație clinică evidentă a cunoștințelor dobândite în urma studiilor TLR a fost utilizarea liganzilor TLR ca adjuvanți pentru vaccinuri. Mai mult, s-a încercat, de asemenea, inhibarea TLR în clinică, al cărei scop este de a limita inflamația excesivă care se presupune că este determinată de supraactivarea unui anumit TLR.
| Takeda, Kiyoshi și Shizuo Akira. „Căile de semnalizare TLR”. Seminare în imunologie. Vol. 16. Nr. 1. Academic Press, 2004. | |
| Akira, Shizuo, și Kiyoshi Takeda. „Toll-like receptor signalling”. Nature reviews immunology 4.7 (2004): 499-511. | |
| Lim, Kian-Huat, și Louis M. Staudt. „Toll-like receptor signaling”. Cold Spring Harbor perspectives in biology 5.1 (2013): a011247. | |
| șiTaro Kawai, Takumi Kawasaki. „Toll-like receptor signaling pathways” (Căile de semnalizare a receptorilor Toll-like). Pattern Recognition Receptors and Cancer 8916 (2015): 7. | |
| Gay, Nicholas J., et al. „Assembly and localization of Toll-like receptor signalling complexes”. Nature reviews Immunology 14.8 (2014): 546-558. | |
| O’Neill, Luke AJ, Douglas Golenbock, și Andrew G. Bowie. „The history of Toll-like receptors redefining innate immunity” (Istoria receptorilor de tip Toll care redefinesc imunitatea înnăscută). Nature Reviews Immunology 13.6 (2013): 453-460. | |
| Botos, Istvan, David M. Segal, and David R. Davies. „The structural biology of Toll-like receptors” (Biologia structurală a receptorilor Toll-like). Structure 19.4 (2011): 447-459. |
.