Cellen från vilken grenen kommer ut är den konidiofora fotcellen, som skiljer sig från andra vegetativa celler genom att den har en brunpigmenterad sekundär vägg som är förtjockad på insidan av sin ursprungliga vägg. Stjälken växer apikalt tills den når en längd av ca 100 µm då spetsen sväller och bildar den konidiofora vesikeln som har en diameter av ca 10 µm. Ett enda lager av många primära sterigmata, så kallade metulae, knoppar sedan av från vesikeln och sekundära sterigmata, phialiderna, knoppar av från metulaes exponerade spetsar. Phialiderna är stamcellerna som sedan genomgår upprepade asymmetriska delningar för att bilda de långa kedjorna av enteroblastiska konidier som är ungefär 3 µm i diameter (fig. 7).
Klassisk genetisk analys, genom isolering och analys av mutanter, fastställde den grundläggande genetiska strukturen för Aspergillus konidiering. Mellan 300 och 1 000 genloci uppskattades vara berörda av konidiering genom att jämföra mutationsfrekvenser vid loci som påverkar konidiering med frekvenser för andra funktioner (Martinelli & Clutterbuck, 1971). Analys av mRNA-arter visade att ungefär 6 000 uttrycktes i vegetativt mycel och ytterligare 1 200 hittades i kulturer som innehöll konidiophorer och konidier; 200 av dessa ytterligare mRNA fanns i själva konidierna. Endast cirka 2 % av de mutanter av A. nidulans som saknade konidier hade defekter i de stadier som rörde tillväxt och utveckling av konidiophorerna, och 85 % av mutanterna med konidier var också defekta i den vegetativa hyfertillväxten och när det gällde att uppnå kompetens.
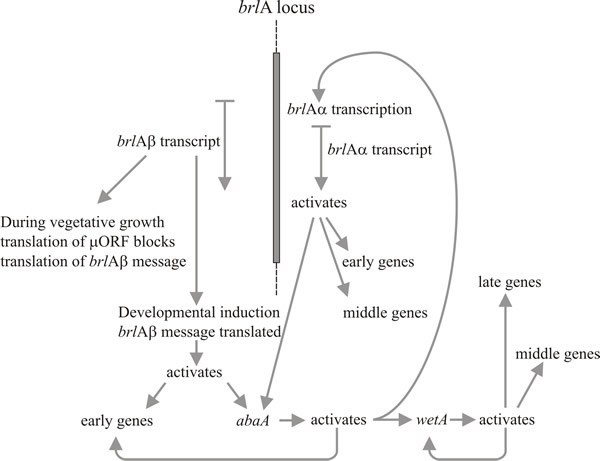
Särskilt två gener spelar en nyckelroll i morfogenesen för konidiophora: dessa är genen ”borst” (brlA), som har defekter vid bildning av vesiklar och metula, och genen ”abacus” (abaA), där konidier ersätts av pärlformade längder av hyfer, vilket innebär att den förmodligen är defekt vid konidieknoppning från phialiden och vid den slutliga septationen. En tredje gen, wetA, är defekt i ett tidigt skede av sporernas mognad. Konidier från wetA-mutanter saknar pigment och hydrofobicitet; de autolyseras efter några timmar och misslyckas med att uttrycka en rad sporspecifika mRNA:er. WetA-genens transkript saknas i brlA- och abaA-mutanter (dvs. brlA och abaA är epistatiska till wetA), och studier av dubbla mutanter visar att dessa tre gener verkar i följande ordning: brlA → abaA → wetA.
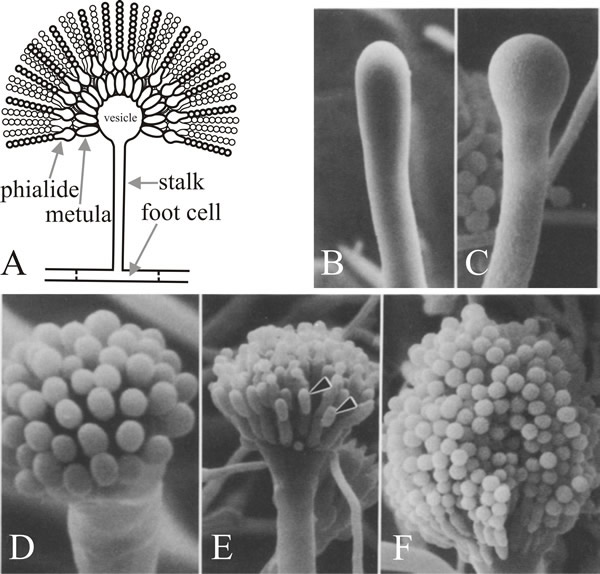
Ett slående inslag i mutationsanalysen av konidioforutvecklingen hos A. nidulans är att mutanter av endast dessa tre gener orsakar defekter i morfogenesen av konidioforer och sporer, medan upp till 1 000 andra genloci orsakar avsaknad av konidiebildning när de muteras. Detta innebär att brlA, abaA och wetA är regulatorer som integrerar uttrycket av andra gener som behövs för konidiering men som inte själva är avsedda för detta. Många av Aspergillus konidieringsmutanter var också defekta när det gäller sexuell reproduktion, så en annan slutsats som kan dras är att det finns en viss ekonomi i användningen av morfogenetiska gener i olika utvecklingsprocesser. Det är troligt att olika utvecklingssätt använder strukturella gener som inte är unikt utvecklingsrelaterade utan fungerar i många olika vägar, och som får sin utvecklingsspecifika karaktär av de regulatorer som de reagerar på. Detta symboliseras av idén att nyckeln till eukaryote utveckling ligger i förmågan att använda relativt få regulatoriska gener för att integrera aktiviteterna hos många andra.
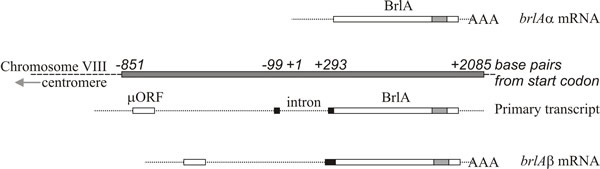
Molekylär analys stöder tolkningen att brlA, abaA och wetA är regulatorer; brlA-sekvensen kodar för ett zinkfingerprotein som är en sekvensspecifik DNA-bindande transkriptionsaktivator av utvecklingsreglerade målgener (fig. 8). Detta är dock inte hela sanningen, eftersom brlA-produkten har olika affiniteter för olika målgener. Faktum är att brlA-lokusen består av överlappande transkriptionsenheter (fig. 9), där nedströmsenheten benämns brlAα och uppströmsenheten brlAβ. Mellan dem löser deras produkter två klassiska utvecklingsproblem, nämligen hur man reagerar på en signal och hur man upprätthåller den reaktionen när signalen har försvunnit.
De två brlA-transkriptionerna delar samma läsram i större delen av sin längd, men brlAβ har ytterligare 23 aminosyrarester i den aminoterminala änden av denna läsram, och dess transkript har också en separat läsram med 41 aminosyrarester (kallad µORF) nära sin 5′-terminus. µORF-produkten undertrycker translation från läsramen nedströms (BrlA) och även om brlAβ-transkriptet kan påvisas i vegetativa hyfer produceras inte BrlA-peptiden. Repressionen som orsakas av µORF övervinns först när mycelet är kompetent, vilket troligen signaleras som en kvävebegränsning (en vanlig miljösignal för initiering av sporulering i Ascomycota), vilket minskar aminoacyl-tRNA-poolerna och stör översättningsregleringen genom µORF. När effekten av µORF är avbruten kan BrlA-peptiden översättas från befintligt transkript.
Upptäckaren av denna process beskrev aktiveringen av konidiationsvägen som ”translational triggering” (Timberlake, 1993), vilket tyder på att translational triggering är ett sätt att göra differentieringen känslig för hypans näringsstatus. Den kompetenta hypan är alltså förberedd för att påbörja konidioforutvecklingen, men den irreversibla aktiveringen av konidieringsvägen förhindras av en translationell repression som upprätthåller den vegetativa tillväxten tills sporuleringsförhållandena är idealiska.
Aktivering av brlA ses därför som det första steget i konidiophorutveckling, och dess produkt aktiverar i sin tur en panel av konidiationsspecifika gener, bland vilka nästa regulator, abaA, finns. AbaA-produkten är också ett DNA-bindande transkriptionsreglerande protein som ökar uttrycket av brlA-inducerade strukturgener. Generna brlA och abaA är ömsesidiga aktivatorer, eftersom abaA också aktiverar brlA. Naturligtvis måste brlA-uttryck ske innan abaA kan uttryckas, men den därav följande abaA-aktiveringen av brlA förstärker brlA-uttrycket av den senare och gör i själva verket att utvecklingen av vägen är oberoende av yttre händelser. AbaA-produkten aktiverar också ytterligare strukturgener och den sista regulatoriska genen, wetA, som aktiverar sporspecifika strukturgener. Eftersom brlA och abaA inte uttrycks i differentierande konidier är wetA troligen inblandad i inaktiveringen av deras uttryck i sporerna (och kanske också i phialiden; när den aktuella sporekärnan når det mognadsstadium som behöver wetA-reglerade gener måste phialidkärnorna ”vändas tillbaka” till konidie-initieringstillståndet för att påbörja bildandet av nästa spor). Uttrycket av wetA aktiveras initialt i phialiden genom sekventiell verkan av brlA och abaA, och det är sedan autoreglerat (wetA-produkten aktiverar wetA-transkriptionen). Positiv autoreglering av wetA upprätthåller därefter dess uttryck efter det att konidiet har separerats (fysiskt och cytologiskt) från phialiden.
Timberlake (1993) kallade denna mekanism för återkopplingsfixering: ömsesidig aktivering, återkopplingsaktivering och autoreglering av de centrala regulatoriska sekvenserna förstärker uttrycket av hela vägen, vilket gör den oberoende av de externa miljömässiga signaler som initierade den och gör det möjligt för sporen att fortsätta mognadsprocessen även efter separation från phialiden. Konidiophoreutvecklingen är liksom många andra morfogenetiska processer naturligt uppdelad i sekventiella steg. Detta regleringsnätverk visar hur translationell utlösning kan koppla en morfogenetisk väg till kompetensutveckling å ena sidan och till initiering som svar på miljömässiga signaler å andra sidan. Efter initiering resulterar återkopplingsfixering i utvecklingsbestämning i den klassiska embryologiska betydelsen av fortsatt morfogenes även när man avlägsnat sig från den initierande miljön.
Vi valde medvetet att i det här avsnittet basera vår beskrivning på forskning som utfördes för cirka 50 år sedan och som började med att isolera ett stort antal mutationer med förändrade fenotyper för konidiering och fortsatte med ”klassiska” studier av gen-segregationer och genkomplementering (Martinelli & Clutterbuck, 1971). Förutom att visa hur vår förståelse av sporulering har åstadkommits, visar den värdet av att använda dessa ”gammaldags” tekniker för att undersöka sådana fenomen.
Det går dock inte att bortse från den omfattande forskning som har slutförts om de molekylära mekanismer som ligger till grund för tillväxt och utveckling av Aspergillus. Dessa studier har bekräftat att den viktigaste händelsen vid sporulering är aktivering av zinkfingertranskriptionsfaktorn som kodas av brlA, och att abaA- och wetA-generna är nödvändiga regulatorer av konidiering. Den abaA-kodade transkriptionsfaktorn aktiveras av brlA efter differentiering av metulae och under de mellersta stadierna av konidieutvecklingen, och genenwetA, som aktiveras av abaA, fungerar i den sena fasen av konidiebildningen genom att styra syntesen av viktiga cellväggskomponenter och omvandla ämnesomsättningen hos det mognande konidiet. I Aspergillus nidulans skapar dessa tre gener den centrala regleringsvägen, som tillsammans med andra gener kontrollerar det konidiationsspecifika genuttrycket och sekvensen av genaktivering som är involverad i förvärvet av utvecklingskompetens, konidiophorutveckling och spormognad (Lee et al., 2016).
Många aspekter av dessa utvecklingsvägar har bevarats i andra aspergiller. Medlemmar av släktet Aspergillus är bland de vanligaste svamparna och alla förökar sig asexuellt genom att bilda långa kedjor av konidier. Flera arter, däribland Aspergillus oryzae och Aspergillus niger, används inom industrin för enzymproduktion och livsmedelsbearbetning, medan Aspergillus flavus är ansvarig för livsmedelsförstöring genom att producera de mest potenta kända naturligt förekommande cancerframkallande ämnena, aflatoxinerna. En annan art som ger anledning till oro är den opportunistiska humanpatogenen Aspergillus fumigatus, som producerar ett stort antal små hydrofoba konidier som sitt främsta spridningsmedel och som har blivit en utbredd luftburen svamppatogen i de utvecklade länderna. Hos patienter med nedsatt immunförsvar orsakar A. fumigatus en invasiv aspergillos med hög dödlighet. Utvecklingssignalvägen BrlA-AbaA-WetA har bevarats vid konidiering av dessa Aspergillus-arter (Yu, 2010; Tao & Yu, 2011; Krijgsheld et al., 2013). Vidare har proteomiska, transkriptomiska och metabolomiska studier gett en detaljerad bild av de dynamiska förändringar som sker i många tusentals gener, transkript, enzymer och metaboliska reaktioner under bildning, mognad, vila och groddning av Aspergillus konidier (van Leeuwen et al., 2013; Novodvorska et al., 2016; Teertstra et al., 2017).
Uppdaterad juli 2019