Ioniseringsenergier för s- och p-blockelement
Ioniseringsenergierna för grundämnena i den tredje raden i det periodiska systemet uppvisar samma mönster som för \(Li\) och \(Be\) (tabell \(\(\PageIndex{2}\)): De successiva joniseringsenergierna ökar stadigt när elektroner avlägsnas från valensorbitalerna (3s eller 3p i det här fallet), följt av en särskilt stor ökning av joniseringsenergin när elektroner avlägsnas från fyllda kärnnivåer, vilket indikeras av den fetstilade diagonala linjen i tabell \(\(\PageIndex{2}\)). I den tredje raden i det periodiska systemet motsvarar således den största ökningen av joniseringsenergin när man tar bort den fjärde elektronen från \(Al\), den femte elektronen från Si och så vidare – det vill säga när man tar bort en elektron från en jon som har den föregående ädelgasens valenselektronkonfiguration. Detta mönster förklarar varför grundämnenas kemi normalt endast omfattar valenselektroner. Det krävs för mycket energi för att antingen ta bort eller dela de inre elektronerna.
| Element | \(I_1\) | \(I_2\) | \(I_3\) | \(I_4\) | \(I_5\) | \(I_6\) | \(I_7\) | |
|---|---|---|---|---|---|---|---|---|
| *Inner-skalelektron | ||||||||
| Na | 495.8 | 4562.4* | – | – | – | – | – | – |
| Mg | 737.7 | 1450.7 | 7732.7 | – | – | – | – | |
| Al | 577.4.4 | 1816.7 | 2744.8 | 11 577.4.4 | – | – | – | |
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16 090.6 | – | – | |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – | |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4.3 | |
| Cl | 1251.2 | 2297.7 | 3822 | 5158.6 | 6540 | 9362 | 11 018,2 | |
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 | |
Exempel \(\PageIndex{1}\): Högsta fjärde joniseringsenergi
Utifrån deras placering i det periodiska systemet, förutse vilket av dessa grundämnen som har den högsta fjärde joniseringsenergin: B, C eller N.
Givet: tre grundämnen
Sökt: grundämne med högsta fjärde joniseringsenergi
Strategi:
- Lista upp elektronkonfigurationen för varje grundämne.
- Bestäm om elektroner avlägsnas från ett fyllt eller delvis fyllt valensskal. Förutsäg vilket grundämne som har den högsta fjärde joniseringsenergin och inse att den högsta energin motsvarar avlägsnande av elektroner från en fylld elektronkärna.
Lösning:
A Dessa grundämnen ligger alla i den andra raden i det periodiska systemet och har följande elektronkonfigurationer:
- B: 2s22p1
- C: 2s22p2
- N: Den fjärde joniseringsenergin för ett grundämne (\(I_4\)) definieras som den energi som krävs för att avlägsna den fjärde elektronen:
\
Eftersom kol och kväve har fyra respektive fem valenselektroner motsvarar deras fjärde joniseringsenergier att man avlägsnar en elektron från ett delvis fyllt valensskal. Den fjärde joniseringsenergin för bor motsvarar dock att man tar bort en elektron från det fyllda 1s2-underskalet. Detta borde kräva mycket mer energi. De faktiska värdena är följande: B, 25 026 kJ/mol, C, 6223 kJ/mol och N, 7475 kJ/mol.
Övning \(\PageIndex{1}\): Lägsta andra joniseringsenergi
Utifrån deras placering i det periodiska systemet, förutse vilket av dessa grundämnen som har den lägsta andra joniseringsenergin: Svar
\(\ce{Sr}\)
Den första kolumnen med data i tabell \(\PageIndex{2}\) visar att den första joniseringsenergin tenderar att öka över den tredje raden i det periodiska systemet. Detta beror på att valenselektronerna inte skärmar av varandra särskilt väl, vilket gör att den effektiva kärnladdningen ökar stadigt över raden. Valenselektronerna dras därför starkare till kärnan, vilket gör att atomstorlekarna minskar och joniseringsenergierna ökar. Dessa effekter utgör två sidor av samma mynt: starkare elektrostatiska interaktioner mellan elektronerna och kärnan ökar ytterligare den energi som krävs för att avlägsna elektronerna.
Däremot minskar den första joniseringsenergin vid Al (3s23p1) och vid S (3s23p4). Elektronkonfigurationerna hos dessa ”undantag” ger svaret på varför. Elektronerna i aluminiums fyllda 3s2-underskal är bättre på att skärma av 3p1-elektronen än de är på att skärma av varandra från kärnladdningen, så s-elektronerna tränger närmare kärnan än vad p-elektronen gör och p-elektronen avlägsnas lättare. Minskningen vid S sker eftersom de två elektronerna i samma p-orbital stöter bort varandra. Detta gör S-atomen något mindre stabil än vad som annars skulle förväntas, vilket gäller för alla grundämnen i grupp 16.
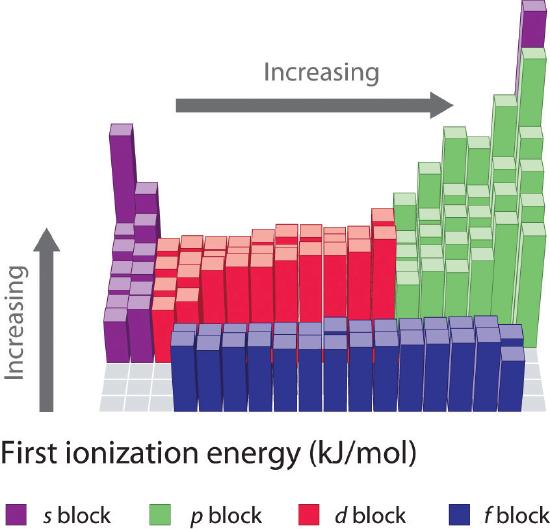
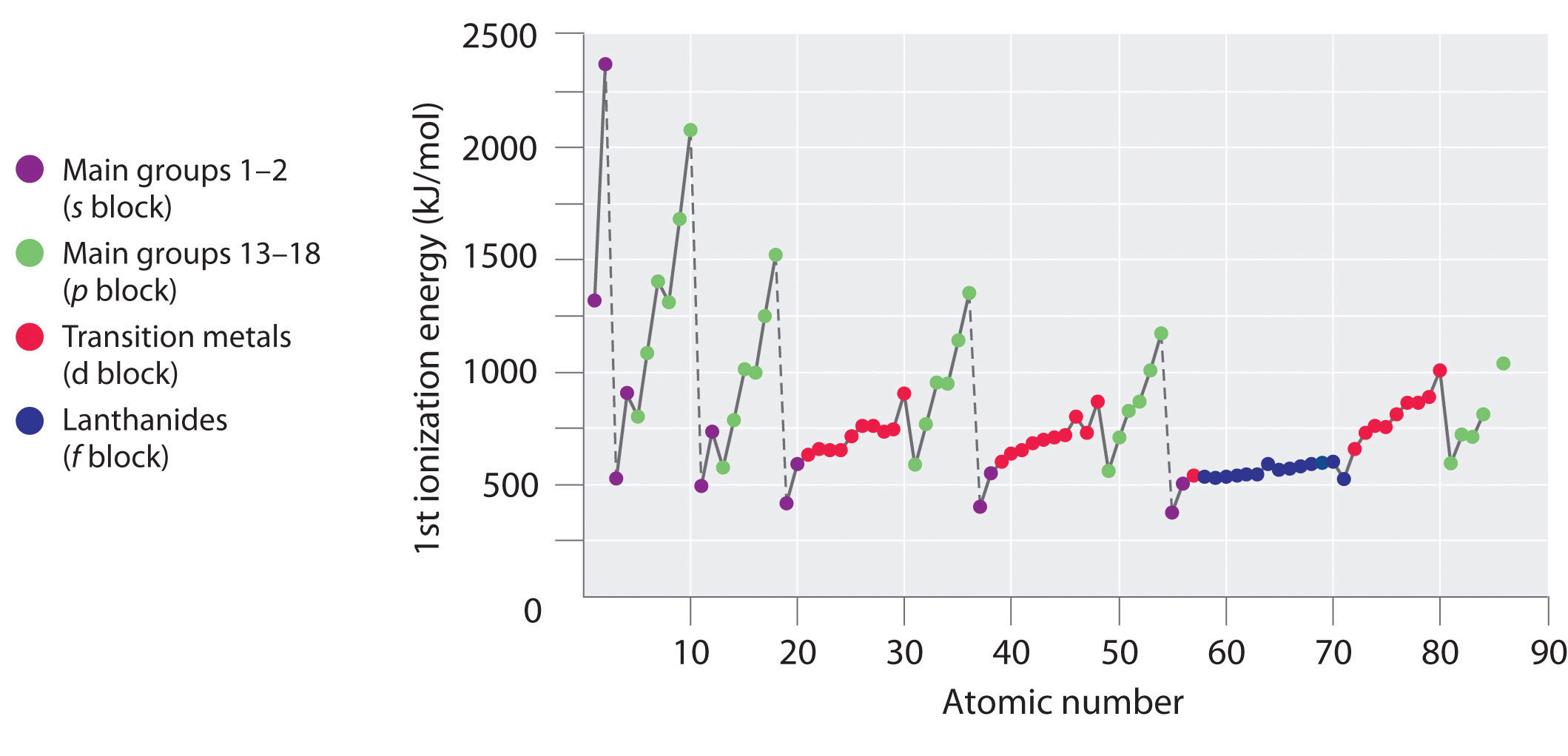
De första joniseringsenergierna för grundämnena i de sex första raderna i det periodiska systemet visas i figur \(\PageIndex{1}\) och presenteras numeriskt och grafiskt i figur \(\PageIndex{2}\). Dessa figurer illustrerar tre viktiga tendenser:
- Förändringarna i den andra (Li till Ne), fjärde (K till Kr), femte (Rb till Xe) och sjätte (Cs till Rn) raden i s- och p-blocken följer ett mönster som liknar det mönster som beskrivits för den tredje raden i det periodiska systemet. Övergångsmetallerna ingår dock i den fjärde, femte och sjätte raden, och lantaniderna ingår i den sjätte raden. De första joniseringsenergierna för övergångsmetallerna liknar varandra i viss mån, liksom för lantaniderna. Joniseringsenergierna ökar från vänster till höger över varje rad, med avvikelser som uppstår vid ns2np1 (grupp 13), ns2np4 (grupp 16) och ns2(n – 1)d10 (grupp 12).
- De första joniseringsenergierna minskar i allmänhet nedåt i en kolumn. Även om det huvudsakliga kvantantalet n ökar nedåt i en kolumn är fyllda inre skal effektiva för att skärma av valenselektronerna, så det blir en relativt liten ökning av den effektiva kärnladdningen. Följaktligen blir atomerna större när de får elektroner. Valenceelektroner som befinner sig längre bort från kärnan är mindre hårt bundna, vilket gör dem lättare att avlägsna, vilket gör att joniseringsenergierna minskar. En större radie motsvarar vanligtvis en lägre joniseringsenergi.
- På grund av de två första tendenserna ligger de grundämnen som lättast bildar positiva joner (har de lägsta joniseringsenergierna) i det nedre vänstra hörnet av det periodiska systemet, medan de som är svårast att jonisera ligger i det övre högra hörnet av det periodiska systemet. Följaktligen ökar joniseringsenergierna i allmänhet diagonalt från nedre vänster (Cs) till övre höger (He).

Generellt ökar \(I_1\) diagonalt från den nedre vänstra delen av det periodiska systemet till den övre högra delen.
Gallium (Ga), som är det första grundämnet efter den första raden av övergångsmetaller, har följande elektronkonfiguration: Gallium (Ga) är det första grundämnet efter den första raden av övergångsmetaller: 4s23d104p1. Dess första joniseringsenergi är betydligt lägre än den för det omedelbart föregående grundämnet, zink, eftersom galliums fyllda 3d10-underskal ligger innanför 4p-underskalet och skyddar den enda 4p-elektronen från kärnan. Experiment har avslöjat något av ännu större intresse: den andra och tredje elektronen som avlägsnas när gallium joniseras kommer från 4s2-orbitalet, inte från 3d10-underskalet. Galliums kemi domineras av den resulterande Ga3+-jonen, med dess 3d10-elektronkonfiguration. Denna och liknande elektronkonfigurationer är särskilt stabila och förekommer ofta i de tyngre grundämnena i p-blocket. De kallas ibland för pseudoädelgaskonfigurationer. För grundämnen som uppvisar dessa konfigurationer är inga kemiska föreningar kända där elektroner avlägsnas från det (n – 1)d10-fyllda underskalet.