T-regulatoriska celler (Tregs), tidigare kända som T-suppressorceller, är en delmängd av T-celler som har en direkt roll i både autoimmunitet och respons mot patogener.
Tregs minskar inflammation via utsöndring av immunosuppressiva cytokiner (IL-10, TGF-b) och även genom direkt undertryckande av inflammatoriska effektor-T-celler (t.ex. Th1- och Th17-celler).
Tregs kontrollerar och förebygger troligen autoimmuna sjukdomar genom att bidra till upprätthållandet av tolerans mot självantigener. Den terapeutiska nyttan av Treg-överföring är väletablerad i djurmodeller och insatser för att påbörja mänskliga Treg-behandlingar pågår för transplantationer och patienter med typ 1-diabetes.
Med tanke på betydelsen av denna unika undergrupp av T-celler i så många immunsvar känner sig många utredare försummade om de immunofenotyparbetar sina intressanta cellpopulationer utan att inkludera en Treg-mätning i blandningen. Men det kan vara komplicerat att kvantifiera Tregs.
Till exempel – Vilka är de bästa markörerna att använda? Hur vet man säkert att man mäter verkliga suppressor-T-celler?
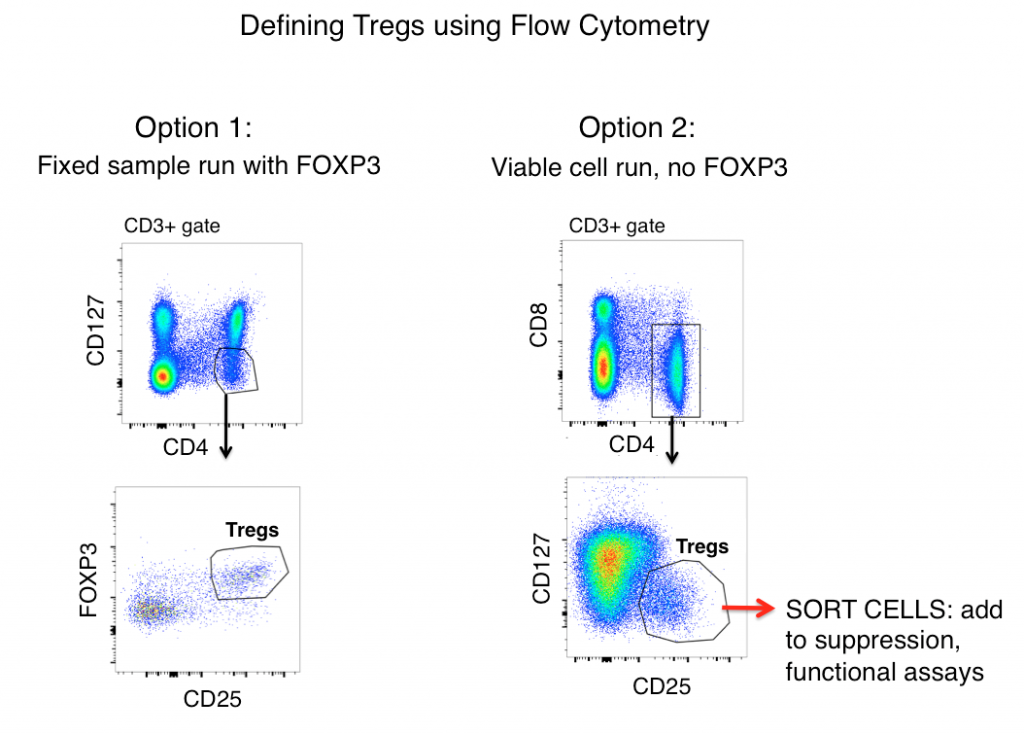
Gatingstrategier för att definiera Tregs med hjälp av flödescytometri
Standardstrategin för gating av Tregs för både mus- och humana prover (efter att först ha gattat ut dubbleringar och gattat på levande celler) omfattar antigenerna CD3, CD4, CD25, FOXP3 och CD127.
När man enbart tittar på antigenuttryck definieras Tregs ofta som CD3+, CD4+, CD25hi, FOXP3+ och CD127lo (visas i figuren nedan som alternativ 1). Med hjälp av dessa markörer kan man ofta se en tydlig population från prover som t.ex. mussplenocyter och humana PBMC.
Aktiverade T-celler uppreglerar dock ofta CD25, och FOXP3-uttryck har påträffats på ”effektor”- (icke-suppressiva) T-cellslinjer. När man därför förlitar sig på enbart flödescytometrisk fenotypning för att definiera Tregs kan inflammatoriska T-celler vara en varg i fårakläder (Tregs) och leda till felaktig datatolkning.
En cell kan se ut som en anka, men kvackar den? Mätning av effektorfunktionerna hos din eventuella Treg-population kommer i hög grad att bidra till att belysa noggrannheten hos din strategi för flödesgating. För att avgöra om de celler som du definierar som Tregs funktionellt liknar dem, innebär alternativ 2 (se nedan) att du utelämnar FOXP3 från din panel, sorterar CD3+, CD4+, CD25hi, CD127lo-celler och sedan bestämmer funktionerna hos din ”Treg”-population genom cytokinanalys och/eller suppressionskokulturförsök med T-celler som inte är Treg-celler (CD3+, CD4+, CD25-, CD127hi). Vanligtvis kan FOXP3 inte inkluderas i paneler där livskraftiga celler krävs efter sortering eftersom intracellulär färgning krävs.
Definiering av den ökande mångfalden av Treg-undergrupper
Det finns många olika sorters Tregs, däribland tTregs, pTregs och iTregs.
Tregs (även kallade nTregs) genereras till exempel i thymus och har en TcR-repertoar som är inriktad på egna peptider. En annan smak, känd som pTregs, genereras i periferin, och iTregs induceras i kultur via TGF-b.
Det finns makers som är associerade med dessa olika Treg-undergrupper och de bör övervägas för att inkluderas i en Treg-antikroppspanel om det är av intresse att subsettera dem. Hos människor anses till exempel CD39 vara en tillförlitlig tTreg-markör. Dessutom har Helios i både möss och människor visat sig tillförlitligt skilja tTregs från p- och iTreg-undergrupperna.
Definiera en enskild cell som en Treg – är det möjligt?
En stor begränsning inom Treg-området är bristen på en test för undertryckning av en enskild cell.
Definiering av en enskild T-cell som medlem av en distinkt minnessläkt, t.ex. Th1, Th2 eller Th17, kan åstadkommas genom analys med upplösning på en enskild cell, t.ex. intracellulär cytokinfärgning, eftersom dessa celler i första hand, om inte uteslutande, definieras av vilka cytokiner de producerar.
För att visa att en enskild cell är en Treg-cell vill vi dock helst kunna kvantifiera att denna utvalda cell kan undertrycka funktionen hos effektor-T-celler (eller andra cellundergrupper) i samkultur. För närvarande är det enda sättet att testa Tregs suppressiva funktion i en masskultur, där man kan dra slutsatsen att vissa (men inte alla, kanske inte ens de flesta) av de celler som betecknas som Tregs är suppressiva.
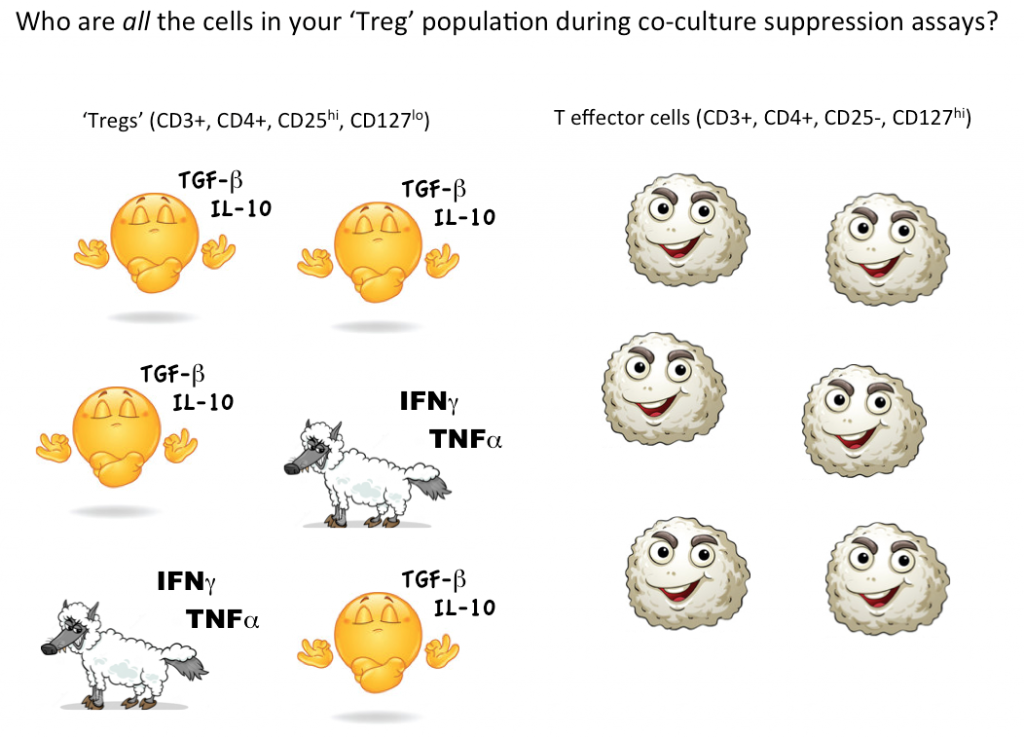
Och om vi återigen tänker på de potentiella vargarna i fårakläderna från ”effektor-T-celler”, så vet vi helt enkelt inte hur många icke-suppressiva, till och med inflammatoriska celler som gömmer sig i vår Treg-gatingstrategi. Att använda flödescytometri för att först sätta igång och sortera livskraftiga celler med markörer som överensstämmer med Tregs, och sedan funktionellt testa för att se om de celler som definierats genom din gatingstrategi faktiskt fungerar som Tregs som grupp, är för närvarande det bästa sättet att kvantifiera Tregs i ditt prov.
Om du tillämpar rätt gatingstrategier för att definiera Tregs genom flödescytometri och tar hänsyn till det ökande antalet undergrupper av Tregs, kan du ta fram de Treg-populationer som är intressanta för dig. Nyckeln är att testa dessa populationer funktionellt efter att ha identifierat dem eftersom det för närvarande är svårt, om inte omöjligt, att definiera en enskild cell som en Treg. Framsteg görs dock dagligen och så småningom kommer det att bli möjligt att märka enskilda Treg-celler korrekt.
Om du vill lära dig mer om att analysera T-celler och andra celltyper med hjälp av flödescytometri och om du vill få tillgång till allt vårt avancerade material, inklusive 20 utbildningsvideor, presentationer, arbetsböcker och ett privat gruppmedlemskap, kan du skriva upp dig på väntelistan för flödescytometriens mästerskapsklass.
 .
.