Generiskt namn: naftifine hydrochloride
Doseringsform: kräm
Medicinskt granskad av Drugs.com. Senast uppdaterad den 1 januari 2021.
- Översikt
- Biverkningar
- Dosering
- Professionell
- Graviditet
- Mer
Indikationer och användning för naftifin-kräm
Naftifinhydroklorid-kräm är indicerat för behandling av interdigital tinea pedis, tinea cruris och tinea corporis orsakade av organismen Trichophyton rubrum.
Naftifinkräm Dosering och administrering
Endast för lokal användning. Naftifinhydrokloridkräm är inte avsedd för oftalmisk, oral eller intravaginal användning. Applicera ett tunt lager naftifinhydrokloridkräm en gång dagligen på de drabbade områdena plus en ½ tum marginal av frisk omgivande hud i 2 veckor.
Doseringsformer och styrka
Varje gram innehåller 20 mg naftifinhydroklorid (2 %) i en vit till benvit bas.
Kontraindikationer
Ingen
Varningar och försiktighetsåtgärder
Lokala biverkningar
Avbryt behandlingen om irritation eller känslighet utvecklas vid användning av naftifinhydrokloridkräm. Uppmana patienterna att kontakta sin läkare om dessa tillstånd utvecklas efter användning av naftifinhydrokloridkräm.
Biverkningar
Erfarenheter från kliniska prövningar
Då kliniska prövningar utförs under mycket varierande förhållanden kan biverkningsfrekvenser som observerats i kliniska prövningar av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och kanske inte avspeglar frekvenser som observerats i klinisk praxis.
Under de kliniska prövningarna exponerades 903 försökspersoner för naftifin 1 % och 2 % krämformuleringar. Totalt 564 försökspersoner med interdigital tinea pedis, tinea cruris eller tinea corporis behandlades med naftifinhydrokloridkräm.
I två randomiserade, vehikelkontrollerade prövningar (400 försökspersoner behandlades med naftifinhydrokloridkräm). Populationen var 12 till 88 år gammal, huvudsakligen män (79 %), 48 % kaukasier, 36 % svarta eller afroamerikaner, 40 % spansktalande eller latinamerikaner och hade antingen huvudsakligen interdigital tinea pedis eller tinea cruris. De flesta försökspersoner fick doser en gång dagligen, lokalt, i 2 veckor för att täcka de drabbade hudområdena plus en ½ tum marginal av omgivande frisk hud. I de två vätskekontrollerade studierna upplevde 17,5 % av de naftifinhydrokloridkrämbehandlade försökspersonerna en biverkning jämfört med 19,3 % av försökspersonerna med vätskekontroll. Den vanligaste biverkningen (större än eller lika med 1 %) är pruritus. De flesta biverkningarna var lindriga i svårighetsgrad. Incidensen av biverkningar i den naftifinhydrokloridkrämbehandlade populationen var inte signifikant annorlunda än i den vehikelbehandlade populationen.
I en tredje randomiserad, vehikelkontrollerad studie behandlades 116 pediatriska försökspersoner med tinea corporis med naftifinhydrokloridkräm. Populationen var äldre än eller lika med 2 till mindre än 18 år (medelålder 9 år), huvudsakligen män (61 %), 47 % vita, 51 % svarta eller afroamerikaner, 92 % spansktalande eller latinamerikaner och infekterade med tinea corporis. Naftifinhydrokloridkräm applicerades lokalt en gång dagligen i två veckor på alla drabbade kroppsytor med tinea corporis plus en marginal på en halv tum av frisk hud som omger de drabbade lesionerna. Incidensen av biverkningar i den naftifinhydrokloridkrämbehandlade populationen var inte signifikant annorlunda än i den vehikelbehandlade populationen.
I två öppna pediatriska farmakokinetik- och säkerhetsstudier fick 49 pediatriska försökspersoner i åldrarna 2 till mindre än 18 år med interdigital tinea pedis, tinea cruris och tinea corporis naftifinhydrokloridkräm. Incidensen av biverkningar i den pediatriska populationen var liknande den som observerades i den vuxna populationen.
Erfarenheter efter marknadsintroduktion
Följande biverkningar har identifierats under användning av naftifinhydroklorid efter godkännandet: rodnad/irritation, inflammation, uppblåsning, maceration, svullnad, sveda, brännande känsla, blåsor, serös dränering, skorpbildning, huvudvärk, yrsel, leukopeni, agranulocytos.
Om dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband med läkemedelsexponering.
Användning hos särskilda populationer
Graviditet
Risksammanfattning
Det finns inga tillgängliga data med naftifinhydrokloridkräm hos gravida kvinnor för att informera om den läkemedelsassocierade risken för allvarliga fosterskador och missfall. I reproduktionsstudier på djur sågs inga negativa effekter på embryofetal utveckling vid orala doser administrerade under organogenesiperioden upp till 18 gånger den högsta rekommenderade humandosen (MRHD) hos dräktiga råttor eller subkutana doser administrerade under organogenesiperioden upp till 2 gånger MRHD hos dräktiga råttor eller 4 gånger MRHD hos dräktiga kaniner .
Den uppskattade bakgrundsrisken för större missbildningar och missfall för den angivna populationen är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förluster eller andra negativa resultat. I USA:s allmänna befolkning är den uppskattade bakgrundsrisken för större fosterskador och missfall i kliniskt erkända graviditeter 2 % till 4 % respektive 15 % till 20 %.
Data
Djurdata
Studier av systemisk embryofetal utveckling har utförts på råttor och kaniner. För jämförelse av doser från djur till människa baserat på jämförelse av kroppsytan (mg/m2) har MRHD fastställts till 8 g 2 % kräm per dag (2,67 mg/kg/dag för en individ på 60 kg).
Orala doser av 30, 100 och 300 mg/kg/dag naftifinhydroklorid administrerades under organogenesiperioden till dräktiga honråttor. Inga behandlingsrelaterade effekter på embryofetal utveckling noterades vid doser upp till 300 mg/kg/dag (18 gånger MRHD). Subkutana doser av 10 och 30 mg/kg/dag naftifinhydroklorid administrerades under organogenesen till dräktiga honråttor. Inga behandlingsrelaterade effekter på embryofetal utveckling noterades vid 30 mg/kg/dag (2 gånger MRHD). Subkutana doser av 3, 10 och 30 mg/kg/dag naftifinhydroklorid administrerades under organogenesen till dräktiga honkaniner. Inga behandlingsrelaterade effekter på embryofetal utveckling noterades vid 30 mg/kg/dag (4 gånger MRHD).
En studie av peri- och postnatal utveckling genomfördes på råttor. Orala doser av 30, 100 och 300 mg/kg/dag naftifinhydroklorid administrerades till honråttor från gestationsdag 14 till laktationsdag 21. Minskad viktökning hos honorna under dräktigheten och hos avkomman under laktationen noterades vid 300 mg/kg/dag (18 gånger MRHD). Ingen utvecklingstoxicitet noterades vid 100 mg/kg/dag (6 gånger MRHD).
Avvänjning
Risksammanfattning
Det finns ingen information tillgänglig om förekomsten av naftifinhydrokloridkräm i humanmjölk, läkemedlets effekter på det ammade spädbarnet eller läkemedlets effekter på mjölkproduktionen. Bristen på kliniska data under amning utesluter en tydlig bestämning av risken med naftifinhydrokloridkräm för ett spädbarn under amning; därför bör utvecklingen och hälsofördelarna med amning övervägas tillsammans med moderns kliniska behov av naftifinhydrokloridkräm och eventuella negativa effekter på det ammade spädbarnet från naftifinhydrokloridkräm eller från det underliggande tillståndet hos modern.
Pediatrisk användning
Säkerheten och effekten av naftifinhydrokloridkräm har fastställts hos pediatriska patienter i åldern 12 år och äldre med interdigital tinea pedis och tinea cruris och i åldern 2 år och äldre med tinea corporis .
Användning av naftifinhydrokloridkräm i dessa åldersgrupper stöds av bevis från adekvata och välkontrollerade studier på vuxna och barn, med ytterligare säkerhets- och PK-data från två öppna studier som utförts på 49 pediatriska försökspersoner som exponerats för naftifinhydrokloridkräm .
Säkerheten och effektiviteten av naftifinhydrokloridkräm vid behandling av tinea cruris och interdigital tinea pedis hos pediatriska patienter yngre än 12 år har inte fastställts. Säkerhet och effektivitet för naftifinhydrokloridkräm vid behandling av tinea corporis hos pediatriska patienter yngre än 2 år har inte fastställts.
Geriatrisk användning
Kliniska studier av naftifinhydrokloridkräm omfattade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de reagerar annorlunda än yngre försökspersoner.
Naftifinkräm Beskrivning
Naftifinhydrokloridkräm, USP är en vit till grumligt vit kräm för enbart topikal användning. Varje gram innehåller 20 mg naftifinhydroklorid, USP, (2 %), en syntetisk svampdödande allylaminförening.
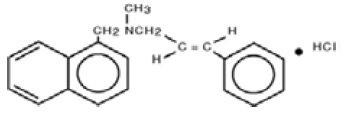
Kemiskt sett är naftifin HCl (E)-N-kinnamyl-N-metyl-1-naftalenmetylaminhydroklorid.
Molekylformeln är C21H21N-HCl med en molekylvikt på 323,86.
Strukturformeln för naftifinhydroklorid, USP är:
Naftifinhydrokloridkräm, USP innehåller följande inaktiva beståndsdelar: bensylalkohol, cetylalkohol, cetylestervax, isopropylmyristat, polysorbat 60, renat vatten, natriumhydroxid, sorbitanmonostearat och stearylalkohol. Saltsyra kan tillsättas för att justera pH.
Naftifinkräm – klinisk farmakologi
Aktionsmekanism
Naftifinhydrokloridkräm är ett lokalt svampdödande läkemedel .
Farmakodynamik
Farmakodynamiken för naftifinhydrokloridkräm har inte fastställts.
Farmakokinetik
Studier av biotillgänglighet in vitro och in vivo har visat att naftifin penetrerar stratum corneum i tillräcklig koncentration för att hämma tillväxten av dermatofyter.
Farmakokinetiken för naftifinhydrokloridkräm utvärderades efter en topisk applicering en gång dagligen i 2 veckor på 21 vuxna försökspersoner, både män och kvinnor, med både tinea pedis och tinea cruris. Medianvärdet för den totala mängden kräm som applicerades var 6,4 g (intervall 5,3 g till 7,5 g) per dag. Resultaten visade att den systemiska exponeringen (dvs. maximal koncentration (Cmax) och area under kurvan från tid 0 till 24 timmar (AUC0-24) för naftifin ökade under den två veckor långa behandlingsperioden hos alla 21 försökspersoner. Geometriskt medelvärde (variationskoefficient eller CV%) av AUC0-24 var 117 (41,2) ng*hr/mL på dag 1 och 204 (28,5) ng*hr/mL på dag 14. Geometriskt medelvärde (CV %) Cmax var 7 ng/mL (55,6) på dag 1 och 11 ng/mL (29,3) på dag 14. Mediantiden till Cmax (Tmax) var 8 timmar (intervall 4 till 24 timmar) på dag 1 och 6 timmar (intervall 0 till 16 timmar) på dag 14. Ackumulering efter 14 dagars topisk applicering var mindre än två gånger. Tröskelkoncentrationerna ökade i allmänhet under hela den 14 dagar långa studieperioden. Naftifin fortsatte att detekteras i plasma hos 13/21 (62 %) försökspersoner på dag 28. De genomsnittliga plasmakoncentrationerna (standardavvikelse eller SD) var 1,6 ± 0,5 ng/ml (intervall under kvantifieringsgränsen (BLQ) till 3 ng/ml). I samma farmakokinetiska studie som utfördes på patienter med tinea pedis och tinea cruris var den medianfraktion av dosen som utsöndrades i urin under behandlingsperioden 0,0016 % på dag 1 jämfört med 0,0020 % på dag 14.
I en andra studie som omfattade 22 försökspersoner utvärderades farmakokinetiken för naftifinhydrokloridkräm hos 20 pediatriska försökspersoner i åldrarna 13 till mindre än 18 år med både tinea pedis och tinea cruris. Försökspersonerna behandlades med en medeldos på 8,1 g (intervall 6,6 g till 10,1 g) som applicerades på de drabbade områdena en gång dagligen i 2 veckor. Resultaten visade att den systemiska exponeringen ökade under behandlingsperioden. Geometriskt medelvärde (CV%) AUC0-24 var 138 (50,2) ng*hr/mL på dag 1 och 192 (74,9) ng*hr/mL på dag 14. Geometriskt medelvärde (CV %) Cmax var 9,21 ng/mL (48,4) på dag 1 och 12,7 ng/mL (67,2) på dag 14. Medianfraktionen av dosen som utsöndrades i urin under behandlingsperioden var 0,0030 % på dag 1 och 0,0033 % på dag 14.
En tredje studie utvärderade farmakokinetiken för naftifinhydrokloridkräm hos 27 pediatriska försökspersoner i åldrarna 2 till mindre än 12 år med minst måttlig tinea corporis. Försökspersonerna delades in i yngre (2 till mindre än 6 år, 17 försökspersoner) och äldre (6 till mindre än 12 år, 10 försökspersoner) grupper. Medeldoserna 1,3 g (intervall 1 g till 3,1 g) och 2,3 g (intervall 2,2 g till 4,2 g) applicerades en gång dagligen i två veckor i de yngre respektive äldre grupperna på det angripna området plus en marginal på en halv tum. Farmakokinetiska bedömningar av plasma och urin utfördes på dag 1 endast i den äldre gruppen och på dag 14 i båda grupperna. Alla försökspersoner uppvisade mätbara nivåer av naftifin i plasma efter topisk applicering av naftifinhydrokloridkräm. Efter en engångsdos dag 1 hos försökspersoner som var 6 till mindre än 12 år gamla var de geometriska medelvärdena (CV%) för Cmax och AUC0-24 3,60 (76,6) ng/ml respektive 49,8 (64,4) ng*h/ml. På dag 14 i denna grupp var Cmax och AUC0-24 3,31 (51,2) ng/mL respektive 52,4 (49,2) ng*h/mL. Hos försökspersoner i åldern 2 till mindre än 6 år var Cmax och AUC0-24 på dag 14 3,98 (186) ng/mL respektive 54,8 (150) ng*h/mL. I den äldre gruppen av försökspersoner i åldern 6 till 12 år var de systemiska exponeringarna (både Cmax och AUC0-24) på dag 1 och 14 jämförbara. Den medianfraktion av dosen som utsöndrades i urinen under 24 timmar efter läkemedelstillämpningar på dag 1 och dag 14 var 0,0029 % respektive 0,0014 %.
Mikrobiologi
Och även om den exakta verkningsmekanismen mot svampar inte är känd, tycks naftifinhydroklorid störa sterolbiosyntesen genom att hämma enzymet squalen2, 3-epoxidas.Denna hämning av enzymaktiviteten resulterar i minskade mängder steroler, särskilt ergosterol, och en motsvarande ackumulering av squalen i cellerna.
Mekanism för resistens
Till dags dato har en mekanism för resistens mot naftifin inte identifierats.
Naftifin har visat sig vara aktivt mot de flesta isolat av följande svampar, både in vitro och vid kliniska infektioner, enligt beskrivningen i avsnitt INDIKATIONER OCH ANVÄNDNING:
Trichophyton rubrum
Nonklinisk toxikologi
Karcinogenes, mutagenes, försämrad fertilitet
I en 2-årig dermal karcinogenicitetsstudie administrerades naftifinhydrokloridkräm till Sprague-Dawley-råttor i topiska doser på 1 %, 2 % och 3 % (10, 20 och 30 mg/kg/dag naftifinhydroklorid). Inga läkemedelsrelaterade tumörer noterades i denna studie upp till den högsta dosen som utvärderades i denna studie på 30 mg/kg/dag (12 gånger MRHD baserat på AUC-jämförelse).
Naftifinhydroklorid uppvisade inga tecken på mutagen eller klastogen potential baserat på resultaten av två in vitro gentoxicitetstester (Ames-assay och kromosomavvikelseassay för kromosomavvikelser i kinesiska hamsteräggstocksceller) och ett in vivo gentoxicitetstest (mikrokärneassay för benmärg från mus).
Oral administrering av naftifinhydroklorid till råttor, under hela parningen, dräktigheten, födseln och laktationen, visade inga effekter på tillväxt, fertilitet eller reproduktion, vid doser upp till 100 mg/kg/dag (6 gånger MRHD).
Kliniska studier
Tinea cruris
Naftifinhydrokloridkräm har undersökts med avseende på säkerhet och effekt i en randomiserad, dubbelblind, vehikelkontrollerad, multicenterstudie på 146 försökspersoner med symtomatisk och dermatofytkulturpositiv tinea cruris. Försökspersonerna randomiserades till att få naftifinhydrokloridkräm eller vehikel. Försökspersonerna applicerade naftifinhydrokloridkräm eller vehikel på det angripna området plus en ½-tums marginal av frisk hud som omger det angripna området en gång dagligen i 2 veckor. Tecken och symtom på tinea cruris (närvaro eller frånvaro av erytem, pruritus och fjällning) bedömdes, och KOH-undersökning och dermatofyteodling utfördes vid den primära effektmätpunkten vecka 4.
Medelåldern för försökspopulationen var 47 år och 87 % var män och 43 % var vita. Vid baslinjen bekräftades att försökspersonerna hade tecken och symtom på tinea cruris, positiv KOH-undersökning och bekräftad närvaro av dermatofyter baserat på odlingsresultat från ett centralt mykologiskt laboratorium. Analysen av intention-till-behandling-populationen var en jämförelse av andelen försökspersoner med fullständig bot vid besöket vecka 4 (se tabell 1). Fullständig bot definieras som både klinisk bot (avsaknad av erytem, pruritus och fjällning) och mykologisk bot (negativ KOH- och dermatofytodling).
Procentandelen försökspersoner med klinisk bot och procentandelen försökspersoner med mykologisk bot vid vecka 4 presenteras individuellt i tabell 1 nedan.
|
Endpoint |
Naftifine Hydrochloride Cream, 2% |
Förpackning |
|
N=75 |
N=71 |
|
|
Komplett kurea |
19 (25%) |
2 (3%) |
|
Effektiv behandlingb |
45 (60%) |
7 (10%) |
|
Mykologisk bot |
54 (72%) |
11 (16%) |
|
a. Fullständig bot är en sammansatt slutpunkt för både mykologisk bot och klinisk bot. Klinisk bot definieras som frånvaro av erytem, pruritus och fjällning (grad 0). |
||
|
b. Effektiv behandling är ett negativt KOH-preparat och negativ dermatofytkultur, erytem, fjällning och pruritus av graderna 0 eller 1 (frånvarande eller nästan frånvarande). |
||
|
c. Mykologisk bot definieras som negativ KOH- och dermatofytkultur. |
||
Interdigital Tinea Pedis
Naftifinhydrokloridkräm har undersökts för effektivitet i en randomiserad, dubbelblind, vehikelkontrollerad, multicenterstudie på 217 försökspersoner med symtomgivande och dermatofytkulturpositiv interdigital tinea pedis. Försökspersonerna randomiserades till att få naftifinhydrokloridkräm eller vehikel. Försökspersonerna applicerade naftifinhydrokloridkräm eller vehikel på det angripna området på foten plus en ½-tums marginal av frisk hud som omger det angripna området en gång dagligen i 2 veckor. Tecken och symtom på interdigital tinea pedis (närvaro eller frånvaro av erytem, pruritus och fjällning) bedömdes och KOH-undersökning och dermatofytodling utfördes vid den primära effektmätpunkten vecka 6.
Medelåldern för försökspopulationen var 42 år och 71 % var män och 57 % var vita. Vid baslinjen bekräftades att försökspersonerna hade tecken och symtom på interdigital tinea pedis, positiv KOH-undersökning och bekräftad dermatofytkultur. Det primära effektmåttet var andelen försökspersoner med fullständig bot vid besöket vecka 6 (se tabell 2). Fullständig bot definieras som både klinisk bot (avsaknad av erytem, pruritus och fjällning) och mykologisk bot (negativ KOH- och dermatofytodling).
Villkorsresultaten vid vecka 6, fyra veckor efter avslutad behandling, presenteras i tabell 2 nedan. Naftifinhydrokloridkräm visade fullständig bot hos försökspersoner med interdigital tinea pedis, men fullständig bot hos försökspersoner med enbart tinea pedis av moccasintyp kunde inte påvisas.
|
Endpoint |
Naftifine hydrochloride Cream, 2% |
Förpackning |
|
N=147 |
N=70 |
|
|
Komplett kurea |
26 (18%) |
5 (7%) |
|
Effektiv behandlingb |
83 (57%) |
14 (20%) |
|
Mycological Curec |
99 (67%) |
15 (21%) |
|
a. Fullständigt botande är ett sammansatt slutresultat av både mykologiskt botande och kliniskt botande. |
||
|
b. Effektiv behandling är ett negativt KOH-preparat och negativ dermatofytkultur, erytem, fjällning och pruritus med graderna 0 eller 1 (frånvarande eller nästan frånvarande). |
||
|
c. Mykologisk bot definieras som negativ KOH- och dermatofytkultur. |
||
Tinea corporis
Naftifinhydrokloridkräm har undersökts med avseende på säkerhet och effekt i en randomiserad, dubbelblind, vehikelkontrollerad multicenterstudie på 184 försökspersoner med symtomatisk och dermatofytkulturpositiv tinea corporis. Försökspersonerna randomiserades till att få naftifinhydrokloridkräm eller vehikel. Försökspersonerna applicerade studiemedlet på alla angripna kroppsytor med tinea corporis plus en ½ tum marginal av frisk hud som omger de angripna lesionerna i två veckor. Tecken och symtom på tinea corporis (närvaro eller frånvaro av erytem, induration och pruritus) bedömdes och KOH-undersökning och dermatofytodling utfördes för bedömning av den primära effektmåttpunkten vid dag 21.
Studiepopulationen var pediatrisk (större än eller lika med 2 till mindre än 18 år) med en medianålder på 9 år (naftifinhydrokloridkräm) eller 8 år (vehikel); 61 % av försökspersonerna var män och 45 % var vita. Vid baslinjen bekräftades att försökspersonerna hade tecken och symtom på tinea corporis, positiv KOH-undersökning och bekräftad dermatofytkultur. Det primära effektmåttet var andelen försökspersoner med fullständig bot vid besöket dag 21. Fullständig bot definieras som både klinisk bot (avsaknad av erytem, induration och pruritus på alla lesioner som fanns vid baslinjen) och mykologisk bot (negativ KOH- och dermatofytodling).
Villkorsresultaten vid dag 21, en vecka efter avslutad behandling, presenteras i tabell 3 nedan.
|
Naftifine Hydrochloride Cream, 2% |
Förpackning |
|
|
Endpunkt |
N=91 |
N=93 |
|
Complete Curea |
42 (46%) |
26 (28%) |
|
Effektiv behandlingb |
53 (58%) |
32 (34%) |
|
Mykologisk kur |
57 (63%) |
36 (39%) |
|
a. Fullständig bot är ett sammansatt effektmått av både mykologisk bot och klinisk bot. |
||
|
b. Effektiv behandling är ett negativt KOH-preparat och negativ dermatofytkultur, erytem, induration och pruritus av graderna 0 eller 1 (frånvarande eller mild). |
||
|
c. Mykologisk bot definieras som negativ KOH- och dermatofytkultur. |
||
Hur levereras/förvaring och hantering
Naftifinhydrokloridkräm, USP 2 %, är en vit till benvit kräm som levereras i följande storlek:
45 grams tuber – NDC 70700-161-18
60 grams tuber – NDC 70700-161-17
Lagra naftifinhydrokloridkräm vid 25°C (77°F); avvikelser tillåts till 15° till 30°C (59° till 86°F).
Patientrådgivning
- Informera patienterna om att naftifinhydrokloridkräm endast är avsedd för lokal användning. Naftifinhydrokloridkräm är inte avsedd för oral, intravaginal eller oftalmisk användning.
- Om irritation eller känslighet utvecklas vid användning av naftifinhydrokloridkräm ska behandlingen avbrytas och lämplig behandling sättas in. Patienter ska uppmanas att kontakta sin läkare om dessa tillstånd utvecklas efter användning av naftifinhydrokloridkräm.
Distribueras av:
Xiromed, LLC,
Florham Park, NJ 07932
Rev. 09/2020
PI-161-00
Förpackningsetikett PRINCIPAL DISPLAY PANEL SECTION – 45g Tube

NDC 70700-161-18
Naftifinkräm, 2 %
Xiromed, LLC
För topisk användning endast
Inte för oftalmisk användning, Oral eller intravaginal användning
45 g
Rx Only
Förpackningens etikett PRINCIPAL DISPLAY PANEL SECTION – 60g Tube

NDC 70700-161-17
Naftifine Cream, 2%
Xiromed, LLC
Endast för topisk användning
Inte för oftalmisk användning, Oral eller intravaginal användning
60 g
Rx Only
| NAFTIFINE HYDROCHLORIDE naftifinhydrokloridkräm |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Etiketterare – Xiromed, LLC (080228637)
Registrant – Xiromed Pharma España, S.L. (468835741)
Mer om naftifine topical
- Biverkningar
- Under graviditet eller amning
- Doseringsinformation
- Prissättning &Kuponger
- En Español
- 7 Recensioner
- Läkemedelsklass: Aktuella svampmedel
Konsumentresurser
- Patientinformation
- Naftifine Topical (Avancerad läsning)
Professionella resurser
- Förskrivarinformation
- Naftifine (Professionell patientrådgivning)
- Naftifine Gel (FDA)
Andra varumärken Naftin
Relaterade behandlingsguider
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Medicinsk ansvarsfriskrivning