Subatomära partiklar
Alla grundämnen består av extremt små materiepartiklar som kallas atomer. Vi kan definiera en atom som den enklaste partikel av ett grundämne som har grundämnets kemiska egenskaper. Kemiska egenskaper omfattar grundämnets fysiska tillstånd (gas, vätska eller fast ämne), vilka typer av bindningar grundämnet kan bilda, hur det reagerar med andra grundämnen osv. Därför har alla atomer som utgör grundämnet kol samma kemiska egenskaper.
Fysiker har lyckats spränga isär atomer till dussintals olika subatomära partiklar, men endast tre av dem är stabila. Dessa är protoner, neutroner och elektroner. Protoner är positivt laddade partiklar, har massa och befinner sig i atomens centrum, eller atomkärna. Neutroner har ingen laddning, har massa och befinner sig också i atomens kärna. Neutroner binder sig till protoner på ett sätt som bidrar till att stabilisera atomkärnan. För många eller för få neutroner kan resultera i en atomkärna som är instabil och kan sönderfalla och bilda andra grundämnen. Vi kallar dessa atomer för radioaktiva. Även om neutronens massa är något större än protonens kan vi tilldela dem båda den relativa massan 1 (1 atommassenhet eller amu). Neutroner och protoner utgör nästan hela atomens massa. Den tredje typen av stabila partiklar är elektronen. Elektroner har en negativ laddning men är extremt små och har en massa på endast 1/1850 av en proton eller neutron. De är så små att de av praktiska skäl inte bidrar till atomens massa. Elektroner rör sig runt kärnan med enormt höga hastigheter och färdas faktiskt nästan med ljusets hastighet. Även om vi ofta beskriver elektronerna som att de befinner sig i banor som kretsar runt kärnan, likt planeter som kretsar runt solen, lär oss den moderna fysiken att denna modell är felaktig. Dessa ”banor” är i själva verket områden i rymden runt kärnan där elektronerna kommer att befinna sig mest hela tiden. Detta område kallas ofta för elektronernas ”moln”. Det är visserligen fortfarande ett specifikt område, men det är lite mer amorft än en sfärisk omloppsbana. För enkelhetens skull tänker vi dock ofta på dessa som satellitliknande cirkulära banor. Bilden nedan representerar vår nuvarande modell av en kväveatom.
Kvävekärnan innehåller 7 protoner (orange) och 7 neutroner (grön). De skuggade områdena runt kärnan representerar elektronorbitalerna (moln). Elektroner (blå) kommer att finnas någonstans inom dessa orbitaler. (Observera: bilden är inte ritad i skala. Det har föreslagits att om kärnan var lika stor som en basketboll skulle elektronerna vara ungefär sex kilometer eller 3¾ mil bort!)
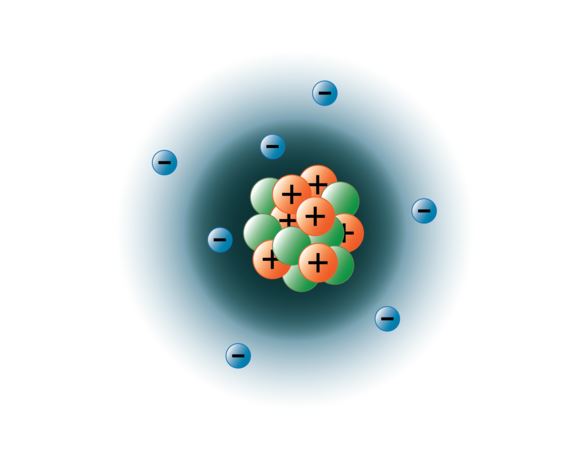
Bild skapad av BYU-I-studenten Hannah Crowder Fall 2013
Atomnummer
Ta en titt på det periodiska systemet igen och lägg märke till numret högst upp i varje ruta. Detta nummer är atomnumret för grundämnet och är unikt för alla olika grundämnen. Till exempel är atomnumret för väte 1. Inget annat grundämne har ett atomnummer på 1. För kol är atomnumret 6 och återigen har inget annat grundämne ett atomnummer på 6. Betydelsen av atomnumret är att det talar om hur många protoner som finns i kärnan hos varje grundämne. Därför har alla väteatomer 1 proton och alla kolatomer 6 protoner. Eftersom atomer har en neutral laddning säger atomnumret dessutom hur många elektroner som finns i atomen. I kemisk notation uttrycks atomnumret för ett grundämne som ett subscript som föregår symbolen för grundämnet. Kol skulle till exempel uttryckas som 6C.
Massanummer (atommassa)
Massanumret för en atom anger, som namnet antyder, atomens totala massa. Eftersom elektronens massa är extremt liten (försumbar) används den inte vid beräkningen av masstalet. Kom också ihåg att massan för varje proton såväl som för varje neutron är 1 atommassenhet. Därför är masstalet summan av protonerna och neutronerna i atomen. Eftersom masstalet är antalet protoner plus antalet neutroner och atomnumret är antalet protoner, kan du hitta antalet neutroner genom att helt enkelt subtrahera atomnumret från masstalet. Som exempel kan vi anta att vi har ett grundämne med ett atomnummer på 8 och ett masstal på 17. Från denna information kan du dra slutsatsen att grundämnet har 8 protoner, 8 elektroner och 9 neutroner (17-8=9). Låt mig nu kasta dig en kurvig boll. Som nämnts ovan har alla atomer av ett visst grundämne samma antal protoner (atomnummer), men olika atomer av ett visst grundämne kan ha olika antal neutroner. Vi säger att detta är olika isotoper av grundämnet. Det finns till exempel tre isotoper av väte. Den vanligaste isotopen som utgör 99,98 % av alla väteatomer har masstalet 1. Den består alltså av 1 proton, inga neutroner och en elektron. De andra mindre vanliga isotoperna av väte har masstal 2 respektive 3. Dessa isotoper skiljer sig åt i antalet neutroner i sina kärnor, men alla tre har en proton och en elektron. I verkligheten finns det naturligt förekommande isotoper av varje grundämne, som var och en har sitt eget unika masstal. I kemisk notation uttrycks masstalet för en viss isotop som en överskrift som föregår symbolen för grundämnet. De tre isotoperna för väte skulle uttryckas som 1H, 2H och 3H. Eftersom varje grundämne består av flera isotoper är en fråga som uppstår: ”Vad är den faktiska massan för ett visst grundämne?”. Om du återigen tittar på det periodiska systemet ovan kommer du att märka ett nummer i botten av varje ruta. Detta är atomvikten för grundämnet. Till exempel är atomvikten för väte 1,00794 amu. Denna siffra har tagits fram genom att beräkna den genomsnittliga massan för de tre isotoperna av väte. Anta till exempel att vi hade 10 pojkar i vår klass. Om vi vill veta pojkarnas genomsnittliga vikt skulle vi lägga ihop deras individuella vikter och sedan dividera summan med 10. Detta skulle ge oss deras genomsnittliga vikt. Detta är i huvudsak hur atomvikter bestäms. Eftersom 1H är den vanligaste isotopen av väte är det logiskt att atomvikten för väte ligger mycket nära atommassan för 1H.
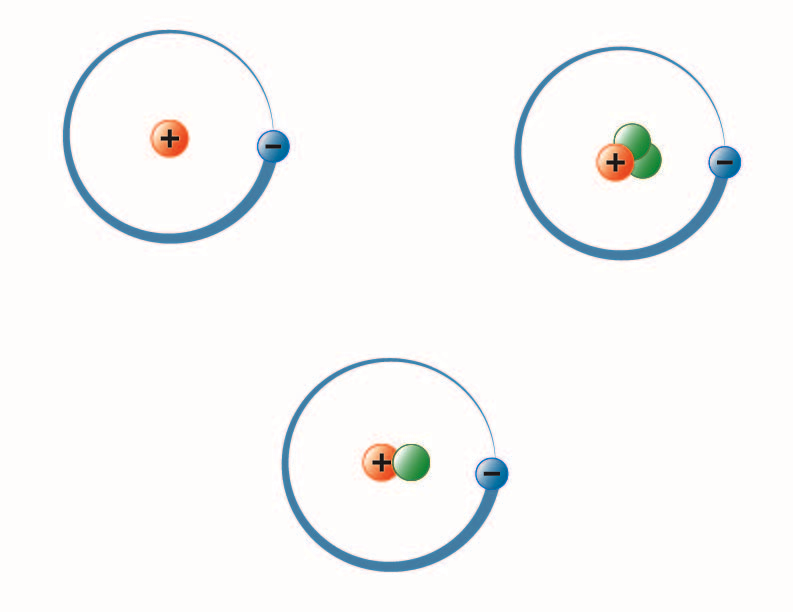
Bild skapad av BYU-I-studenten Hannah Crowder Fall 2013
Bilden ovan representerar de tre isotoperna av väte. Den vanligaste (uppe till vänster) har en proton och inga neutroner i kärnan. Deuterium (nederst) har en proton och en neutron och tritium (överst till höger) har en proton och två neutroner.
**Du kan använda knapparna nedan för att gå till nästa eller föregående läsning i den här modulen**

