Figur 1. Toll-like-receptorns signalväg
Vad är Toll-like-receptorn?
Toll-liknande receptorer (TLR) är en klass av proteiner som spelar en nyckelroll i den medfödda immuniteten. De är transmembranreceptorer med en enda domän och tillhör mönsterigenkänningsreceptorer (PRRs) som vanligen uttrycks i sentinelceller såsom makrofager dendritiska celler och många andra icke-immuna celler såsom fibroblaster och epitelceller. De känner igen strukturellt bevarade molekyler som härrör från mikrober och som kallas patogenassocierade molekylmönster (PAMPs) eller egenutvecklade molekyler som härrör från skadade celler och som kallas skadeassocierade molekylmönster (DAMPs). Till PAMP hör olika bakteriella cellväggskomponenter som lipopolysackarid (LPS), peptidoglykan (PGN) och lipopeptider samt flagellin, bakteriellt DNA och viralt dubbelsträngat RNA. DAMPs omfattar intracellulära proteiner som värmeschockproteiner samt proteinfragment från den extracellulära matrisen. PRRs aktiverar nedströms signalvägar som leder till induktion av medfödda immunsvar genom produktion av inflammatoriska cytokiner, typ I-interferon (IFN) och andra mediatorer. Dessa processer utlöser inte bara omedelbara försvarssvar från värdens sida, t.ex. inflammation, utan de ger också upphov till och styr antigenspecifika adaptiva immunsvar. Dessa reaktioner är viktiga för att rensa bort infekterande mikrober och avgörande för den efterföljande instruktionen av antigenspecifika adaptiva immunsvar.
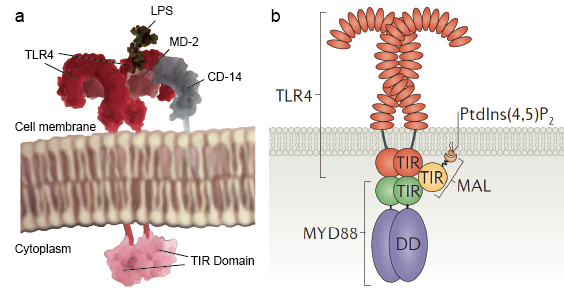
Figur 2. TLR:s molekylära struktur.
Toll-liknande receptorfamilj
TLR-familjen består av 10 medlemmar (TLR1-TLR10) hos människa och 12 (TLR1-TLR9, TLR11-TLR13) hos mus. TLRs lokaliseras till cellytan eller till intracellulära kompartment som ER, endosom och lysosom. Till cellytans TLR hör TLR1, TLR2, TLR4, TLR5, TLR6 och TLR10, medan intracellulära TLR lokaliseras i endosomen och omfattar TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 och TLR13 (figur 1). TLR:er på cellytan känner främst igen mikrobiella membrankomponenter som lipider, lipoproteiner och proteiner. Intracellulära TLR:er känner igen nukleinsyror som härrör från bakterier och virus, och känner även igen egna nukleinsyror vid sjukdomstillstånd som autoimmunitet.
Funktionen hos Toll-liknande receptorer bygger vanligtvis på en dimeriseringsprocess av två TLR-molekyler, men inte alltid. Till exempel kommer TLR-1 och TLR-2 att binda till varandra för att bilda en dimmer när de känner igen PAMP-molekyler som huvudsakligen omfattar lipoproteiner, peptidoglykaner, lipoteksyror (LTA, Gram-), zymosan, mannan och tGPI-mucin. TLR-2 kan också bilda en dimridå med TLR-6 när de känner igen samma PAMPs som anges ovan. TLR-4 kan känna igen lipopolysackarid (LPS, Gram+) och bilda en homodimer med en annan TLR-4-molekyl. TLR-5 kan känna igen bakteriellt flagellin, men de bildar ingen dimmer. TLR-11 är funktionell hos möss och känner främst igen uropatogena bakterier. TLR-3, 7, 8, 9, 13 uttrycks på endosomytan i cytoplasman. TLR3 känner igen viralt dubbelsträngat RNA (dsRNA), små interfererande RNA och själv-RNA som härrör från skadade celler. TLR-7 uttrycks främst i plasmacytoida DCs (pDCs) och känner igen enkelsträngat (ss) RNA från virus. Den känner också igen RNA från streptokock B-bakterier i konventionella DCs (cDCs). TLR8 reagerar på viralt och bakteriellt RNA. TLR-9 känner igen bakteriellt och viralt DNA som är rikt på ometylerade CpG-DNA-motiv. TLR13 känner igen bakteriellt 23S rRNA och okända komponenter av vesikulärt stomatitvirus.
Trots att det finns så många typer av TLR-molekyler som känner igen ett brett spektrum av ligander har alla dessa TLR ett gemensamt strukturellt ramverk i sina extracellulära, ligandbindande domäner. Dessa domäner antar alla hästskoformade strukturer som är uppbyggda av leucinrika upprepningsmotiv. Vid ligandbindning bildar två extracellulära domäner typiskt sett en m-formad dimer som tar ligandmolekylen i en sandwich, vilket gör att transmembran- och cytoplasmadomänerna kommer nära varandra och utlöser en nedströms signaleringskaskad (figur 2).
Toll-liknande receptorers signaleringssignalväg
1. Toll-liknande receptorers signalkaskad
Toll-liknande receptorer gör det möjligt för sentinelceller som makrofager att upptäcka mikrober genom PAMPs som LPS. LPS är en komponent i bakteriernas cellvägg. Mekanismen för lipopolysackaridigenkänning av Toll-like-receptorer är komplex och kräver flera tilläggsproteiner. Ett serumprotein, LPS-binding protein, binder LPS-monomerer och överför dem till ett protein som kallas CD14. CD14 kan vara löslig eller bindas till cellytan genom ett glykosylfosfatidylinositolankare. CD 14 levererar och laddar LPS till den extracellulära domänen av Toll-like-receptorer. TLR:erna kan upptäcka LPS med hjälp av ett tilläggsprotein som kallas MD-2. Därefter induceras homodimerisering av TLR:er när LPS binder till komplexet TLR-CD14-MD2. Konformationsförändringen av de extracellulära domänerna initierar dimerisering av den cytoplasmatiska Toll IL-1-receptordomänen (TIR). TIR-konformitetsförändringen ger en ny ram som gör det möjligt att rekrytera adaptorproteiner för att bilda ett signalkomplex efter receptorn. TIR innehåller ett adaptorprotein, myeloid differentiation primary-response protein 88 (MyD88).
MyD88 fungerar som en adaptor som kopplar ihop TLR/IL-1R med nedströms signalmolekyler som har DDs. Den känner igen konformationsförändringen i TLR:s TIR-domän, binder till det nya receptorkomplexet och överför signaleringen genom amino (N)-terminal dödsdomän (DD) interaktion med IL-1R-associerade kinaser (IRAKs). Detta resulterar i en komplex kaskad med signalering som varnar cellen för patogeninvasion. Det finns fyra IRAKs (IRAK 1, 2, 4, M). De innehåller en N-terminal DD och en central serin/treoninkinasdomän. IRAK1 och IRAK4 har inneboende kinasaktivitet, medan IRAK2 och IRAK-M inte har någon påvisbar kinasaktivitet. IRAK4 aktiveras av MyD88 och fortsätter att aktivera IRAK1. IRAK1 aktiverar sedan nedströms TRAF6. TRAF6 är en medlem av den tumörnekrosfaktorreceptor (TNFR)-associerade faktorfamiljen (TRAF) som medierar cytokinsignalvägar. Vid stimulering rekryteras TRAF6 till receptorkomplexet och aktiveras av IRAK-1 som binder till TRAF-domänen av TRAF6. Därefter dissocieras IRAK-1/TRAF6-komplexet från receptorn och associeras med TGF-beta-aktiverat kinas 1 (TAK1) och TAK1-bindande proteiner, TAB1 och TAB2. Komplexet av TRAF6, TAK1, TAB1 och TAB2 rör sig till cytoplasman, där det bildar ett stort komplex med andra proteiner, till exempel E2-ligaserna Ubc13 och Uev1A. Ubc13- och Uev1A-komplexet har visat sig katalysera syntesen av en Lys 63-länkad polyubiquitinkedja av TRAF6 och därigenom inducera TRAF6-medierad aktivering av TAK1 och slutligen av NF-kB. Dessa signalvägar som beskrivs ovan kallas MyD88-beroende vägar eftersom signalen utgår från MyD88-molekylen. Det finns också en annan väg som kallas MyD88-oberoende väg, där signaleringen inte utgår från MyD88. I stället börjar signalen från TRIF-proteinet. TRIF interagerar med TRAF6 och TRAF3. TRAF6 rekryterar kinaset RIP-1, som i sin tur interagerar med och aktiverar TAK1-komplexet, vilket leder till aktivering av NF-kB och MAPK och induktion av inflammatoriska cytokiner. TRAF3 rekryterar däremot de IKK-relaterade kinasernaTBK1 och IKKi tillsammans med NEMO för IRF3-fosforylering och aktivering. IRF3 bildar en dimer och translokeras till kärnan från cytoplasman, inducerar uttrycket av typ I IFN.
2. Signalering nedströms
TLRs signalerar faktiskt främst genom rekrytering av specifika adaptormolekyler, vilket leder till aktivering av transkriptionsfaktorerna NF-kB och IRFs, som dikterar utfallet av de medfödda immunsvaren. Denna signalväg nedströms signalerar alltså att IRFs transkriptionsfaktor, NF-kB-signalvägen och MAKP-signalvägen aktiveras. Du kan hitta mer detaljerad information om NF-kB- och MAKP-signalvägen från:
NF-kB-signalvägen, P38-signalvägen och MAKP-signalvägen.
3. Reglering av signalvägen
Förvisso finns det en viss negativ reglering av ett antal molekyler genom olika mekanismer för att förhindra eller avsluta överdrivna immunresponser som leder till skadliga konsekvenser som förknippas med autoimmunitet och inflammatoriska sjukdomar. Aktiveringen av den MyD88-beroende vägen undertrycks av ST2825, SOCS1 och Cbl-b, och aktiveringen av den TRIF-beroende vägen undertrycks av SARM och TAG. Dessa molekyler associerar sig med MyD88 eller TRIF för att hindra dem från att binda till TLRs eller nedströmsmolekyler. TRAF3-aktiveringen regleras negativt av SOCS3 och DUBA. TRAF6 är måltavla för ett antal hämmande molekyler såsom A20, USP4, CYLD, TANK, TRIM38 och SHP. TAK1-aktivering hämmas av TRIM30a och A20.
4. Samband med sjukdomar
Då TLR är involverad i LPS-sensoreringen och skulle kunna spela en roll vid sepsis, är målinriktning av TLR viktigt för behandling av flera sjukdomar. Förutom att ingripa i TLR-svar för att behandla patogeninfektioner var en uppenbar klinisk tillämpning av den kunskap som vunnits genom TLR-studier att använda TLR-ligander som adjuvans för vacciner. Dessutom har man också försökt med TLR-hämning i kliniken, vars mål är att begränsa överdriven inflammation som förmodligen drivs av överaktivering av en viss TLR.
| Takeda, Kiyoshi och Shizuo Akira. ”TLR-signalvägar”. Seminarier i immunologi. Vol. 16. No. 1. Academic Press, 2004. | |
| Akira, Shizuo och Kiyoshi Takeda. ”Toll-like receptor signalering”. Nature reviews immunology 4.7 (2004): 499-511. | |
| Lim, Kian-Huat och Louis M. Staudt. ”Toll-like receptor signalering”. Cold Spring Harbor perspectives in biology 5.1 (2013): a011247. | |
| ochTaro Kawai, Takumi Kawasaki. ”Toll-liknande receptorers signalvägar”. Pattern Recognition Receptors and Cancer 8916 (2015): 7. | |
| Gay, Nicholas J., et al. ”Assembly and localization of Toll-like receptor signaleringskomplex”. Nature reviews Immunology 14.8 (2014): 546-558. | |
| O’Neill, Luke AJ, Douglas Golenbock och Andrew G. Bowie. ”Historien om Toll-liknande receptorer som omdefinierar den medfödda immuniteten”. Nature Reviews Immunology 13.6 (2013): 453-460. | |
| Botos, Istvan, David M. Segal och David R. Davies. ”Den strukturella biologin för Toll-like-receptorer”. Structure 19.4 (2011): 447-459. |