Figura 1. Szlak sygnałowy receptora Toll-podobnego
Co to jest receptor Toll-podobny?
Receptory Toll-podobne (TLR) to klasa białek, które odgrywają kluczową rolę w odporności wrodzonej. Są to jednodomenowe receptory transbłonowe należące do receptorów rozpoznawania wzorców (pattern recognition receptors – PRR), które zwykle ulegają ekspresji w komórkach czuciowych, takich jak makrofagi, komórki dendrytyczne i wiele innych komórek nieimmunologicznych, takich jak fibroblasty i komórki nabłonkowe. Rozpoznają one strukturalnie konserwowane cząsteczki pochodzące od drobnoustrojów, nazywane wzorcami molekularnymi związanymi z patogenami (pathogen-associated molecular patterns – PAMP), lub cząsteczki pochodzące z uszkodzonych komórek, nazywane wzorcami molekularnymi związanymi z uszkodzeniami (damage associated molecules patterns – DAMP). PAMPs obejmują różne składniki ściany komórkowej bakterii, takie jak lipopolisacharyd (LPS), peptydoglikan (PGN) i lipopeptydy, a także flagelinę, bakteryjne DNA i wirusowe dwuniciowe RNA. DAMP obejmują białka wewnątrzkomórkowe, takie jak białka szoku cieplnego, jak również fragmenty białek macierzy pozakomórkowej. PRR aktywują szlaki sygnałowe, które prowadzą do indukcji wrodzonej odpowiedzi immunologicznej poprzez produkcję cytokin zapalnych, interferonu typu I (IFN) i innych mediatorów. Procesy te nie tylko wyzwalają natychmiastowe odpowiedzi obronne gospodarza, takie jak zapalenie, ale także pobudzają i ukierunkowują antygenowo-swoiste adaptacyjne odpowiedzi immunologiczne. Te odpowiedzi są niezbędne do usuwania infekujących mikrobów, jak również kluczowe dla konsekwentnego instruowania antygenowo-swoistych adaptacyjnych odpowiedzi immunologicznych.
Rysunek 2. Schemat budowy molekularnej TLRs.
Rodzina receptorów tollopodobnych
Rodzina TLR obejmuje 10 członków (TLR1-TLR10) u człowieka i 12 (TLR1-TLR9, TLR11-TLR13) u myszy. TLR lokalizują się na powierzchni komórki lub w przedziałach wewnątrzkomórkowych, takich jak ER, endosom i lizosom. TLR na powierzchni komórki obejmują TLR1, TLR2, TLR4, TLR5, TLR6 i TLR10, podczas gdy wewnątrzkomórkowe TLR zlokalizowane są w endosomie i obejmują TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 i TLR13 (Rysunek 1). TLR na powierzchni komórki rozpoznają głównie składniki błony komórkowej, takie jak lipidy, lipoproteiny i białka. Wewnątrzkomórkowe TLR rozpoznają kwasy nukleinowe pochodzące od bakterii i wirusów, a także rozpoznają własne kwasy nukleinowe w stanach chorobowych, takich jak autoimmunizacja.
Funkcja receptora Toll-podobnego zwykle opiera się na procesie dimeryzacji dwóch cząsteczek TLR, ale nie zawsze. Na przykład, TLR-1 i TLR-2 będą wiązać się ze sobą, aby utworzyć dimer, gdy rozpoznają cząsteczki PAMPs głównie obejmujące lipoproteiny, peptydoglikany, kwasy lipotechniczne (LTA, Gram-), zymosan, mannan i tGPI-mucynę. TLR-2 może również tworzyć dimer z TLR-6, gdy rozpoznają one te same PAMP wymienione powyżej. TLR-4 może rozpoznawać lipopolisacharyd (LPS, Gram+) i tworzyć homodimer z inną cząsteczką TLR-4. TLR-5 może rozpoznawać bakteryjną flagelinę, ale nie tworzą one dimeru. TLR-11 jest funkcjonalny u myszy i rozpoznaje głównie bakterie uropatogenne. TLR-3, 7, 8, 9, 13 ulegają ekspresji na powierzchni endosomów w cytoplazmie. TLR3 rozpoznaje wirusowe dwuniciowe RNA (dsRNA), małe interferuj±ce RNA i własne RNA pochodz±ce z uszkodzonych komórek. TLR-7 ulega ekspresji głównie w plazmacytoidalnych DCs (pDCs) i rozpoznaje jednoniciowy (ss) RNA pochodzący z wirusów. Rozpoznaje również RNA z bakterii paciorkowca B w konwencjonalnych DCs (cDCs). TLR8 reaguje na wirusowe i bakteryjne RNA. TLR-9 rozpoznaje bakteryjne i wirusowe DNA, które jest bogate w niemetylowane motywy CpG-DNA. TLR13 rozpoznaje bakteryjny 23S rRNA i nieznane składniki wirusa pęcherzykowego zapalenia jamy ustnej.
Mimo, że istnieje tak wiele typów cząsteczek TLR, które rozpoznają szeroki zakres ligandów, wszystkie te TLR mają wspólne ramy strukturalne w swoich zewnątrzkomórkowych domenach wiążących ligandy. Wszystkie te domeny przyjmuj± struktury w kształcie podkowy zbudowane z motywów powtórzeń bogatych w leucynę. Zazwyczaj, po związaniu liganda, dwie domeny zewnątrzkomórkowe tworzą dimer w kształcie litery „m”, który przekłada cząsteczkę liganda, zbliżając do siebie domeny transmembranowe i cytoplazmatyczne i uruchamiając kaskadę sygnałową (Rysunek 2).
Scieżka sygnałowa receptora Toll-podobnego
1. Kaskada sygnalizacyjna receptorów Toll-podobnych
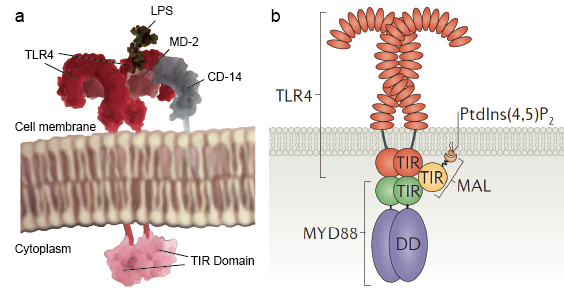
Receptory Toll-podobne umożliwiają komórkom czuciowym, takim jak makrofagi, wykrywanie mikrobów poprzez PAMP, takie jak LPS. LPS jest składnikiem ściany komórkowej bakterii. Mechanizm rozpoznawania lipopolisacharydu przez receptory Toll-podobne jest złożony i wymaga udziału kilku białek pomocniczych. Białko surowicy, białko wiążące LPS, wiąże monomery LPS i przenosi je do białka zwanego CD14. CD14 może być rozpuszczalne lub wiązać się z powierzchnią komórki poprzez kotwicę glikozylofosfatydyloinozytolową. CD 14 dostarcza i ładuje LPS do zewnątrzkomórkowej domeny receptorów Toll-podobnych. TLR są w stanie wykryć LPS przy pomocy białka pomocniczego o nazwie MD-2. Homodimeryzacja TLR jest indukowana, gdy LPS zwi±zuje się z kompleksem TLR-CD14-MD2. Zmiana konformacyjna domen zewnątrzkomórkowych inicjuje dimeryzację cytoplazmatycznej domeny receptora Toll IL-1 (TIR). Zmiana konformacyjna TIR stanowi nowe rusztowanie, które umożliwia rekrutację białek adaptorowych w celu utworzenia postreceptorowego kompleksu sygnałowego. TIR zawiera białko adaptorowe myeloid differentiation primary-response protein 88 (MyD88).
MyD88 funkcjonuje jako adaptor łączący TLRs/IL-1Rs z cząsteczkami sygnałowymi downstream, które mają DDs. Rozpoznaje zmianę konformacyjną w domenie TIR TLRs, wiąże się z nowym kompleksem receptorowym i przenosi sygnalizację poprzez interakcję aminowej (N)-końcowej domeny śmierci (DD) z kinazami związanymi z IL-1R (IRAKs). W ten sposób powstaje złożona kaskada sygnałów, która ostrzega komórkę przed inwazją patogenu. Istniej± 4 IRAKs (IRAK 1, 2, 4, M). Zawierają one N-końcowy DD i centralną domenę serynowo-treoninową kinazy. IRAK1 i IRAK4 mają wewnętrzną aktywność kinazową, podczas gdy IRAK2 i IRAK-M nie mają wykrywalnej aktywności kinazowej. IRAK4 jest aktywowany przez MyD88 i dalej aktywuje IRAK1. IRAK1 następnie aktywuje downstream TRAF6. TRAF6 jest członkiem rodziny TRAF (tumor necrosis factor receptor – TNFR), która pośredniczy w szlakach sygnałowych cytokin. Po stymulacji, TRAF6 jest rekrutowany do kompleksu receptorowego i aktywowany przez IRAK-1, który wiąże się z domeną TRAF w TRAF6. Następnie kompleks IRAK-1/TRAF6 odłącza się od receptora i łączy się z kinazą 1 aktywowaną przez TGF-beta (TAK1) oraz białkami wiążącymi TAK1, TAB1 i TAB2. Kompleks TRAF6, TAK1, TAB1 i TAB2 przechodzi do cytoplazmy, gdzie tworzy duży kompleks z innymi białkami, takimi jak ligazy E2 Ubc13 i Uev1A. Wykazano, że kompleks Ubc13 i Uev1A katalizuje syntezę łańcucha polibikwitynowego TRAF6 związanego z Lys 63 i w ten sposób indukuje TRAF6-mediowaną aktywację TAK1 i w końcu NF-kB. Opisane powyżej szlaki sygnałowe nazywane są szlakami MyD88-zależnymi, ponieważ sygnał pochodzi z cząsteczki MyD88. Istnieje również inna ścieżka, zwana ścieżką MyD88-independedt, w której sygnalizacja nie rozpoczyna się od MyD88. Zamiast tego, sygnał zaczyna się od białka TRIF. TRIF oddziałuje z TRAF6 i TRAF3. TRAF6 rekrutuje kinazę RIP-1, która z kolei oddziałuje z kompleksem TAK1 i aktywuje go, co prowadzi do aktywacji NF-kB i MAPK oraz indukcji cytokin zapalnych. Z kolei TRAF3 rekrutuje kinazy związane z IKK -TBK1 i IKKi wraz z NEMO do fosforylacji i aktywacji IRF3. IRF3 tworzy dimer i przenosi się do jądra z cytoplazmy, indukując ekspresję IFN typu I.
2. Sygnalizacja downstream
TLR sygnalizują właściwie głównie poprzez rekrutację specyficznych cząsteczek adaptorowych, prowadząc do aktywacji czynników transkrypcyjnych NF-kB i IRFs, które dyktują wynik wrodzonych odpowiedzi immunologicznych. Tak więc ten szlak downstream sygnalizuje aktywację czynnika transkrypcyjnego IRFs, szlaku sygnalizacyjnego NF-kB i szlaku MAKP. Możesz znaleźć więcej szczegółowych informacji na temat szlaku NF-kB i MAKP z:
Scieżka sygnalizacyjna NF-kB, ścieżka sygnalizacyjna P38 i ścieżka sygnalizacyjna MAKP.
3. Regulacja szlaku
Przyczyną jest pewna negatywna regulacja przez szereg cząsteczek poprzez różne mechanizmy, aby zapobiec lub zakończyć nadmierne reakcje immunologiczne, które prowadzą do szkodliwych konsekwencji związanych z autoimmunologią i chorobami zapalnymi. Aktywacja szlaku zależnego od MyD88 jest tłumiona przez ST2825, SOCS1 i Cbl-b, a aktywacja szlaku zależnego od TRIF jest tłumiona przez SARM i TAG. Cząsteczki te wiążą się z MyD88 lub TRIF, aby uniemożliwić im wiązanie się z TLR lub z cząsteczkami downstream. Aktywacja TRAF3 jest negatywnie regulowana przez SOCS3 i DUBA. TRAF6 jest ukierunkowany przez szereg cząsteczek hamujących, takich jak A20, USP4, CYLD, TANK, TRIM38 i SHP. Aktywacja TAK1 jest hamowana przez TRIM30a i A20.
4. Związek z chorobami
Jako że TLR jest zaangażowany w wyczuwanie LPS i może mieć rolę w sepsie, ukierunkowanie TLR jest ważne w leczeniu kilku chorób. Poza zakłócaniem odpowiedzi TLR w celu leczenia infekcji patogenami, oczywistym klinicznym zastosowaniem wiedzy uzyskanej z badań nad TLR było wykorzystanie ligandów TLR jako adiuwantów szczepionek. Co więcej, w klinice podjęto również próby inhibicji TLR, której celem jest ograniczenie nadmiernego stanu zapalnego, który przypuszczalnie jest napędzany przez nadmierną aktywację konkretnego TLR.
| Takeda, Kiyoshi, and Shizuo Akira. „TLR signaling pathways.” Seminars in immunology. Vol. 16. No. 1. Academic Press, 2004. | |
| Akira, Shizuo, and Kiyoshi Takeda. „Toll-like receptor signalling.” Nature reviews immunology 4.7 (2004): 499-511. | |
| Lim, Kian-Huat, and Louis M. Staudt. „Toll-like receptor signaling.” Cold Spring Harbor perspectives in biology 5.1 (2013): a011247. | |
| iTaro Kawai, Takumi Kawasaki. „Ścieżki sygnalizacyjne receptorów Toll-podobnych.” Pattern Recognition Receptors and Cancer 8916 (2015): 7. | |
| Gay, Nicholas J., et al. „Assembly and localization of Toll-like receptor signalling complexes.” Nature reviews Immunology 14.8 (2014): 546-558. | |
| O’Neill, Luke AJ, Douglas Golenbock, and Andrew G. Bowie. „The history of Toll-like receptors redefining innate immunity.” Nature Reviews Immunology 13.6 (2013): 453-460. | |
| Botos, Istvan, David M. Segal, and David R. Davies. „The structural biology of Toll-like receptors.” Structure 19.4 (2011): 447-459. |
.