Ionization Energies of s- and p-Block Elements
Energie jonizacji pierwiastków z trzeciego rzędu układu okresowego wykazują ten sam wzór, co energie jonizacji pierwiastków (Li) i (Be) (tabela \): kolejne energie jonizacji wzrastają systematycznie w miarę usuwania elektronów z orbitali walencyjnych (3s lub 3p, w tym przypadku), po czym następuje szczególnie duży wzrost energii jonizacji, gdy elektrony są usuwane z wypełnionych poziomów rdzeniowych, jak wskazuje pogrubiona linia ukośna w tabeli \(\PageIndex{2}}). Tak więc w trzecim rzędzie układu okresowego, największy wzrost energii jonizacji odpowiada usunięciu czwartego elektronu z Al, piątego elektronu z Si, i tak dalej – czyli usunięcie elektronu z jonu, który ma konfigurację elektronu walencyjnego poprzedniego gazu szlachetnego. Ten schemat wyjaśnia, dlaczego chemia pierwiastków zwykle obejmuje tylko elektrony walencyjne. Zbyt dużo energii jest wymagane, aby albo usunąć, albo podzielić się wewnętrznymi elektronami.
| Pierwiastek | (I_1) | (I_2) | (I_3) | (I_4\) | (I_5\) | (I_6\) | (I_7\) | |
|---|---|---|---|---|---|---|---|---|
| *Elektron z wewnętrznejpowłoki elektronu | ||||||||
| Na | 495.8 | 4562.4* | – | – | – | – | ||
| Mg | 737.7 | 1450.7 | 7732.7 | – | – | – | ||
| Al | 577.4.4 | 1816.7 | 2744.8 | 11,577.4.4 | – | – | ||
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16,090.6 | – | – | |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – | |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4.3 | |
| Cl | 1251.2 | 2297.7 | 3822 | 5158.6 | 6540 | 9362 | 11 018.2 | |
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 | |
Przykład: Najwyższa czwarta energia jonizacji
W oparciu o ich położenie w układzie okresowym, przewidz, który z tych pierwiastków ma najwyższą czwartą energię jonizacji: B, C, czy N.
Dane: trzy pierwiastki
Pytanie: pierwiastek o najwyższej czwartej energii jonizacji
Strategia:
- Podaj konfigurację elektronową każdego pierwiastka.
- Określ, czy elektrony są usuwane z wypełnionej, czy częściowo wypełnionej powłoki walencyjnej. Przewidzieć, który element ma najwyższą czwartą energię jonizacji, uznając, że najwyższa energia odpowiada usuwaniu elektronów z wypełnionego jądra elektronowego.
Rozwiązanie:
A Wszystkie te pierwiastki leżą w drugim rzędzie układu okresowego i mają następujące konfiguracje elektronowe:
- B: 2s22p1
- C: 2s22p2
- N: 2s22p3
B Czwarta energia jonizacji pierwiastka (I_4) jest zdefiniowana jako energia potrzebna do usunięcia czwartego elektronu:
Ponieważ węgiel i azot mają odpowiednio cztery i pięć elektronów walencyjnych, ich czwarte energie jonizacji odpowiadają usunięciu elektronu z częściowo zapełnionej powłoki walencyjnej. Czwarta energia jonizacji dla boru, jednakże, odpowiada usunięciu elektronu z wypełnionej podpowłoki 1s2. Powinno to wymagać znacznie więcej energii. Rzeczywiste wartości są następujące: B, 25,026 kJ/mol; C, 6223 kJ/mol; i N, 7475 kJ/mol.
Ćwiczenie: Lowest Second Ionization Energy
Na podstawie ich położenia w układzie okresowym, przewidz, który z tych pierwiastków ma najniższą energię drugiej jonizacji: Sr, Rb, czy Ar.
Odpowiedź
Pierwsza kolumna danych w tabeli pokazuje, że energie pierwszej jonizacji mają tendencję do wzrostu w całym trzecim rzędzie układu okresowego. Dzieje się tak dlatego, że elektrony walencyjne nie ekranują się wzajemnie zbyt dobrze, co pozwala na stały wzrost efektywnego ładunku jądrowego w całym rzędzie. Elektrony walencyjne są więc silniej przyciągane do jądra, przez co rozmiary atomów maleją, a energie jonizacji rosną. Efekty te stanowią dwie strony tej samej monety: silniejsze oddziaływania elektrostatyczne pomiędzy elektronami i jądrem dodatkowo zwiększają energię potrzebną do usunięcia elektronów.
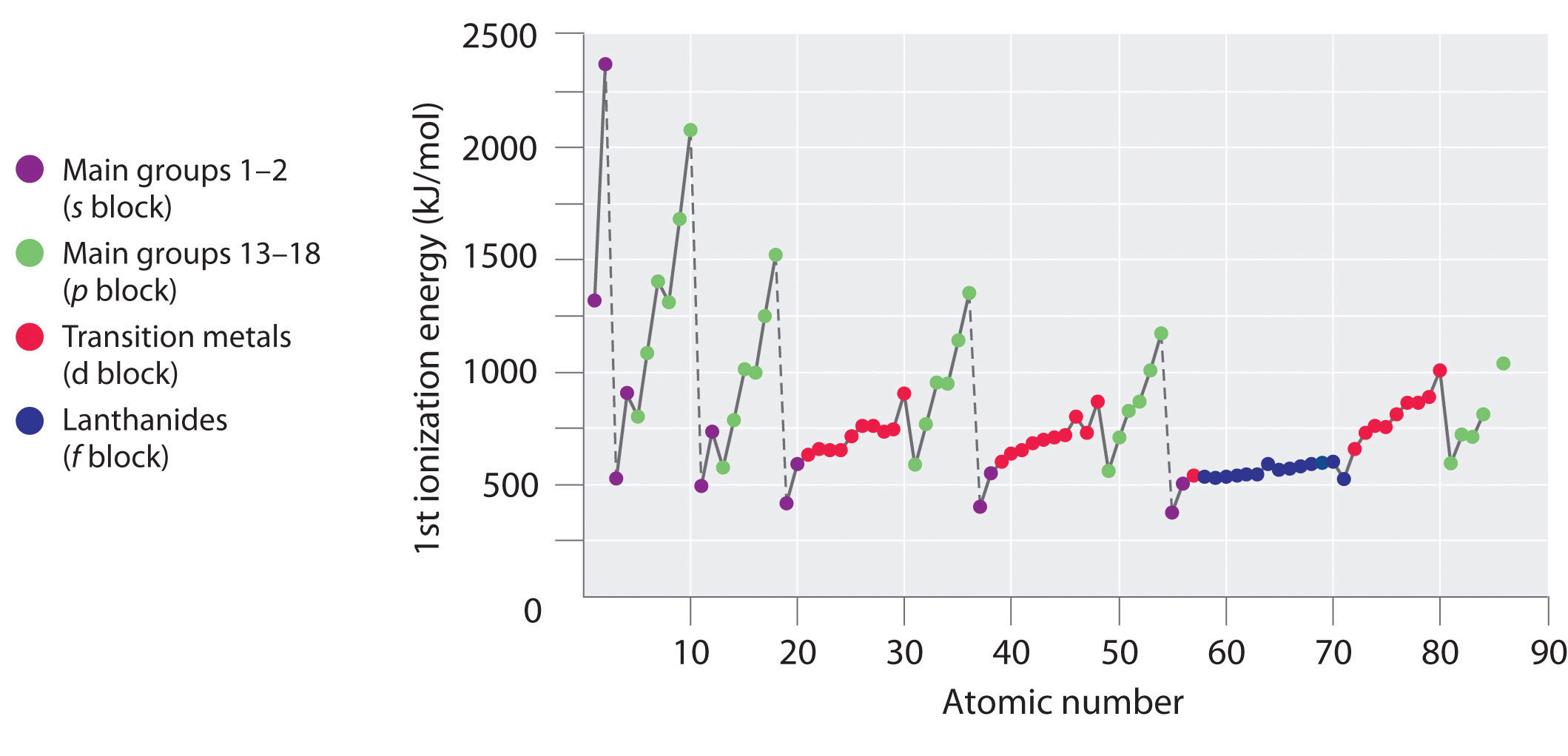
Jednakże pierwsza energia jonizacji maleje przy Al (3s23p1) i przy S (3s23p4). Konfiguracje elektronowe tych „wyjątków” dają odpowiedź dlaczego. Elektrony w wypełnionej podpowłoce 3s2 aluminium są lepsze w ekranowaniu elektronu 3p1 niż w ekranowaniu siebie nawzajem od ładunku jądrowego, więc elektrony s wnikają bliżej jądra niż elektron p, a elektron p jest łatwiej usuwany. Zmniejszenie przy S następuje, ponieważ dwa elektrony na tym samym orbitalu p odpychają się wzajemnie. Powoduje to, że atom S jest nieco mniej stabilny niż można by się spodziewać, co dotyczy wszystkich pierwiastków grupy 16.
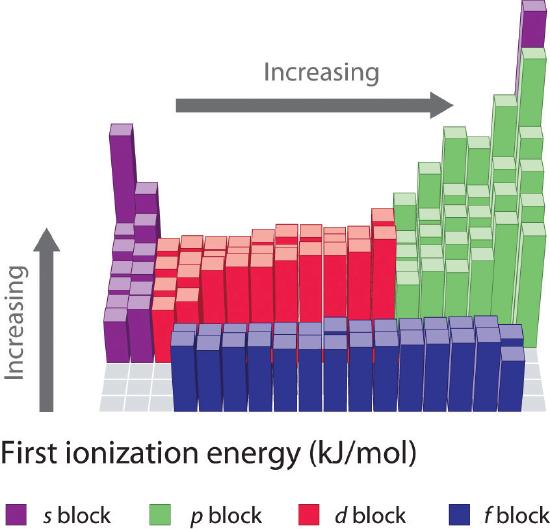
Energie pierwszej jonizacji pierwiastków z pierwszych sześciu rzędów układu okresowego są wykreślone na rysunku (\PageIndex{1}}) i przedstawione numerycznie i graficznie na rysunku (\PageIndex{2}}). Rysunki te ilustrują trzy ważne tendencje:
- Zmiany widoczne w drugim (Li do Ne), czwartym (K do Kr), piątym (Rb do Xe) i szóstym (Cs do Rn) rzędzie bloków s i p przebiegają według schematu podobnego do opisanego dla trzeciego rzędu układu okresowego. Metale przejściowe są jednak zawarte w czwartym, piątym i szóstym rzędzie, a lantanowce są zawarte w szóstym rzędzie. Pierwsze energie jonizacji metali przejściowych są nieco podobne do siebie, podobnie jak energie lantanowców. Energie jonizacji wzrastają od lewej do prawej w każdym rzędzie, z rozbieżnościami występującymi przy ns2np1 (grupa 13), ns2np4 (grupa 16) i ns2(n – 1)d10 (grupa 12).
- Pierwsze energie jonizacji na ogół maleją w dół kolumny. Chociaż główna liczba kwantowa n wzrasta w dół kolumny, wypełnione powłoki wewnętrzne są skuteczne w ekranowaniu elektronów walencyjnych, więc jest stosunkowo niewielki wzrost w efektywnym ładunku jądrowym. W konsekwencji, atomy stają się większe w miarę nabywania elektronów. Elektrony walencyjne, które znajdują się dalej od jądra są mniej ciasno związane, przez co łatwiej je usunąć, co powoduje zmniejszenie energii jonizacji. Większy promień zwykle odpowiada niższej energii jonizacji.
- Z powodu pierwszych dwóch tendencji, elementy, które tworzą jony dodatnie najłatwiej (mają najniższe energie jonizacji) leżą w lewym dolnym rogu układu okresowego, podczas gdy te, które są najtrudniejsze do jonizacji leżą w prawym górnym rogu układu okresowego. W związku z tym energie jonizacji na ogół rosną ukośnie od dolnego lewego (Cs) do górnego prawego (He).

Generalnie, energia jonizacji wzrasta ukośnie od lewej dolnej części układu okresowego do prawej górnej.
Gal (Ga), który jest pierwszym pierwiastkiem następującym po pierwszym rzędzie metali przejściowych, ma następującą konfigurację elektronową: 4s23d104p1. Jego energia pierwszej jonizacji jest znacznie niższa niż energia bezpośrednio poprzedzającego go pierwiastka, cynku, ponieważ wypełniona podpowłoka 3d10 galu leży wewnątrz podpowłoki 4p, osłaniając pojedynczy elektron 4p od jądra. Eksperymenty ujawniły coś jeszcze bardziej interesującego: drugi i trzeci elektron, który jest usuwany podczas jonizacji galu pochodzi z orbitalu 4s2, a nie z podpowłoki 3d10. Chemia galu jest zdominowany przez jon Ga3+, z jego konfiguracji elektronowej 3d10. Ten i podobne konfiguracje elektronowe są szczególnie stabilne i są często spotykane w cięższych elementów p-blok. Są one czasami określane jako pseudo konfiguracje gazu szlachetnego. W rzeczywistości, dla pierwiastków, które wykazują te konfiguracje, nie są znane związki chemiczne, w których elektrony są usuwane z (n – 1)d10 wypełnionej podpowłoki.